Bestemmelse av relativ celle overflaten og Total ekspresjon av rekombinante ionekanaler ved hjelp av flowcytometri
Summary
Arvet hjertearytmier er ofte forårsaket av mutasjoner som endrer overflate levering av én eller flere ionekanaler. Her, tilpasse vi flowcytometri analyser for å tilveiebringe en kvantifisering av den relative totale og celleoverflate-protein ekspresjon av rekombinante ionekanaler uttrykt i TSA-201-celler.
Abstract
Inherited or de novo mutations in cation-selective channels may lead to sudden cardiac death. Alteration in the plasma membrane trafficking of these multi-spanning transmembrane proteins, with or without change in channel gating, is often postulated to contribute significantly in this process. It has thus become critical to develop a method to quantify the change of the relative cell surface expression of cardiac ion channels on a large scale. Herein, a detailed protocol is provided to determine the relative total and cell surface expression of cardiac L-type calcium channels CaV1.2 and membrane-associated subunits in tsA-201 cells using two-color fluorescent cytometry assays. Compared with other microscopy-based or immunoblotting-based qualitative methods, flow cytometry experiments are fast, reproducible, and large-volume assays that deliver quantifiable end-points on large samples of live cells (ranging from 104 to 106 cells) with similar cellular characteristics in a single flow. Constructs were designed to constitutively express mCherry at the intracellular C-terminus (thus allowing a rapid assessment of the total protein expression) and express an extracellular-facing hemagglutinin (HA) epitope to estimate the cell surface expression of membrane proteins using an anti-HA fluorescence conjugated antibody. To avoid false negative, experiments were also conducted in permeabilized cells to confirm the accessibility and proper expression of the HA epitope. The detailed procedure provides: (1) design of tagged DNA (deoxyribonucleic acid) constructs, (2) lipid-mediated transfection of constructs in tsA-201 cells, (3) culture, harvest, and staining of non-permeabilized and permeabilized cells, and (4) acquisition and analysis of fluorescent signals. Additionally, the basic principles of flow cytometry are explained and the experimental design, including the choice of fluorophores, titration of the HA antibody and control experiments, is thoroughly discussed. This specific approach offers objective relative quantification of the total and cell surface expression of ion channels that can be extended to study ion pumps and plasma membrane transporters.
Introduction
Dette papir gir en pålitelig analyse for å rapportere relativ celleoverflate-ekspresjon av membranproteiner slik som ionekanaler uttrykt i rekombinante celler ved bruk av eksisterende teknologi flowcytometri. Ionekanaler er poredannende membranproteiner som er ansvarlig for styring av elektriske signaler ved å portstyre strømmen av ioner gjennom cellemembranen. De blir klassifisert av aktiveringsmekanismen, natur, og selektiviteten til ion-arter i transitt gjennom porene hvor de er lokalisert. På de cellulære og vev nivåer, de makroskopiske ion fluks gjennom ionekanaler er et produkt av biofysiske (gating og gjennomtrengning), biokjemisk (fosforylering), og biogenesis (syntese, glykosylering, trafficking, og nedbrytning) eiendommer 1. Hver av disse prosessene er unik for hver type av ionekanaler og er optimalisert for å oppfylle den fysiologiske rollen til ionekanal. Følgelig, endringer i noen av disse finjusterte prosesser gjennom enarvet eller en genetisk modifikasjon, ofte referert til som "ionekanalsvikt", kan være skadelig for celle homeostase. Det er viktig å understreke at levere den "riktige" mengde av ionekanaler på celleoverflaten er kritisk for celle homeostase. Selv små økninger (gain-of-funksjon) og små reduksjoner (tap-av-funksjon) i ionekanal aktivitet har potensial til å forårsake en alvorlig patologi over livsløpet. Defekter i celleoverflaten levering av modne ionekanaler er en viktig determinant i en rekke kanalopatier, som cystisk fibrose (CFTR ion kanal) 2 og hjertearytmier av lang QT-syndrom form (kardiale kaliumkanaler) 3.
Kanalopatier er assosiert med hjerte plutselig død 4. Den nåværende globale utbredelsen av alle hjerte kanalopatier antas å være minst 1: 2,000-1: 3000 per individ 5 og er ansvarlig for omtrent halvparten av plutselige arytmisk hjertedød cases 6. Dysfunksjon i hjerte de spenningsstyrte natrium, kalium- og kalsium-selektive ionekanaler er kjent for å spille en nøkkelrolle i denne prosessen. Den L-type Ca V 1.2 de spenningsstyrte kalsiumkanal er nødvendig for å initiere synkronisert hjertemuskelsammentrekning. Kardiale L-type Ca V 1.2 kanal er en multi-underenhet-protein-komplekset som består av de viktigste poredannende Ca V α1-subenheten og Ca V ß og Ca V α2δ1 tilleggs subenheter 7-12. Vær oppmerksom på at full bemanning av hjelpe subenheter er nødvendig for å produsere funksjonelle Ca V 1.2 kanaler på plasmamembranen og dynamiske samspillet mellom disse underenhetene er viktig å støtte den normale elektriske funksjon av hjertet 13. Ca V ß fremmer celleoverflate-ekspresjon av Ca V 1.2 kanaler gjennom et ikke-kovalent nanomolar hydrofob interaksjon 14. Co-uttrykk for Ca V α2δ1 subenhet with Ca V ß-bundet Ca V α1 stimulerer peak strøm uttrykk (5-10 ganger) og fremmer kanal aktivering ved flere negative spenninger. Gain-av-funksjon mutasjoner av den poredannende subenhet Ca V 1.2 har vært forbundet med en form av ventrikulære arytmier som kalles forlenget QT-syndrom 15, mens en rekke av punktmutasjoner i de tre viktigste subenheter som danner L-type Ca V 1.2 kanal det er identifisert hos personer som lider av arytmier av kort QT-syndrom skjema 16,17. Ionekanaler er membranproteiner som kan undersøkes fra et biokjemisk perspektiv (protein kjemi) eller ved bruk av elektroverktøy (strømgenererende maskiner) og ofte ved hjelp av disse komplementære tilnærminger. Elektro, spesielt hel-celle patch-fastspenning, er en passende metode for å klargjøre funksjonen av ionekanaler 15, men kan ikke løse endringer i protein handel fra endringer i deres biofysiskeegenskaper. Protein kjemi har imidlertid ofte begrenset bruk på grunn av den relativt lave ekspresjon av store membranproteiner i forhold til mindre oppløselige proteiner. Robuste high-throughput metoder ved hjelp av fluorescens avlesning må utvikles for å spesielt ta opp mangler i protein biogenesis forårsaker endringer i celleoverflaten uttrykk for ionekanaler.
Flowcytometri er en biofysisk teknologi ansatt i celle telling, sortering, biomarkør oppdagelse, og protein engineering 18. Når en prøveoppløsning av levende celler eller partikler injiseres i et flowcytometer, blir cellene organisert til en enkelt strøm som kan bli probet ved maskinens deteksjonssystem (figur 1). Den første strømningscytometer instrument fremstilt i 1956 19 detektert bare en parameter, men moderne væskestrømsfotometere har flere lasere og fluorescens-detektorer som tillater påvisning av mer enn 30 fluoriserende parametere 20,21.Filtre og speil (utslipps optikk) dirigere lysspredning eller fluorescerende lys av celler til et elektronisk nettverk (fotodiode og detektorer) som konverterer lys proporsjonalt med intensiteten. Digitale data er analysert ved hjelp av spesialisert programvare og den primære effekt vises som et prikkplott 21.
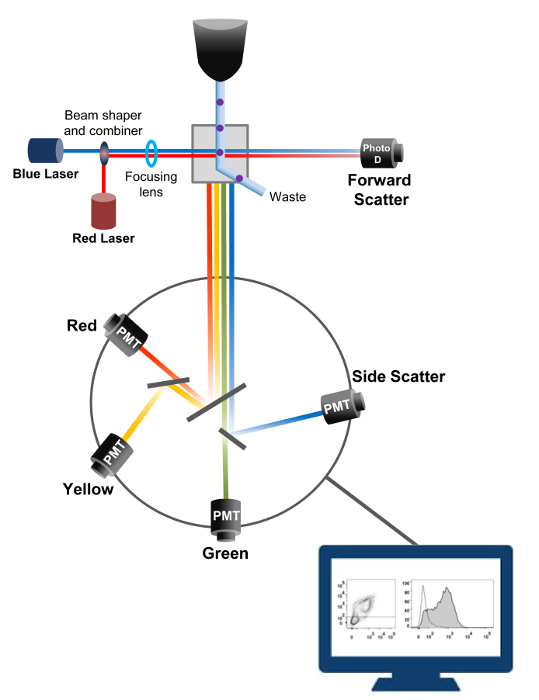
Fig. 1: Biofysiske prinsippene ved flowcytometri sortering Enkeltceller blir presset gjennom en dyse under høyt trykk i en strøm av skjermfluid som beveger dem på tvers av ett eller flere laserutspørrings poeng. Lysstrålen avbøyes av de passerende celler, og lyset samles i fremoverretningen (fremover diffusjon, FCS) blir sendt til en fotodiode som omdanner lys til et signal proporsjonalt med størrelsen av cellen. Lyset er også samlet i en 90 ° vinkel til laser banen og sendt til detektorene (også kalt fotomultiplikatorer (PMT)).Dette lyset ledes gjennom dikroiske speil som tillater påvisning av sidespredningssignalet (SSC), som gjenspeiler den detaljnivået i cellene, og de fluorescerende utslipp hvis eksiterte fluorokromer er til stede i cellen. Tre detektorer (grønn, gul, og rød) er representert med ulike bølgelengde båndpassfiltre, slik at den samtidig påvisning av ulike fluorokromer. De forskjellige signalene digitalisert av en ekstern datamaskin og konvertert til data som vil bli analysert for å kvantifisere egenskapene til cellene. Klikk her for å se en større versjon av dette tallet.
Den high-throughput kapasitet på flowcytometere ble utnyttet til å kvantifisere den relative membran uttrykk av rekombinant villtype og trafficking-mangelfull spennings gated L-type Ca V 1.2 kanaler og tilhørende underenhetene i levende celler. cDNA konstruerer coding for proteinene var dobbelt merket for samtidig å bære en ekstracellulær ikke-fluoriserende epitop som kan oppdages ved hjelp av en ugjennomtrengelig fluorescerende antistoff og et intracellulært fluorofor som er konstitutivt fluorescerende. Både den ekstracellulære epitop, innføres i et ekstracellulært løkke av proteinet, og den intracellulære fluorofor, innføres etter den C-terminale enden, blir omregnet med proteinet. I denne serien av forsøk ble Ca V α2δ1 proteinet konstruert for å uttrykke et ekstracellulært hemagglutinin (HA) epitop (YPYDVPDYA) som detekteres ved hjelp av en ugjennomtrengelig FITC (fluoresceinisotiocyanat) -konjugert anti-HA og mCherry som den indre intracellulære fluoroforen. For å bestemme den relative celleoverflate-ekspresjon nivået av mCherry-Ca V α2δ1 HA-kodede protein, ble rekombinante celler som uttrykker fusjonsproteinet høstet etter transfeksjon, og farget med FITC-konjugert mus monoklonalt anti-HA-epitop tag antibody (figur 2). FITC er en organisk fluorescerende stoff som er betydelig mindre enn enzym journalister og derfor ikke så sannsynlig å påvirke biologisk funksjon. mCherry- Ca V α2δ1-HA overexpressed i TSA-201cells, produserer en betydelig tre-log økning i FITC fluorescens og mCherry fluorescens på todimensjonale plott 22. Gitt at HA-epitop er lokalisert i den ekstracellulære del av proteinet, fluorescensintensiteten for FITC oppnådd i nærvær av intakte celler gjenspeiler den relative indeksen til celleoverflate-ekspresjon av HA-kodede protein. Tilgjengeligheten av HA-epitop i konstruksjonene er systematisk validert ved å måle FITC signal etter celle permeabilization. Dette tiltaket tjener også til å underbygge den normaliserte totale protein ekspresjon, siden de relative intensiteter for FITC fluorescens estimert i permeabiliserte celler er kvalitativt sammenlignbare med de relative fluorescens-verdier for mCherry målt under permeabilized og ikke-permeabilized forhold 22,23. Det er viktig å merke seg at den indre fluorescens-spekteret er forskjøvet mot høyere verdier etter permeabiliseringen men at den eneste verdi som rapporteres er endringen i fluorescens-intensitet sammenlignet med kontroll-konstruksjonen. Relative endringer i fluorescens intensitet for test konstruksjoner blir estimert ved hjelp av ΔMean fluorescensintensitet (ΔMFI) verdier for hver fluorophore (mCherry eller FITC). Eksperimenter er utformet for å måle fluorescensintensiteten av test konstruksjonen i forhold til fluorescensintensiteten av styre konstruksjonen uttrykt under de samme betingelser for å begrense eksperimentelle variasjoner i den indre fluorescens av det fluorofor-konjugert antistoff. To membranproteiner ble med hell undersøkt ved hjelp av denne analysen: den poredannende subenhet av L-typen de spenningsstyrte kalsiumkanal Ca V 1,2 14,22 og i en annen serieeksperimenter, den ekstracellulære hjelpe Ca V α2δ1 subenhet 22,23. Den følgende protokoll ble anvendt for å bestemme celleoverflate-ekspresjon av Ca V α2δ1 subenheten til hjerte L-type Ca V 1,2 kanalen under kontrollbetingelser, og etter mutasjoner som påvirker posttranslasjonell modifikasjon av ionekanal. Under standardiserte eksperimentelle betingelser, celleoverflaten fluorescensen av FITC øker kvasi-lineært med ekspresjon av cDNA som koder for de mCherry-Ca V α2δ1-HA-proteiner (figur 5 fra referanse 22).
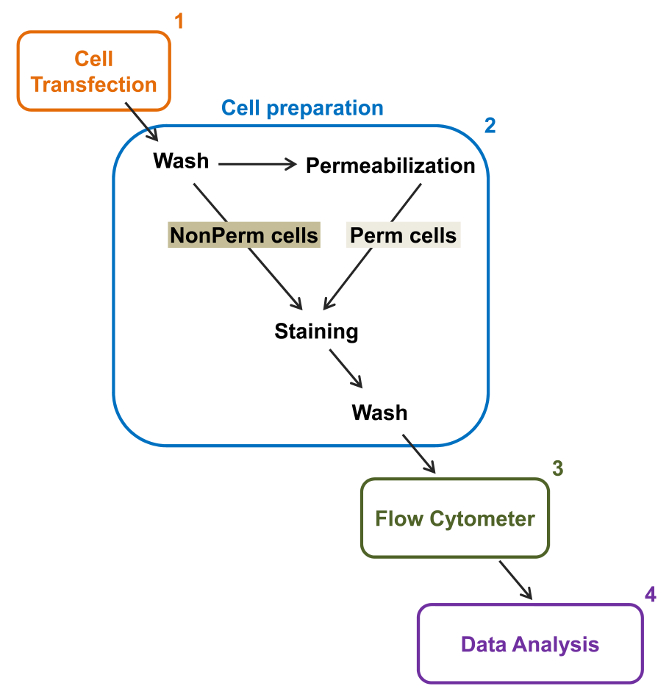
Fig. 2: Skjematisk representasjon av total og membranmerking i flowcytometri forsøksprotokoll Ordningen skisserer noen av de hovedtrinn som er nødvendige for å kvantifisere den relative totale og celleoverflate-ekspresjon av rekombinante ionekanaler etter flow cytometri. Cellene transfektert med dobbel-taggede konstruksjon mCherry-Ca V α2δ1-HA i TSA-201 celler (1) og farget før eller etter permeabilization (2). Funksjoner med flere data er kjøpt i et flowcytometer (3) for multivariat analyse (4). Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Dette flowcytometri-baserte analysen ble med hell anvendt til måling av relativ total og celleoverflate nivåer av fluorescens-merkede poredannende og tilhørende subenheter av spenningsstyrte kalsiumkanaler 14,22,26. Det er best å bruke når undersøke virkningen av genetiske mutasjoner og således krever at den indre fluorescens intensiteten av det fluorescens-merkede merket villtype-konstruksjonen være minst 10 til 100 ganger større enn for fluorescensintensiteten av det fluorescens-merkede ukodede kon…
Declarações
The authors have nothing to disclose.
Acknowledgements
We thank Mr. Serge Sénéchal and Dr. Jacques Thibodeau for sharing their expertise and granting us access to their flow cytometry and cell sorting platform. This work was completed with the operating grant 130256 from the Canadian Institutes of Health Research, a grant-in-aid from the Canadian Heart and Stroke Foundation, and support from the “Fondation de l’Institut de Cardiologie de Montréal” to L.P.
Materials
| Q5 Site-Directed Mutagenesis Kit | New England Biolabs | E0554S | Can be substitute with QuickChange site-directed mutagenesis Kit (Agilent, #200523). |
| Tubes 1,5 mL | Sarstedt | 72-690-001 | |
| Tubes 15 mL | Sarstedt | 62-554-002 | |
| Disposable graduated Tranfer Pipets | VWR | 160001-192 | |
| 100-mm culture dish | Corning | 430167 | For standard culture of HEKT cells. |
| 35-mm culture dish | Falcon | 353001 | For standard culture of HEKT cells. |
| Serological pipette 1 ml | Sarstedt | 86.1251.001 | |
| Serological pipette 5 ml | Sarstedt | 86.1253.001 | |
| Serological pipette 10 ml | Sarstedt | 86.1254.001 | |
| Serological pipette 25ml | Sarstedt | 86.1285.001 | |
| Dulbecco's high-glucose medium | Life Technologies | 12100-046 | Warm in 37°C water bath before use. |
| Fetal Bovine Serum, qualified, heat inactivated, US origin | Life Technologies | 16140-071 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140-122 | |
| Lipofectamine 2000 | Life Technologies | 11668-019 | For liposomal transfection. Can be substituted with calcium phosphate transfection. |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 31985-070 | Warm in 37°C water bath before use. |
| Trypsin-EDTA (1X) 0.05%, phenol red | Life Technologies | 25300-062 | |
| 1.5 mL microtubes | Sarstedt | 72.690.001 | |
| Phosphate Buffered Saline 1X | Fisher | BP661-10 | Can be "home-made". |
| Anti-HA FITC conjugated antibody | Sigma | H7411 | |
| IgG1−FITC Isotype Control antibody | Sigma | F6397 | |
| BD Cytofix/Cytoperm Fixation/Permeabilization Solution Kit | BD Biosciences | 554714 | Fixation/Permeabilization. Permeabilization/Wash solution, store at 4 °C. |
| Hemacytometer | Fisher | 49105161 | |
| Trypan Blue | Fisher | 15250061 | To access cell viability. |
| Refrigerated Microcentrifuge, 5430R | Eppendorf | A14H172200 | |
| Forma Steri-Cycle CO2 Incubator | Fisher | 370 | |
| Laboratory Platform Rocker | Fisher | 545034 | |
| Water Bath | VWR | 89032-216 | |
| BD FACSARIA III | BD Biosciences | 648282 | Flow cytometer. |
| FlowJo Software v10 | FlowJo | FlowJo v10 Dongle | For data analysis. |
Referências
- Delisle, B. P., Anson, B. D., Rajamani, S., January, C. T. Biology of Cardiac Arrhythmias: Ion Channel Protein Trafficking. Circ. Res. 94, 1418-1428 (2004).
- Birault, V., Solari, R., Hanrahan, J., Thomas, D. Y. Correctors of the basic trafficking defect of the mutant F508del-CFTR that causes cystic fibrosis. Curr Opin Chem Biol. 17, 353-360 (2013).
- Balijepalli, S. Y., Anderson, C. L., Lin, E. C., January, C. T. Rescue of Mutated Cardiac Ion Channels in Inherited Arrhythmia Syndromes. J. Cardiovas Pharm. 56, 113-122 (2010).
- Gargus, J. J. Unraveling Monogenic Channelopathies and Their Implications for Complex Polygenic Disease. Am. J. Hum. Genet. 72, 785-803 (2003).
- Abriel, H., Zaklyazminskaya, E. V. Cardiac channelopathies: Genetic and molecular mechanisms. Gene. 517, 1-11 (2013).
- Behr, E. R., et al. Sudden arrhythmic death syndrome: familial evaluation identifies inheritable heart disease in the majority of families. Eur Heart J. 29, 1670-1680 (2008).
- Catterall, W. A. Structure and regulation of voltage-gated Ca2+ channels. Annu. Rev. Cell Dev.Biol. 16, 521-555 (2000).
- Peterson, B. Z., DeMaria, C. D., Adelman, J. P., Yue, D. T. Calmodulin is the Ca2+ sensor for Ca2+ -dependent inactivation of L- type calcium channels. Neuron. 22, 549-558 (1999).
- Dolphin, A. C. Calcium channel diversity: multiple roles of calcium channel subunits. Curr.Opin.Neurobiol. 19, 237-244 (2009).
- Dai, S., Hall, D. D., Hell, J. W. Supramolecular assemblies and localized regulation of voltage-gated ion channels. Physiol Rev. 89, 411-452 (2009).
- Gao, T., et al. Identification and subcellular localization of the subunits of L-type calcium channels and adenylyl cyclase in cardiac myocytes. J. Biol. Chem. 272, 19401-19407 (1997).
- Carl, S. L., et al. Immunolocalization of sarcolemmal dihydropyridine receptor and sarcoplasmic reticular triadin and ryanodine receptor in rabbit ventricle and atrium. J. Cell Biol. 129, 673-682 (1995).
- Abriel, H., Rougier, J. S., Jalife, J. Ion Channel Macromolecular Complexes in Cardiomyocytes: Roles in Sudden Cardiac Death. Circ. Res. 116, 1971-1988 (2015).
- Bourdin, B., et al. Molecular Determinants of the Cavb-induced Plasma Membrane Targeting of the Cav1.2 Channel. J. Biol. Chem. 285, 22853-22863 (2010).
- Raybaud, A., et al. The Role of the GX9GX3G Motif in the Gating of High Voltage-activated Calcium Channels. J. Biol. Chem. 281, 39424-39436 (2006).
- Burashnikov, E., et al. Mutations in the cardiac L-type calcium channel associated with inherited J-wave syndromes and sudden cardiac death. Heart Rhythm. 7, 1872-1882 (2010).
- Hennessey, J. A., et al. A CACNA1C Variant Associated with Reduced Voltage-Dependent Inactivation, Increased Cav1.2 Channel Window Current, and Arrhythmogenesis. PLoS ONE. 9, e106982 (2014).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Graham, M. D. The Coulter Principle: Foundation of an Industry. J. Lab. Autom. 8, 72-81 (2003).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243, 77-97 (2000).
- Rothe, G., Sack, U., Tarnok, A., Rothe, G. . Cellular Diagnostics. Basics, Methods and Clinical Applications of Flow Cytometry. , 53-88 (2009).
- Bourdin, B., et al. Functional Characterization of Cavalpha2delta Mutations Associated with Sudden Cardiac Death. J. Biol. Chem. 290, 2854-2869 (2015).
- Tetreault, M. P., et al. Identification of glycosylation sites essential for surface expression of the Cavalpha2delta1 subunit and modulation of the cardiac Cav1.2 channel activity. J. Biol. Chem. 291, 4826-4843 (2016).
- Senatore, A., Boone, A. N., Spafford, J. D. Optimized Transfection Strategy for Expression and Electrophysiological Recording of Recombinant Voltage-Gated Ion Channels in HEK-293T Cells. J Vis Exp. (47), (2011).
- Herzenberg, L. A., Tung, J., Moore, W. A., Herzenberg, L. A., Parks, D. R. Interpreting flow cytometry data: a guide for the perplexed. Nat.Immunol. 7, 681-685 (2006).
- Shakeri, B., Bourdin, B., Demers-Giroux, P. O., Sauve, R., Parent, L. A quartet of Leucine residues in the Guanylate Kinase domain of Cavbeta determines the plasma membrane density of the Cav2.3 channel. J Biol Chem. 287, 32835-32847 (2012).
- Morton, R. A., Baptista-Hon, D. T., Hales, T. G., Lovinger, D. M. Agonist- and antagonist-induced up-regulation of surface 5-HT3A receptors. Br. J. Pharmacol. 172, 4066-4077 (2015).
- Hoffmann, C., et al. Fluorescent labeling of tetracysteine-tagged proteins in intact cells. Nat. Protocols. 5, 1666-1677 (2010).
- Cockcroft, C. J., Gamper, N. . Ion Channels: Methods and Protocols. , 233-241 (2013).
- Gonzalez-Gutierrez, G., Miranda-Laferte, E., Neely, A., Hidalgo, P. The Src Homology 3 Domain of the beta-Subunit of Voltage-gated Calcium Channels Promotes Endocytosis via Dynamin Interaction. J. Biol.Chem. 282, 2156-2162 (2007).
- Galizzi, J. P., Borsotto, M., Barhanin, J., Fosset, M., Lazdunski, M. Characterization and photoaffinity labeling of receptor sites for the Calcium channel inhibitors d-cis-diltiazem, (+/-)-bepridil, desmethoxyverapamil, and (+)-PN 200-110 in skeletal muscle transverse tubule membranes. J. Biol.Chem. 261, 1393-1397 (1986).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiol.Rev. 80, 555-592 (2000).
- Sigworth, F. J. The variance of sodium current fluctuations at the node of Ranvier. J Physiol. 307, 97-129 (1980).
- Bailey, M. A., Grabe, M., Devor, D. C. Characterization of the PCMBS-dependent modification of KCa3.1 channel gating. J. Gen. Physiol. 136, 367-387 (2010).
- Fletcher, P. A., Scriven, D. R., Schulson, M. N., Moore, E. D. Multi-Image Colocalization and Its Statistical Significance. Biophys. J. 99, 1996-2005 (2010).
- Lizotte, E., Tremblay, A., Allen, B. G., Fiset, C. Isolation and characterization of subcellular protein fractions from mouse heart. Anal. Biochem. 345, 47-54 (2005).
- Mattheyses, A. L., Simon, S. M., Rappoport, J. Z. Imaging with total internal reflection fluorescence microscopy for the cell biologist. J. Cell Sci. 123, 3621-3628 (2010).
- Yamamura, H., Suzuki, Y., Imaizumi, Y. New light on ion channel imaging by total internal reflection fluorescence (TIRF) microscopy. J. Pharmacol. Sci. 128, 1-7 (2015).
- Wible, B. A., et al. HERG-Lite-R: A novel comprehensive high-throughput screen for drug-induced hERG risk. J. Pharmacol. Toxicol. Methods. 52, 136-145 (2005).
- Wilde, A. A. M., Brugada, R. Phenotypical Manifestations of Mutations in the Genes Encoding Subunits of the Cardiac Sodium Channel. Circ. Res. 108, 884-887 (2011).
- Milano, A., et al. Sudden Cardiac Arrest and Rare Genetic Variants in the Community. Circ Cardiovasc Genet. , (2016).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. G. Immunolabeling artifacts and the need for live-cell imaging. Nat. Meth. 9, 152-158 (2012).

