誘導性T7 RNAポリメラーゼ媒介マルチ遺伝子発現システム、pMGX
Summary
この研究は、pMGXプラスミド系を用いて、 大腸菌(Escherichia coli)における単一のプラスミドからの複数の遺伝子のT7媒介性同時発現のための方法を記載する。
Abstract
合成生物学、タンパク質 – タンパク質複合体の研究、および生合成経路の特徴付けおよび利用には、複数のタンパク質の共発現がますます必要不可欠である。この原稿では、誘導性T7RNAポリメラーゼの制御下にある多重遺伝子合成オペロンの構築のための非常に有効なシステムの使用が記載されている。このシステムは、多くの遺伝子が1つのプラスミドから同時に発現されることを可能にする。ここでは、アンピシリンまたはカナマイシン耐性選択マーカー(AおよびK)のいずれかとN末端ヘキサヒスチジンを有するかまたは欠いている4つの関連ベクターpMGX-A、pMGX-hisA、pMGX-KおよびpMGX-hisKのセットタグ(his)が開示される。 5つの遺伝子を含むpMGXベースのシステムが容易に構築され、 大腸菌で 5つのコードされたタンパク質すべてを産生することができることを示す、このベクターシステムを用いた合成オペロンの構築のための詳細なプロトコールを対応するデータと共に提供する。このシステムemとプロトコルは、研究者が大腸菌で複雑な多成分モジュールと経路を日常的に発現することを可能にする。
Introduction
特に、複数の機能モジュールを発現させなければならない合成生物学アプリケーションでは、複数のタンパク質の共発現がますます必要不可欠となっている。発現および機能がしばしば共発現2,3を必要とするタンパク質 – タンパク質複合体の研究において ;経路中の各遺伝子が4,5,6,7,8で発現されなければならない生合成経路を特徴づけ、利用することにある。特に宿主生物であるエシェリヒア・コリ ( Escherichia coli)において、共発現のための多くの系が開発されている。例えば、異なる選択可能なマーカーを有する複数のプラスミドを使用して、豊富な異なるexプレスベクトル10,11 。複数のタンパク質発現のための単一プラスミド系は、各遺伝子の発現を制御するために複数のプロモーターのいずれかを使用している10,12 ;複数の遺伝子が単一の転写産物にコードされている合成オペロン2,13;場合によっては、最終的にタンパク質分解処理されたポリペプチドをコードする単一の遺伝子を含み、目的の所望のタンパク質14を生じる。
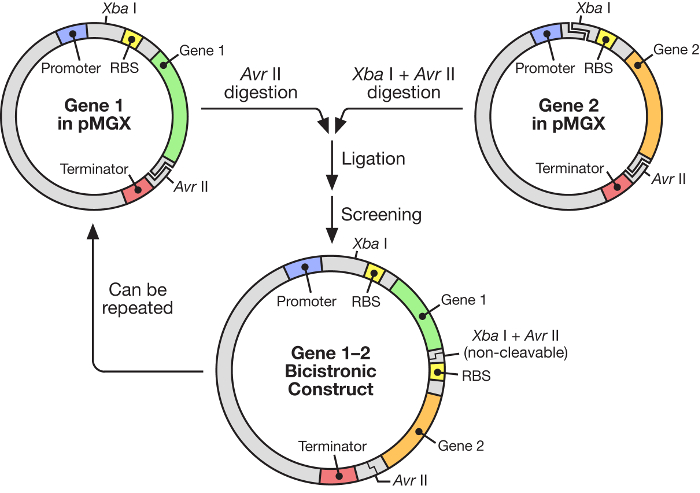
図1:ポリシストロニックベクターの構築を示すpMGXワークフロー。 pMGXシステムは、誘導性T7プロモーターの制御下で合成オペロンの構築のための柔軟で使い易い戦略を提供する。e.com/files/ftp_upload/55187/55187fig1large.jpg "target =" _ blank ">この図の拡大版を表示するには、ここをクリックしてください。
この原稿では、誘導性T7 RNAポリメラーゼ( 図1 )の制御下にある多重遺伝子合成オペロンの構築のための非常に有効なシステムの使用が記載されている。このシステムは、多くの遺伝子が1つのプラスミドから同時に発現されることを可能にする。これは元々pKH22と呼ばれていたプラスミドシステムに基づいており、これは数多くのさまざまなアプリケーションでよく使用されています6,7,8。ここでは、このプラスミドセットは、4つの関連ベクター:pMGX-A、C末端タグまたはN末端タグを欠く発現ベクターおよびアンピシリン耐性マーカーを含むように拡大される。 pMGX-hisA、N末端ヘキサヒスチジンタグおよびアンピシリン耐性マーカーをコードする発現ベクター; pMGX-K、発現ベクターl任意のC末端タグまたはN末端タグとカナマイシン耐性マーカーとを接触させる工程;およびN末端ヘキサヒスチジンタグおよびカナマイシン耐性マーカーをコードする発現ベクターであるpMGX-hisK。この研究では、pMGXシステム、特にpMGX-Aを使用して5つの遺伝子を含むポリシストロニックベクターを作製する方法が、 大腸菌における個々のタンパク質の成功した産生と共に実証される。
Protocol
Representative Results
Discussion
特に複雑な多遺伝子代謝経路の特徴付けおよび再構築には、複数の遺伝子の同時発現がますます必要不可欠となっている3,4,5 。 pMGXシステムは、 大腸菌ルーチン6,7,8で多遺伝子同時発現を行い、多様な研究者にアクセス可能である。この研究では、目的の5つのタンパク質が、pMGX-Aを用いて単一のプラスミドシステムから同時に生成されることが示された。現?…
Declarações
The authors have nothing to disclose.
Acknowledgements
この研究は、カナダの自然科学および工学研究評議会によって支持された。
Materials
| Enzymes | |||
| Alkaline Phosphatase, Calf Intestinal (CIP) | New England Biolabs | M0290S | |
| AvrII | New England Biolabs | R0174S | |
| EcoRI | New England Biolabs | R0101S | |
| NdeI | New England Biolabs | R0111S | |
| XbaI | New England Biolabs | R0145S | |
| Herculase II Fusion DNA Polymerase | Agilent Technologies | 600677 | |
| T4 DNA Ligase | New England Biolabs | M0202S | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 1 kb DNA ladder | New England Biolabs | N3232L | |
| 4-20% Mini-PROTEAN TGX Stain-Free Protein Gels | Bio-Rad | 456-8095 | |
| 50 x TAE | Fisher Thermo Scientific | BP1332-4 | |
| Agar | Fisher Thermo Scientific | BP1423-500 | |
| Agarose | Fisher Thermo Scientific | BP160-500 | |
| Ampicilin | Sigma-Alrich | A9518-5G | |
| BL21 (DE3) chemically comeptent cells | Comeptent cell prepared in house | ||
| B-PER Bacterial Protein Extraction Reagent | Fisher Thermo Scientific | PI78243 | |
| dNTP mix | Agilent Technologies | Supplied with polymerase | |
| Gel Extraction Kit | Omega | D2500-02 | E.Z.N.A Gel Extraction, supplied by VWR Cat 3: CA101318-972 |
| Glycine | Fisher Thermo Scientific | BP381-1 | |
| His Tag Antibody [HRP], mAb, Mouse | GenScript | A00612 | |
| Immobilon Western Chemiluminescent HRP Substrate | EMD Millipore | WBKLS0100 | |
| IPTG | Sigma-Alrich | 15502-10G | |
| LB | Fisher Thermo Scientific | BP1426-500 | |
| Methanol | Fisher Thermo Scientific | A411-20 | |
| Pasteurized instant skim milk powder | Local grocery store | No-name grocery store milk is adequate | |
| Nitrocellulose membrane | Amersham Protran (GE Healthcare Life Sciences) | 10600007 | Membrane PT 0.45 µm 200 mm X 4 m, supplied by VWR Cat #: CA10061-086 |
| Plasmid DNA Isolation Kit | Omega | D6943-02 | E.Z.N.A Plasmid DNA MiniKit I, supplied by VWR Cat #: CA101318-898 |
| pMGX | Boddy Lab | Request from the Boddy Lab Contact cboddy@uottawa.ca | |
| Primers | Intergrated DNA Technologies | Design primers as needed for desired gene | |
| Synthetic Gene | Life Technologies | Design and optimize as needed | |
| Thick Blot Filter Paper | Bio-Rad | 1703932 | |
| Tris base | BioShop | TRS001.1 | |
| Tween-20 | Sigma-Alrich | P9416-50ML | |
| XL1-Blue chemically competent cells | Comeptent cell prepared in house | ||
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| BioSpectrometer | Eppendorf | RK-83600-07 | |
| Gel box – PAGE | Bio-Rad | 1658005 | Mini-PROTEIN Tetra Vertical Electrophoresis Cell |
| Gel Imager | Alpha Innotech | AlphaImager EC | |
| Incubator-oven | Fisher Thermo Scientific | 11-690-650D | Isotemp |
| Incubator-shaker | Fisher Thermo Scientific | SHKE6000-7 | MaxQ 6000 |
| Personna Razors | Fisher Thermo Scientific | S04615 | |
| Power Pack | Bio-Rad | S65533Q | FB300 |
| Transilluminator | VWR International | M-10E,6W | |
| Thermocylcer | Eppendorf | Z316091 | Mastercycler Personal, supplied by Sigma |
| UV Face-Shield | 18-999-4542 | ||
| Waterbath | Fisher Thermo Scientific | 15-460-2SQ | |
| Western Transfer Apparatus | Bio-Rad | 1703935 | Mini-Trans Blot Cell |
Referências
- Purnick, P. E. M., Weiss, R. The second wave of synthetic biology: from modules to systems. Nat. Rev. Mol. Cell Biol. 10 (6), 410-422 (2009).
- Bieniossek, C., et al. Automated unrestricted multigene recombineering for multiprotein complex production. Nat. Methods. 6 (6), 447-450 (2009).
- Jochimsen, B., et al. Five phosphonate operon gene products as components of a multi-subunit complex of the carbon-phosphorus lyase pathway. Proc. Natl. Acad. Sci. USA. 108 (28), 11393-11398 (2011).
- Martin, V. J. J., Pitera, D. J., Withers, S. T., Newman, J. D., Keasling, J. D. Engineering a mevalonate pathway in Escherichia coli for production of terpenoids. Nat. Biotechnol. 21 (7), 796-802 (2003).
- Ajikumar, P. K., et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science. 330 (6000), 70-74 (2010).
- Boddy, C. N., Hotta, K., Tse, M. L., Watts, R. E., Khosla, C. Precursor-directed biosynthesis of epothilone in Escherichia coli. J. Am. Chem. Soc. 126 (24), 7436-7437 (2004).
- Lundgren, B. R., Boddy, C. N. Sialic acid and N-acyl sialic acid analog production by fermentation of metabolically and genetically engineered Escherichia coli. Org. Biomol. Chem. 5 (12), 1903-1909 (2007).
- Horsman, M. E., Lundgren, B. R., Boddy, C. N. N-Acetylneuraminic Acid Production in Escherichia coli Lacking N-Acetylglucosamine Catabolic Machinery. Chem. Eng. Commun. 203 (10), 1326-1335 (2016).
- Romier, C., et al. Co-expression of protein complexes in prokaryotic and eukaryotic hosts: experimental procedures, database tracking and case studies. Acta Crystallogr. D, Biol. Crystallogr. 62 (Pt 10), 1232-1242 (2006).
- Tolia, N. H., Joshua-Tor, L. Strategies for protein coexpression in Escherichia coli. Nat. Methods. 3 (1), 55-64 (2006).
- Chanda, P. K., Edris, W. A., Kennedy, J. D. A set of ligation-independent expression vectors for co-expression of proteins in Escherichia coli. Protein Expr. Purif. 47 (1), 217-224 (2006).
- Kim, K. -. J., et al. Two-promoter vector is highly efficient for overproduction of protein complexes. Protein Sci. 13 (6), 1698-1703 (2004).
- Tan, S., Kern, R. C., Selleck, W. The pST44 polycistronic expression system for producing protein complexes in Escherichia coli. Protein Expr. Purif. 40 (2), 385-395 (2005).
- Chen, X., Pham, E., Truong, K. TEV protease-facilitated stoichiometric delivery of multiple genes using a single expression vector. Protein Sci. 19 (12), 2379-2388 (2010).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J. Vis. Exp. (63), e3998 (2012).
- Lee, P. Y., Costumbrado, J., Hsu, C. -. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J. Vis. Exp. (62), (2012).
- Sukumaran, S. Concentration determination of nucleic acids and proteins using the micro-volume BioSpec-nano-spectrophotometer. J. Vis. Exp. (48), (2011).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Molecular Cloning. J. Vis. Exp Available from: https://www.jove.com/science-education/5074/molecular-cloning (2016)
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. The Western Blot. J. Vis. Exp Available from: https://www.jove.com/science-education/5065/the-western-blot (2016)
- Laible, M., Boonrod, K. Homemade site directed mutagenesis of whole plasmids. J. Vis. Exp. (27), (2009).

