海綿骨の機械的性質を測定するためミリ スケール曲げテスト システム
Summary
特注の機械式試験装置を用いたサブミリ スケール繊維の 3 点曲げ試験を実行するためのプロトコルを提案します。デバイスは、10 N まで 20 µN に至る力を測定することができます、したがってさまざまな繊維のサイズに対応することができます。
Abstract
多くは生物学的構造 (LBBSs) を負荷、羽軸、スピキュールなど-小さい (< 1 mm) がない顕微鏡。これらの LBBSs の曲げ性状の測定は、その顕著な機械的機能の起源を理解するため重要です。
10-5から 10 の1 N と変位に至る 10-7 10-2メートルに至るまで強制的に測定できる特注機械式試験装置を用いた 3 点曲げ試験を行うためのプロトコルについて述べる。この機械の試験装置の主な利点は、異なる LBBSs の力と変位の容量を簡単に調整できることです。デバイスの動作原理は、原子間力顕微鏡のそれに似ています。すなわち、力は、片持ち梁の端に接続されている負荷のポイントによって、LBBS に適用されます。荷重点変位は光ファイバー光ファイバー変位センサーによる測定、測定された片持梁剛性を用いた力に変換します。デバイスの力の範囲は、異なる剛性のカンチレバーを使用して調整できます。
海綿Euplectella aspergillumの骨格要素の 3 点曲げ試験を実行することによって、デバイスの機能を説明します。骨格の要素-スピキュールとして知られている-、直径約 50 μ m シリカ繊維であります。≈1.3 mm スパン 3 点曲げ冶具上、スピキュールを取り付けテスト装置を調整するための手順について述べるし、曲げテストします。スピキュールと応用力の位置の変形にかかる力を測定します。
Introduction
負荷軸受シェルや骨などの生物学的構造 (LBBSs) のアーキテクチャを研究することによってエンジニアは強くてタフな1である新しい複合材料を開発しました。LBBSs および対応する生体の顕著な機械的性質の複雑な内部アーキテクチャ2に関連していることが示されています。ただし、LBBS アーキテクチャと機械的性質との関係は完全には理解されていません。LBBS の力学応答を測定は、そのアーキテクチャがその機械的性質を高める方法を理解することの第一歩です。
ただし、LBBS の力学的応答の測定に使用するテストの種類、その力学的機能と一貫性のあることが重要です。たとえば、羽は空力負荷をサポートする必要があります、ので羽梗の主な機能曲げ剛性3を提供することです。したがって、曲げ試験の力学的応答を測定するため一軸引張試験をお勧めします。実際には、多くの LBBSs、羽軸3など草茎4、およびスピキュール5,6,7,8-主に曲げによる変形します。これは、これらの LBBSs が細い-すなわち、その長さが、幅や深さよりもはるかに大きい。ただし、これらの LBBSs の曲げ試験を行うために、やりがいが軍と彼らが失敗するまで耐えることができる変位 10 10-2範囲2 N と 10-4 10-3 m、それぞれ3,4,5,7,8します。 したがって、これらの機械のテスト実行に使用するデバイスがそれぞれ ≈10-5 N と ≈10-7 m (センサーの最大測定可能な力と変位のすなわち、0.1%) の力と変位の解像度を持つ必要があります。
商業的に利用可能な大規模な機械テスト システム通常測定できない力と変位この解像度で。彼らが測定できる最大の力 (それぞれ変位) はより小さい原子間力顕微鏡を用いた9,10や微小電気機械システム ベース11試験装置には、適切な解像度がありますが、LBBS が耐えることができる最大フォース (それぞれ変位)。したがって、これらの LBBSs、エンジニアおよび科学者で曲げ試験を実行する特注機械テスト デバイス5,7,12,13に頼らなければなりません。これらのカスタム デバイスの主な利点は、力と変位の大きい範囲を格納できることです。ただし、建設、これらのデバイスの操作でも記載されていません、文学。
プロトコルは、10-5から 10 の1 N と変位に至る 10-7 10-2メートルに至るまで強制的に測定できる特注機械式試験装置を用いた 3 点曲げ試験を実行する説明です。補足資料は、機械的試験装置のコンポーネントのすべてのディメンションを含む、技術的な図面を提供しています。この機械的試験装置の主な利点は、力と変位の範囲を異なる LBBSs に合わせて簡単に調整できることです。デバイスの動作原理は、原子間力顕微鏡9のそれに似ています。このデバイスは、標本をステンレス板にカット溝を配置 (図 1A ~ C参照)。1278 ± 3 μ m を光学顕微鏡写真からトレンチのスパンを測定 (平均 ± 標準偏差; n = 10)。トレンチ端部曲げ試験 (参照してください図 1、およびD) 中に供試体をサポートします。この試料ステージは、3 軸翻訳段階に添付、ウェッジは海溝のスパンに中間に位置する、アルミ ウェッジの下に配置 (図 1C参照)。ステージを移動することによって、 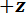 (参照してください図 1 a、およびC) の方向を曲げないように供試体を引き起こしているウェッジを押し込ま標本。
(参照してください図 1 a、およびC) の方向を曲げないように供試体を引き起こしているウェッジを押し込ま標本。
我々 は、負荷ポイント (LP) としてウェッジを含むデバイスのコンポーネントおよび負荷ポイント チップ (LPT) とウェッジを参照してください。LP は、カンチレバーの変位が、ファイバー光ファイバー変位センサー (FODS) で測定の最後に添付されます。対象は LP の上面にあるミラーから反射される赤外光を発する (図 1B参照)、対象に光ファイバーで送受信。洗練されたシリコンウェハーの ≈5 の mm の正方形の部分は LP ミラーとして使用され、エポキシを使用して LP に貼付されています。対象は、光を反射して放出の強度を比較することによって変位を測定します。カンチレバーの剛性と変位を使用して計算力、 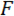 、供試体との対話によるくさびによって経験されます。カンチレバーの変位は、くさびの下に試験片の断面の変位を計算する使用も
、供試体との対話によるくさびによって経験されます。カンチレバーの変位は、くさびの下に試験片の断面の変位を計算する使用も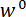 。カンチレバ型力センサーは、ミクロとマクロ力学試験研究10、11,12,13,14の数で使用されています。ここで示した特定の設計は、接着剤の接触実験14を実行するために使用される機械的試験装置から適応。似たようなデザインは、市販のマイクロ トライボメータ15,16で使用されています。
。カンチレバ型力センサーは、ミクロとマクロ力学試験研究10、11,12,13,14の数で使用されています。ここで示した特定の設計は、接着剤の接触実験14を実行するために使用される機械的試験装置から適応。似たようなデザインは、市販のマイクロ トライボメータ15,16で使用されています。
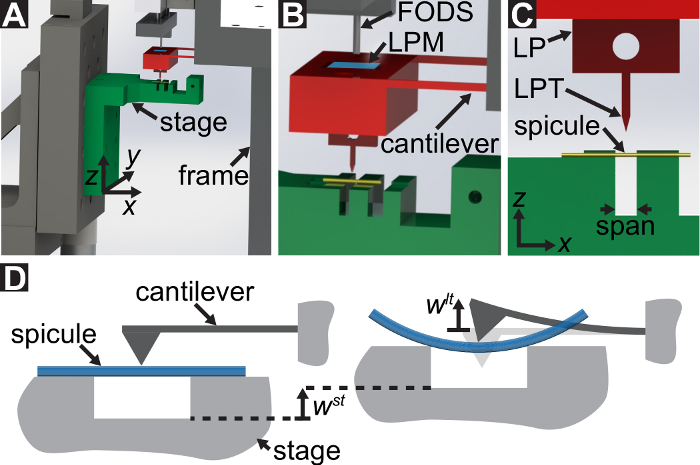
図 1: 特注の機械式試験装置の概要。(A) A コンピューター支援設計レンダリング デバイスの。ステージのコンポーネントが緑色でハイライトされます。サブアセンブリ (片持梁、ロード ポイント (LP)) の検出力は、赤色でハイライトされます。A (B) は (A) のビューを拡大しました。LP ミラーは、対象の下に LP の上面に青色で、LPM のラベルは。(C) 翻訳段階の運動を記述するために使用される座標系。Th を平準化プロトコルの手順 1.9 e ステージ、 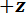 LP ミラーの表面に垂直なベクトルと一致する方向を作った。変形、スピキュールと計測変位を示す三点曲げ構成の (D) の模式図
LP ミラーの表面に垂直なベクトルと一致する方向を作った。変形、スピキュールと計測変位を示す三点曲げ構成の (D) の模式図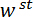 と
と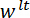 。この図の拡大版を表示するのにはここをクリックしてください。
。この図の拡大版を表示するのにはここをクリックしてください。
海綿Euplectella aspergillum6,7.の骨格要素の 3 点曲げ試験を実行することによってデバイスの機能を実証します。このスポンジのスケルトンは、フィラメント、スピキュール (図 2A参照) と呼ばれるアセンブリです。Spicules は ≈50 μ m 厚い、シリカ6主に構成。バイオシリカ ベースのスピキュールは、普通、Homoscleromorpha、および Hexactinellida のクラスに属するスポンジで発見されます。Hexactinellida クラスに属するE. aspergillumなどのスポンジは「ガラス スポンジ”とも呼ばれますガラス スポンジのスピキュールは、主にシリカから構成される、それはシリカが多くの場合どちらかコラーゲン17,18またはキチン19,20から成る有機マトリックスに含まれていることを示されています。,21. この有機基質シリカ鉱物18,20の重要な役割を果たしています。さらに、いくつかの骨片の有機基質もカルシウム22のバイオミネラリゼーションのテンプレートとして機能します。シリカ内で配布されているほか、有機マトリックスはまたスピキュールのシリカを分割、同心の円筒ラメラ6,23異なる層を形成できます。それはこの同心円状、層状アーキテクチャがスピキュールの変形動作6,7,8,24,25,26 に影響を与えることが示されています。.その結果、スピキュールの機械的プロパティは、化学反応の組み合わせによって決定されます (すなわち。、シリカ-タンパク質複合体の化学構造) とは建築27。化学構造とガラス海綿骨片のアーキテクチャの両方調査24,28,29の下にまだあります。
E. aspergillumのスピキュールのほとんどは、フォーム硬い骨格のケージに一緒に接合されています。しかし、スケルトンの基部 (図 2A参照) アンカー スピキュールとして知られている非常に長い (≈10 cm) スピキュールの房があります。アンカー スピキュールの小さいセクションで 3 点曲げ試験を行うためのプロトコルについて述べる。
プロトコルの手順 1で組み立てと特注の機械式試験装置のコンポーネントの位置揃え、手順を説明します。手順 2と4プロトコルの力と曲げ試験における変位を計算するために使用のキャリブレーション データを生成するための手順を提供します。手順 3で、スピキュールのセクションを準備し、テスト ・ フィクスチャにそれをマウントするための手順を示します。スピキュール セクションの曲げ試験を行うための手順は、手順 5に記載されています。最後に、代表結果セクションでステップ 2と4で得られた校正データを使ってステップ 5で得られた曲げ試験データと共に計算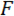 、
、 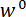 。
。

断面およびE. aspergillum スピキュールを検査するため図 2: プロシージャ。(A) E. aspergillumのスケルトン。フリースタンディング アンカー スピキュールの房は、スケルトンのベースに表示されます。スケール バーは ~ 25 mm (B) 単一のアンカー スピキュールは赤 #00000 クロテン ブラシを使用して、かみそりの刃を使用して断面の顕微鏡スライドの場所で開催されます。スケール バーは 〜 12 mm (C) 試料ステージの塹壕に配置されますE. aspergillumスピキュールのセクションあります。トレンチ端部とトレンチ リッジそれぞれティールと、オレンジ色でハイライトされます。トレンチ リッジに対して、スピキュールをプッシュすることで、その軸がトレンチ端部に垂直であることを確認します。(D) A スピキュール セクションが破損しているし、捨てられるべき場合を決定する方法を記述するプロトコルの手順 3.4で説明した検査手順を通過する骨片の顕微鏡写真。A (E) プロトコルの手順 3.4で説明した検査手順が失敗するシリカ層の大部分を不足している多くの亀裂を含む骨片の顕微鏡写真。スケール バー = 250 μ m (C)、(D)、100 μ m、100 μ m (E)。この図の拡大版を表示するのにはここをクリックしてください。
Protocol
Representative Results
Discussion
プロトコルのいくつかの手順は、力と変位を正確に測定を確保するため特に重要です。いくつかの重要な手順はすべて 3 点曲げ試験に普遍的なこの機械のテスト装置に固有のものです。
LP ミラーがきれい、傷の検査プロトコルの手順 1.2とステップ 1.6プロトコルの「FODS ゲインを設定します。ゲインの手順 2、 4、および<…
Declarações
The authors have nothing to disclose.
Acknowledgements
この作業は [材料力学と構造プログラム、付与数 1562656]; 国立科学財団によって支えられました。機械エンジニア [Haythornthwaite 若手研究者賞] のアメリカの社会。
Materials
| TMC 36" x 48" isolation table with 4" CleanTop breadboard | TMC | 63-563 | Isolation Table |
| Diffeential Screw Adjuster | Thorlabs | DAS110 | For stage leveling plate |
| 1" Travel Micrometer Head with 0.001" Graduations | Thorlabs | 150-801ME | For stage leveling plate |
| Right-Angle Bracket for PT Series Translation Stages, 1/4"-20 Mounting Holes | Thorlabs | PT102 | For microscope mount |
| 1" Dovetail Translation Stage, 1/4"-20 Taps | Thorlabs | DT25 | For microscope mount |
| 1" Translation Stage with 1/4"-170 Adjustment Screw, 1/4"-20 Taps | Thorlabs | PT1B | For microscope mount |
| 12" Length, Dovetail Optical Rail | Edmund Optics | 54-401 | For microscope mount |
| 2.5" Width, Dovetail Carrier | Edmund Optics | 54-404 | For microscope mount |
| 0.5" Width, Dovetail Carrier | Edmund Optics | 54-403 | For microscope mount |
| InfiniTube Mounting C-Clamp with ¼-20 | Edmund Optics | 57-788 | Microscope component |
| Standard (with no In-Line Attachment), InfiniTube | Edmund Optics | 56-125 | Microscope component |
| Standard In-Line Attachment (Optimized at 2X-10X), InfiniTube | Edmund Optics | 56-126 | Microscope component |
| Mitutoyo/Achrovid Objective Adapter (M26 to M27) | Edmund Optics | 53-787 | Microscope component |
| 5X Infinity Achrovid Microscope Objective | Edmund Optics | 55-790 | Microscope component |
| 0.316" ID, Fiber Optic Adapter SX-6 | Edmund Optics | 38-944 | Microscope component |
| ¼" x 36", Flexible Fiber Optic Light Guide | Edmund Optics | 42-347 | Microscope component |
| 115V, MI-150 Fiber Optic Illuminator w/IR Filter and Holder | Edmund Optics | 55-718 | Microscope component |
| Allied Vision Manta G-223 2/3" Color CMOS Camera | Edmund Optics | 88-452 | Microscope component |
| Power Supply for Manta/ Guppy Pro/ Stingray/ Pike | Edmund Optics | 68-586 | Microscope component |
| 1/4" Travel Single Axis Translation Stage | Thorlabs | MS1S | FODS micrometer |
| Analog Reflectance Dependent Fiber Optic Displacement Sensor | Philtec | D20 | FODS |
| 30V, 3A DC Power Supply | Agilent | U8001A | Power supply for DAQ and FODS |
| 14-Bit, 48 kS/s Low-Cost Multifunction DAQ | National Instruments | USB-6009 | DAQ for FODS |
| Three Axis Motorized Translation Stage | Thorlabs | Thorlabs T25 XYZ-E/M | Translation stage |
| T-Cube DC Servo Motor Controller | Thorlabs | TDC001 | Motor controller for stage |
| T-Cube Power Supply | Thorlabs | TPS001 | Power supply for motor controller |
| National Instruments LabVIEW (2013 SP1) | National Instruments | Used for running software | |
| National Instruments LabVIEW Vision Acquisition Software (2016) | National Instruments | Used for running software | |
| Nikon Eclipse Ci-POL Main Body | MVI | MDA96000 | Polarized light microscope |
| Nikon Pi Intermediate Tube with Analyzer Slider | MVI | MDB45305 | Polarized light microscope |
| Nikon Dia-Polarizer | MVI | MDN11920 | Polarized light microscope |
| Power Cord – 7'6" | MVI | 79035 | Polarized light microscope |
| Nikon P-Amh Mechanical Stage | MVI | MDC45000 | Polarized light microscope |
| Nikon Lwd Achromat Condenser | MVI | MBL16100 | Polarized light microscope |
| Nikon LV-NBD5BD-CH Manual Quint Nosepiece ESD | MVI | MBP60125 | Polarized light microscope |
| Nikon C-TF Trinocular Tube F | MVI | MBB93100 | Polarized light microscope |
| Nikon CFI 10X Eyepiece FN 22mm NC | MVI | MAK10110 | Polarized light microscope |
| Nikon TU Plan Flour BD 10x Objective | MVI | MUE42100 | Polarized light microscope |
| Venus Flower Basket Sponge | Denis Brand | N/A | Sponge skeleton |
| 3.5X Headband Flip-Up Magnifier | McMaster Carr | 1490T5 | Used for spicule sectioning |
| Ø1" Silicon Wafer, Type P / <100> | Ted Pella | 16011 | Used for load point mirror |
| Low Lint Tapered Tip Cotton Swab | McMaster Carr | 71035T31 | Used for cleaning LP mirror |
| Rubber grip precision knife | McMaster Carr | 35575A68 | Used for sectioning spicules |
| Microscope Slides, frosted end, 75 x 25 x 1mm | Ted Pella | 260409 | Used for sectioning spicules |
| Sable Brushes, #00000, 0.08mm W x 4.0mm L | Ted Pella | 11806 | Used for handling spicules |
| PELCO Pro High Precision Tweezers, extra fine tips, superior finish | Ted Pella | 5367-5NM | Used for handling spicules |
| Dual Axis Linear Scale Micrometer | Edmund Optics | 58-608 | Used for calibrating the microscopes |
| FLEX-A-TOP FT-38 CAS | ESD Plastic Containers | FT-38-CAS | Used for storing spicules |
| Plastic Vial Bullseye Level | McMaster Carr | 2147A11 | Used for leveling the stage |
| Analytical Balance | Mettler Toledo | MS105DU | Used to mass calibration weights |
Referências
- Wegst, U. G., Bai, H., Saiz, E., Tomsia, A. P., Ritchie, R. O. Bioinspired structural materials. Nat. Mater. 14 (1), 23-36 (2015).
- Meyers, M. A., McKittrick, J., Chen, P. Y. Structural biological materials: critical mechanics-materials connections. Science. 339 (6121), 773-779 (2013).
- Bodde, S. G., Meyers, M. A., McKittrick, J. Correlation of the mechanical and structural properties of cortical rachis keratin of rectrices of the Toco Toucan (Ramphastos toco). J. Mech. Behav. Biomed. Mater. 4 (5), 723-732 (2011).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. J. R. Soc. Interface. , (2012).
- Monn, M. A., Kesari, H. A new structure-property connection in the skeletal elements of the marine sponge Tethya aurantia that guards against buckling instability. Sci. Rep. 7, (2017).
- Monn, M. A., Weaver, J. C., Zhang, T., Aizenberg, J., Kesari, H. New functional insights into the internal architecture of the laminated anchor spicules of Euplectella aspergillum. Proc. Natl. Acad. Sci. U.S.A. 112 (16), 4976-4981 (2015).
- Monn, M. A., Kesari, H. Enhanced bending failure strain in biological glass fibers due to internal lamellar architecture. J. Mech. Behav. Biomed. Mater. , (2017).
- Levi, C., Barton, J. L., Guillemet, C., Bras, E., Lehuede, P. A remarkably strong natural glassy rod: the anchoring spicule of the Monorhaphis sponge. J. Mater. Sci. Letters. 8 (3), 337-339 (1989).
- Kesari, H., Doll, J. C., Pruitt, B. L., Cai, W., Lew, A. J. Role of surface roughness in hysteresis during adhesive elastic contact. Philos. Mag. Lett. 90 (12), 891-902 (2010).
- Croisier, F., et al. Mechanical testing of electrospun PCL fibers. Acta Biomater. 8 (1), 218-224 (2012).
- Haque, M. A., Saif, M. T. A review of MEMS-based microscale and nanoscale tensile and bending testing. Exp. Mech. 43 (3), 248-255 (2003).
- Gudlavalleti, S. . Mechanical testing of solid materials at the micro-scale. , (2002).
- Tohmyoh, H., Ishihara, M., Akanda, M. S., Yamaki, S., Watanabe, T., Iwabuchi, T. Accurate determination of the structural elasticity of human hair by a small-scale bending test. J. Biomech. 44 (16), 2833-2837 (2011).
- Waters, J. F. . Contact mechanics of biologically-inspired interface geometries. , (2009).
- Dai, Z., Gorb, S. N., Schwarz, U. Roughness-dependent friction force of the tarsal claw system in the beetle Pachnoda marginata (Coleoptera, Scarabaeidae). J. Exp. Biol. 205 (16), 2479-2488 (2002).
- Tramacere, F., Kovalev, A., Kleinteich, T., Gorb, S. N., Mazzolai, B. Structure and mechanical properties of Octopus vulgaris suckers. J. R. Soc. Interface. 11 (91), (2014).
- Ehrlich, H., et al. Nanostructural organization of naturally occurring composites: Part I. Silica-Collagen-based biocomposites. J. Nanomater. 53, (2008).
- Ehrlich, H., et al. Mineralization of the meter-long biosilica structures of glass sponges is templated on hydroxylated collagen. Nat. Chem. 2, 1084-1088 (2010).
- Ehrlich, H., et al. First evidence of the presence of chitin in skeletons of marine sponges. Part II. Glass sponges (Hexactinellida: Porifera). J. Exp. Zoo. 308 (4), 473-483 (2007).
- Ehrlich, H. Chitin and collagen as universal and alternative templates in biomineralization. Int. Geol Rev. 52, 661-699 (2010).
- Ehrlich, H., et al. Supercontinuum generation in naturally occurring glass sponge spicules. Adv. Opt. Mater. 4 (10), 1608-1613 (2016).
- Ehrlich, H., et al. Calcite reinforced silica-silica joints in the biocomposite skeleton of deep-sea glass sponges. Adv. Funct. Mater. 21, 3473-3481 (2011).
- Werner, P., Blumtritt, H., Zlotnikov, I., Graff, A., Dauphin, Y., Fratzl, P. Electron microscope analyses of the bio-silica basal spicule from the Monorhaphis chuni sponge. J. Struct. Biol. 191 (2), 165-174 (2015).
- Kolednik, O., Predan, J., Fischer, F. D., Fratzl, P. Bioinspired Design Criteria for Damage-Resistant Materials with Periodically Varying Microstructure. Adv. Funct. Mater. 21 (19), 3634-3641 (2011).
- Weaver, J. C., et al. Unifying design strategies in demosponge and hexactinellid skeletal systems. J. Adhes. 86 (1), 72-95 (2010).
- Walter, S. L., Flinn, B. D., Mayer, G. Mechanisms of toughening of a natural rigid composite. Mater. Sci. Eng. C. 27 (3), 570-574 (2007).
- Ehrlich, H. Silica biomineralization in Sponges. Encyclopedia of Geobiology. , 796-808 (2011).
- Zlotnikov, I., Werner, P., Fratzl, P., Zolotoyabko, E. Eshelby Twist as a possible source of lattice rotation in a perfectly ordered protein/silica structure grown by a simple organism. Small. 11 (42), 5636-5641 (2015).
- Zlotnikov, I., et al. A perfectly periodic three-dimensional protein/silica mesoporous structure produced by an organism. Adv. Mater. 26 (11), 1682-1687 (2014).
- Gere, J. M., Timoshenko, S. P. Chapter 5: Stresses in Beams. Mechanics of materials. , 205-217 (1997).
- Baratta, F. I., Matthews, W. T., Quinn, G. D. . Errors associated with flexure testing of brittle materials. , (1987).
- Quinn, G. D., Sparenberg, B. T., Koshy, P., Ives, L. K., Jahanmir, S., Arola, D. D. Flexural strength of ceramic and glass rods. J. Test. Eval. 37 (3), 1-23 (2009).
- Tattersall, H. G., Tappin, G. The work of fracture and its measurement in metals, ceramics and other materials. J. Mater. Sci. 1 (3), 296-301 (1966).

