音響ナノディスペンス技術を用いたハイスループットDNAプラスミド多重化とトランスフェクション
Summary
このプロトコルは、音響液滴排出技術を用いて384ウェルプレートにおける哺乳動物細胞のハイスループットプラスミドトランスフェクションについて説明する。時間がかかり、エラーが起こりやすいDNA分配と多重化だけでなく、トランスフェクション試薬の分配は、ソフトウェア駆動型であり、ナノディスペンサーデバイスによって実行されます。細胞は、次いで、これらの予め充填された井戸に播種されます。
Abstract
多くの生物学的研究に不可欠な細胞トランスフェクションは、正確で成功した達成のために多くのパラメータを制御する必要があります。ほとんどの場合、低スループットで実行され、さらに時間がかかり、エラーが発生しやすく、複数のプラスミドを多重化する場合はさらにそうです。私たちは、音響液滴放出(ADE)技術を使用して384ウェルプレートレイアウトで細胞トランスフェクションを行う簡単で迅速かつ正確な方法を開発しました。本研究で用いられるナノディスペンサー装置は、この技術に基づいており、ソースウェルプレートから目的地への高速での正確なナノボリューム送達を可能にします。あらかじめ設計されたスプレッドシートに従って、DNAおよびトランスフェクション試薬を分配し、多重化することができる。ここでは、ADEベースのハイスループットプラスミドトランスフェクションを実行するための最適なプロトコルを提示し、コトランスフェクション実験において最大90%の効率とほぼ100%のコトランスフェクションに到達することを可能にします。最大 1,536 個の異なるプラスミドを含むライブラリから最大 4 つのプラスミド/ウェルを管理できるユーザーフレンドリーなスプレッドシート ベースのマクロと、タブレットベースのピペッティング ガイド アプリケーションを提案することで、初期作業を拡張します。マクロは、ソースプレートの必要なテンプレートを設計し、ナノディスペンサーとタブレットベースのアプリケーション用にすぐに使用できるファイルを生成します。4ステップトランスフェクションプロトコルは、i)古典的な液体ハンドラを有する希釈剤、ii)プラスミド分布および多重化、iii)ナノディスペンサーによるトランスフェクション試薬分配、およびiv)予め充填されたウェル上の細胞めっきを含む。ADEプラスミド多重化およびトランスフェクションの記載されたソフトウェアベースの制御は、現場の非専門家でさえ、迅速かつ安全な方法で信頼性の高い細胞トランスフェクションを実行することを可能にします。この方法は、特定のセルタイプに最適な設定を迅速に特定し、より大規模かつ手動のアプローチに転置することができます。このプロトコルは、ヒトORFeomeタンパク質(ゲノムにおけるオープンリーディングフレーム[ORFs]のセット)発現やCRISPR-Cas9ベースの遺伝子機能検証などのアプリケーションを非プールスクリーニング戦略で容易にします。
Introduction
ここで提示される方法は、384ウェルプレート内の音響ベースの液体ナノディスペンサーを用いて、哺乳類細胞におけるDNAプラスミド多重化およびトランスフェクションを高スループットで行う方法を詳細に説明する。この最近公開された方法1は、1回の実験で384個もの独立プラスミドDNA多重化およびトランスフェクション条件を行うことを可能にし、1時間未満で単一または共トランスフェクション実験に成功し、ほぼ100%に達するトランスフェクト細胞集団内のコトランスフェクション。このプロトコルは、退屈で時間がかかり、エラーが発生しやすい手順のほとんどがソフトウェア駆動型であるため、トランスフェクションを容易にします (概要については、図 1を参照)。さらに、全体的なプロセス中の人為的ミスを回避しつつ、使いやすさを高め、現場の非専門家にとってもトランスフェクションの成功を促進するための専用ツールの開発に取り組んでいます。記述されたプロトコルには、各ウェルに最大 4 つのプラスミドの可能性を多重化する可能性を持つ 384 の独立したトランスフェクション条件を管理するために開発した「ユーザーフレンドリーな」マクロ スプレッドシートが含まれています。マクロは、入力された実験設計時にナノディスペンサーソフトウェアを駆動するために必要なファイルと、開始ストックソリューションから予想されるDNAプラスミドボリュームをロードするために、ソースプレートのテンプレートを自動的に生成します。384ウェルのソースプレートにDNAを手動で塗布するのは退屈でエラーが起こりやすいため、テンプレートに従ってDNA溶液を分配しながらユーザーを導く専用のタブレットベースのアプリケーションも開発しました。
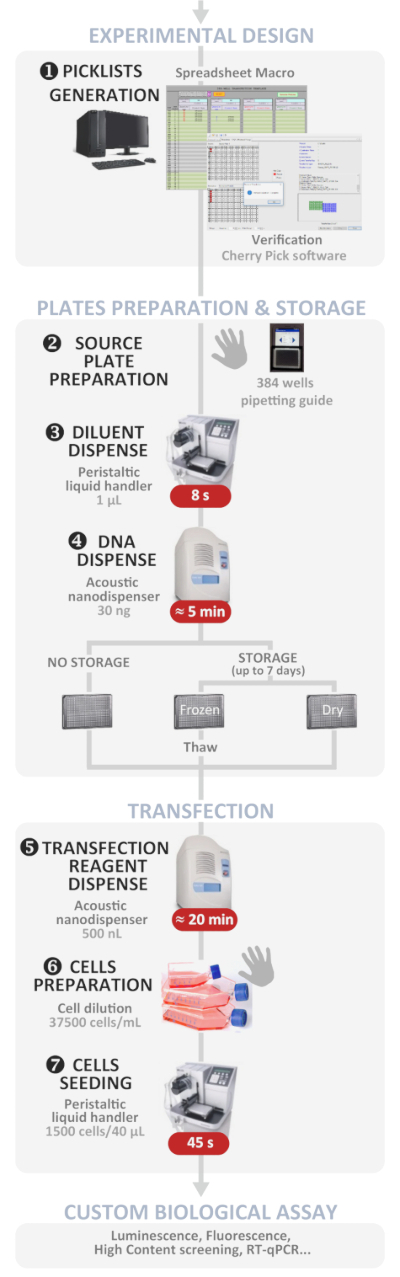
図 1: 実験的なワークフロー。最適な自動ハイスループット逆トランスフェクションプロトコルの概略表現(実験設計からカスタム生物学的アッセイまで)。手動ステップは手の記号で示され、各ステップのおおよその時間は赤いボックスに書き込まれます。この図のより大きなバージョンを表示するには、ここをクリックしてください。
多くの細胞ベースの実験はプラスミドDNAトランスフェクションから始まり、トランスフェクション効率を高め、手順を容易にするために多くの専用試薬が開発されている場合でも、多くのことが行われるべきである2、3,4.DNAプラスミド細胞トランスフェクションは、初期複合体取り込み、エンドソームエスケープ、および核への細胞質輸送などの高効率に到達するためのいくつかのステップを伴う5、6。カルシウム沈殿や専用デバイス7を用いてのエレクトロポレーションやマイクロインジェクションなどの物理的な技術に加えて、現代の化学的方法は、細胞の毒性を低下させながらDNA細胞送達を高めることに焦点を当ててきた8、 9.リポソーム様複合体を形成する脂質またはカチオン性ポリマーの使用により、より最近では、非リポソーム高分子化学系はトランスフェクションをより容易かつ効率的に10にした。これらの開発にもかかわらず、細胞トランスフェクションは、これらの物理的または化学的トランスフェクションプロトコルのほとんどが、科学者が手動で各DNAトランスフェクション反応状態を準備する必要があるため、正確に実行する特定のスキルを必要とします。スループットを損なう。この問題を回避するために、逆トランスフェクションプロトコルは、化学トランスフェクション試薬11、12、13を使用して開発され、ユーザがより速い方法で複数のプラスミドをテストまたは組み合わせることを可能にする。これらのプロトコルでは、トランスフェクション試薬を用いた核酸複合体が、複合体上の細胞を播種する前に形成される。しかし、これらの逆プロトコルは、DNA溶液の手動処理と、独立した条件のそれぞれの組み合わせによって依然として制限されています。96ウェルプレート形式で行うことが可能ですが、DNAの調製と分配は退屈であり、間違いが起こる可能性があります。複数のDNAプラスミドの異なる量が必要とされ、互いに多重化されると、細胞トランスフェクションを達成するのがさらに難しくなり、時間がかかり、ヒューマンエラーは非常に避けられません。逆トランスフェクションアプローチで384ウェルプレートフォーマットにスケールアップすることは、多重化されたDNAトランスフェクション条件が少ないにもかかわらず、以下の理由により不可能な課題となります。i) 管理するDNA量、トランスフェクション試薬、または反応混合物量は、各ウェルに対して1μL未満である。ii) 384の独立した条件に対するプラスミドの多重化は極めて複雑になる。384ウェルの各々における送達もiii)非常に時間がかかり、iv)エラーが発生しやすい。確かに、期待される井戸に適切なソリューションを分配することは、既に分配されている少量は空の井戸と既に充填された井戸の間の視覚的な監視を許可しないため、管理が困難です。v)最後に、必要な分配工程を行うために必要な時間のために細胞が添加される前に蒸発によって混合物を乾燥させる危険性が高い。要約すると、ハイスループットのDNAプラスミドトランスフェクションアッセイを設定する制限要因は、アッセイの小型化であり、これは、もはや手動では処理できないが、また、ほとんど達成できないことを意味するアッセイの小型化である。古典的な前立腺液体ハンドラーによって信頼できる方法。
このようなアッセイを自動化し、高スループットを得ることが困難な証拠として、トランスフェクションを自動化する試みは、これまでに発表されているだけです:市販の液体処理装置とリン酸カルシウム沈殿14を使用した96ウェルプレートフォーマットそして、より最近では、リポレックス試薬、および280の独立したトランスフェクション15を可能にするマイクロ流体チップが、この分野で専門的なスキルを必要とします。別の方法は、アコストフォレシス、液体浮上を可能にし、流体操作および混合につながる、24〜96ウェルプレートフォーマット16でDNAトランスフェクションを行うために使用された。実現可能ですが、DNAトランスフェクション混合物と細胞を混合するには、播種前に1点ごとに60sのインキュベーションが必要とされるため、このアプローチは非常に低いスループットに苦しみます。これは、完全な96ウェルプレートの持続時間が少なくとも96分を意味します。さらに、このプロトコルは、現在市場で入手できない社内で設計され、製造されたデバイスで行われたため、生物学者全体の聴衆に対して受け入れられるものからは程遠い。それどころか、ここ数年、ソフトウェア駆動の音響ベースのディスペンス技術がナノボリュームディスペンサーデバイスで登場しました。集中した音響エネルギーを使用して、これらの装置は、ソースプレートから宛先117への2.5 nLから500 nLまでの小さな液体容積の厳密に制御された排出を可能にします。音響液滴の排出(ADE)と呼ばれるこの技術は多数の利点を有する:それは十分に自動化され、非接触、先端無し、正確、精密、および非常に再生可能であり、高いスループット18を有する。最初にジメチルスルホキシド(DMSO)ソリューションの提供に専念し、水性バッファー19を分配するように設定が強化されました。音響ナノディスペンサーは、その後、逆細胞トランスフェクションプロトコルに適しているように見え、上記の手動制限のほとんどを回避することができます。この技術を用いてプラスミドトランスフェクションの試みはこれまで述べられていなかったので、我々は最近、逆細胞トランスフェクションを行う音響ベースの分配システムの適合性を評価した。
ナノディスペンサーのスループットと使いやすさを活かし、384ウェル、シングルプレート、すなわち総DNA量とDNAトランスフェクションに影響を与える可能性のあるいくつかのパラメータをクロステストすることにより、HeLa細胞の逆トランスフェクションプロトコルを最適化しました。ソースDNA開始濃度、希釈体積、トランスフェクション試薬、および広がり細胞数。開発されたプロトコルは、細胞トランスフェクションの上述の手動制限を回避し、他の自動トランスフェクションの試みに対していくつかの利点を提示します。第1に、小型化により、DNAプラスミド製剤およびトランスフェクション試薬を保存することにより、費用対効果の高いトランスフェクション試薬を可能にします。第二に、384ウェルプレート全体のトランスフェクションが1時間未満で達成することができるので、それは手動プロトコル(初心者のためにも)よりもはるかに高スループットと再現性があります。最後に、それはソフトウェア主導であり、分配されたDNA量およびいくつかのプラスミドの多重化の制御を可能にする。確かに、ナノディスペンサーソフトウェア(材料のテーブル)のおかげで、ユーザーは、定義されたソースウェルプレートから宛先の1に分配されるボリュームを制御するための研究計画を精緻化することができます。
ここで提示されるプロトコルは、主にナノディスペンサーにアクセスし、高スループットでトランスフェクション実験を設定したい人を対象としていますが、特定のセルタイプに対するトランスフェクションパラメータを迅速に最適化したい方も対象です。このプロトコルを適用して、高スループットでいくつかのパラメータをクロステストします。実際、このナノスケールプロトコルで同定された最適化されたパラメータは、大規模かつ手動のトランスフェクション実験に移すことができることを示しました。最後に、本プロトコルで使用されるトランスフェクション試薬は、製造元に応じてDNAまたはsiRNAトランスフェクションを可能にするように、プロトコルは、遺伝子過剰発現またはノックダウンのための配列アプローチを行うことを目指す人にも興味がある。DNAで埋め込んだ宛先プレートは、有効性を損なうことなくトランスフェクションアッセイで使用する7日前まで保存することができ、この種のアプリケーションに対する次のプロトコルのもう一つの利点である。
Protocol
Representative Results
Discussion
特定の細胞株に対する正確なハイスループットトランスフェクション法の確立と最適化は、科学者がこのセクションで説明するいくつかの重要なパラメータに従う必要があります。HeLa細胞用に最適化されたこれらの設定はHEK細胞に対しても効率的であることが証明されたため、プロトコル全体で推奨値から始めることを強くお勧めします。しかし、最良のパラメータは細胞株およびトランス…
Declarações
The authors have nothing to disclose.
Acknowledgements
著者らは、この記事の研究、著作者、および/または出版物のための次の財政的支援の領収書を開示しました:インサーム、リール大学、リールパストゥール研究所、コンセイユ・レジオナル・デュ・ノール、およびPRIM-HCV1と2(Pôle de Rechercheインタージシプリンエア・シュル・ル・メディカメント、アジェンス・ナショナル・デ・ラ・レチェルシュ(ANR-10-EQPX-04-01)、フェデラー(12001407(D-AL)イマジネーションス・バイオメッド)および欧州共同体(ERC-STG INTRACELLTB n° 260901)。著者らは、S.モウリュー博士、B.ヴィルマグネ博士、R.フェルー・クレメント博士、H.グルート博士に対し、原稿の批判的なレビューと訂正に感謝したいと考えている。
Materials
| 384LDV Microplate | Labcyte | LP-0200 | |
| 384-well Microplate μClear Black | Greiner | 781906 | |
| Ampicilin | Sigma | A9393-5G | Selection antibiotic for bacteria transformed with ampicilin expressing vector |
| Android Tablet | Samsung | Galaxy Note 8 | used to guide the user while the source plate manual dispense |
| Aniospray Surf 29 | Anios | 2421073 | disinfectant to clean the MicroFlo head |
| Columbus software | Perkin Elmer | image analysis software | |
| Dulbecco's Modified Eagle Medium (DMEM), high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 10566032 | cell culture medium |
| Echo Cherry Pick 1.5.3 software | Labcyte | Software enabling ADE-based dispenses by the Echo550 device from a *.csv file; nanodispenser software | |
| Echo550 | Labcyte | ADE-based dispenser | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | to add in cell culture medium |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | to fix cell |
| HeLa cells | ATCC | HeLa (ATCC® CCL-2™) | |
| Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | 10 mg/mL Solution in Water |
| INCell Analyzer 6000 | GE Healthcare | 29043323 | automated laser-based confocal imaging platform |
| LB medium | Thermoischer Scientific LB Broth Base (Lennox L Broth Base)®, powder |
12780052 | culture medium for bacteria growth |
| Lysis Buffer (A2) | Macherey-Nagel | 740912.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| MicroFlo 10µL cassette | Biotek Instruments Inc | 7170013 | to use with the Microflo Dispenser |
| MicroFlo 1μL cassette | Biotek Instruments Inc | 7170012 | to use with the Microflo Dispenser |
| MicroFlo Dispenser | Biotek Instruments Inc | 7171000 | peristaltic pump-based liquid handler device |
| Microvolume spectrophotometer | Denovix | DS-11 Spectrophotometer | Measure the DNA concentration of samples |
| mVenus plasmid | mVenus cDNA was cloned by enzymatic restriction digestion and ligation in Age1/BsrG1 sites of the tdTomato-N1 plasmid | Vector type: Mammalian Expression, Fusion Protein: mVenus | |
| Neutralization Buffer (A3) | Macherey-Nagel | 740913.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| NucleoSpin Plasmid kit | Macherey-Nagel | 740588.50 | used to prepare plasmid from bacterial culture |
| Optimal-Modified Eagle Medium (Opti-MEM) Medium | Thermo Fisher Scientific | 31985070 | |
| optional Wash bufferWash Buffer (A4) | Macherey-Nagel | 740914.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| orbital shaker | incubated large capacity shaker | 444-7084 | Used to grow bacteria under gentle agitation and 37°C |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 10,000 U/mL |
| Phosphate-Buffered Saline | Thermo Fisher Scientific | 10010001 | |
| Plasmid mini-columns | Macherey-Nagel | 740499.250 | Silica membrane mini-column to prepare plasmid from bacterial culture |
| Resuspension Buffer (A1) | Macherey-Nagel | 740911.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| RNAse A | Macherey-Nagel | 740505 | Enzyme from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| tdTomato-N1 plasmid | Addgene | Plasmid #54642 | Vector type: Mammalian Expression, Fusion Protein: tdTomato |
| TransIT-X2 Dynamic Delivery System | Mirus Bio | MIR 6000 | |
| Wash Buffer (AW) | Macherey-Nagel | 740916.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| 3D printer | Creality | CR10S | used to print the plate adapter |
| Blender Software | https://www.blender.org/ Free software under GNU General Public License (GPL). |
version 2.79b | used to design the plate adapter |
Referências
- Colin, B., Deprez, B., Couturier, C. High-Throughput DNA Plasmid Transfection Using Acoustic Droplet Ejection Technology. SLAS Discovery: Advancing Life Sciences R & D. , 2472555218803064 (2018).
- Mirus Bio. . Optimising Transfection Performance. , (2019).
- Thermo Fisher Scientific. . Factors Influencing Transfection Efficiency | Thermo Fisher Scientific – FR. , (2019).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Figueroa, E., et al. A mechanistic investigation exploring the differential transfection efficiencies between the easy-to-transfect SK-BR3 and difficult-to-transfect CT26 cell lines. Journal of Nanobiotechnology. 15 (1), 36 (2017).
- Kirchenbuechler, I., Kirchenbuechler, D., Elbaum, M. Correlation between cationic lipid-based transfection and cell division. Experimental Cell Research. 345 (1), 1-5 (2016).
- Zhang, Z., Qiu, S., Zhang, X., Chen, W. Optimized DNA electroporation for primary human T cell engineering. BMC Biotechnology. 18 (1), 4 (2018).
- Cao, D., et al. Transfection activity and the mechanism of pDNA-complexes based on the hybrid of low-generation PAMAM and branched PEI-1.8k. Molecular bioSystems. 9 (12), 3175-3186 (2013).
- Bos, A. B., et al. Development of a semi-automated high throughput transient transfection system. Journal of Biotechnology. 180, 10-16 (2014).
- Colosimo, A., et al. Transfer and expression of foreign genes in mammalian cells. BioTechniques. 29 (2), 314-318 (2000).
- Villa-Diaz, L. G., Garcia-Perez, J. L., Krebsbach, P. H. Enhanced transfection efficiency of human embryonic stem cells by the incorporation of DNA liposomes in extracellular matrix. Stem Cells and Development. 19 (12), 1949-1957 (2010).
- Sabatini, D. M. . Reverse transfection method. , WO2001020015A1 (2001).
- Raymond, C., et al. A simplified polyethylenimine-mediated transfection process for large-scale and high-throughput applications. Methods (San Diego, CA). 55 (1), 44-51 (2011).
- Junquera, E., Aicart, E. Recent progress in gene therapy to deliver nucleic acids with multivalent cationic vectors. Advances in Colloid and Interface Science. 233, 161-175 (2016).
- Woodruff, K., Maerkl, S. J. A High-Throughput Microfluidic Platform for Mammalian Cell Transfection and Culturing. Scientific Reports. 6, 23937 (2016).
- Vasileiou, T., Foresti, D., Bayram, A., Poulikakos, D., Ferrari, A. Toward Contactless Biology: Acoustophoretic DNA Transfection. Scientific Reports. 6, 20023 (2016).
- Hadimioglu, B., Stearns, R., Ellson, R. Moving Liquids with Sound: The Physics of Acoustic Droplet Ejection for Robust Laboratory Automation in Life Sciences. Journal of Laboratory Automation. 21 (1), 4-18 (2016).
- Grant, R. J., et al. Achieving accurate compound concentration in cell-based screening: validation of acoustic droplet ejection technology. Journal of Biomolecular Screening. 14 (5), 452-459 (2009).
- Sackmann, E. K., et al. Technologies That Enable Accurate and Precise Nano- to Milliliter-Scale Liquid Dispensing of Aqueous Reagents Using Acoustic Droplet Ejection. Journal of Laboratory Automation. 21 (1), 166-177 (2016).
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chemical Society Reviews. 38 (10), 2887-2921 (2009).
- Zielinski, D., Gordon, A., Zaks, B. L., Erlich, Y. iPipet: sample handling using a tablet. Nature Methods. 11 (8), 784-785 (2014).
- Brunner, S., et al. Cell cycle dependence of gene transfer by lipoplex, polyplex and recombinant adenovirus. Gene Therapy. 7 (5), 401-407 (2000).
- Nii, T., et al. Single-Cell-State Culture of Human Pluripotent Stem Cells Increases Transfection Efficiency. BioResearch Open Access. 5 (1), 127-136 (2016).
- Noonan, D. J., Henry, K., Twaroski, M. L. A High-Throughput Mammalian Cell-Based Transient Transfection Assay. Signal Transduction Protocols. 284, 051-066 (2004).
- . . Transfection | TransIT Transfection Reagents | Mirus Bio. , (2015).
- American Type Culture Collection. . General protocol for transfection of stem cells, primary cells, and continuous cell lines with ATCC TransfeX Transfection Reagent. , (2017).
- American Type Culture Collection. . Transfection Reagents for Nucleic Acid Transfer into ATCC Cells. , (2017).
- de Los Milagros Bassani Molinas, M., Beer, C., Hesse, F., Wirth, M., Wagner, R. Optimizing the transient transfection process of HEK-293 suspension cells for protein production by nucleotide ratio monitoring. Cytotechnology. 66 (3), 493-514 (2014).
- Promega. . FuGENE® 6 Transfection Reagent. , (2019).
- Olden, B. R., Cheng, Y., Yu, J. L., Pun, S. H. Cationic polymers for non-viral gene delivery to human T cells. Journal of Controlled Release: Official Journal of the Controlled Release Society. 282, 140-147 (2018).
- Park, E., Cho, H. B., Takimoto, K. Effective gene delivery into adipose-derived stem cells: transfection of cells in suspension with the use of a nuclear localization signal peptide-conjugated polyethylenimine. Cytotherapy. 17 (5), 536-542 (2015).
- Wood, R. W., Loomis, A. L. The physical and biological effects of high-frequency sound-waves of great intensity. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 4 (22), 417-436 (1927).
- Mamat, U., et al. Eliminating Endotoxin at the Source – A Novel Competent Cell Line with Modified Lipopolysaccharide for Low-Endotoxin Plasmid Production. , (2014).
- Ivanova, N. V., Kuzmina, M. L. Protocols for dry DNA storage and shipment at room temperature. Molecular Ecology Resources. 13 (5), 890-898 (2013).
- Lesnick, J., Lejeune-Dodge, A., Ruppert, N., Jarman, C. . High-Precision Cell Dispensing with the Labcyte Echo® Liquid Handler. , (2017).
- Yang, X., et al. A public genome-scale lentiviral expression library of human ORFs. Nature Methods. 8 (8), 659-661 (2011).
- Peng, J., Zhou, Y., Zhu, S., Wei, W. High-throughput screens in mammalian cells using the CRISPR-Cas9 system. The FEBS journal. 282 (11), 2089-2096 (2015).

