High-throughput DNA plasmide multiplexing en transfectie met behulp van akoestische nano doseertechnologie
Summary
Dit protocol beschrijft een hoge doorvoer plasmide transfectie van zoogdiercellen in een 384-goed plaat met behulp van akoestische druppel ejectie technologie. De tijdrovende, foutgevoelige DNA-afgifte en multiplexing, maar ook de transfectie-reagens afgifte, zijn softwaregestuurd en worden uitgevoerd door een nanodispenser apparaat. De cellen worden vervolgens in deze voorgevulde putten gesest.
Abstract
Celtransfectie, onmisbaar voor veel biologische studies, vereist het beheersen van vele parameters voor een nauwkeurige en succesvolle prestatie. Meestal uitgevoerd bij lage doorvoer, het is bovendien tijdrovend en foutgevoelig, nog meer als multiplexing verschillende plasmiden. We ontwikkelden een eenvoudige, snelle en nauwkeurige methode om celtransfectie uit te voeren in een 384-well plate layout met behulp van Acoustic druppel uitwerp (ADE) technologie. De nano dispenser apparaat gebruikt in deze studie is gebaseerd op deze technologie en maakt nauwkeurige nano volume levering op hoge snelheid van een bron goed plaat naar een bestemming een. Het kan DNA-en transfectie-reagens verdelen en multiplex volgens een vooraf ontworpen spreadsheet. Hier presenteren we een optimaal protocol om op ADE gebaseerde plasmide transfectie met hoge doorvoer uit te voeren, wat het mogelijk maakt om een efficiëntie van maximaal 90% en een bijna 100% cotransfectie in cotransfection experimenten te bereiken. We breiden het initiële werk uit door een gebruiksvriendelijke macro op spreadsheet voor te stellen, die maximaal vier plasmiden/putten kan beheren uit een bibliotheek met maximaal 1.536 verschillende plasmiden en een Tablet-gebaseerde Pipetteer hulplijn toepassing. De macro ontwerpt de noodzakelijke template (s) van de bron plaat (en) en genereert de kant-en-klare bestanden voor de nano dispenser en Tablet-based applicatie. Het transfectie-Protocol van vier stappen omvat i) een verdunningsmiddel dat met een klassieke vloeistofhandler, II) plasmide distributie en multiplexing, III) een transfectie-reagens van de nano dispenser, en IV) celplating op de voorgevulde putten. De beschreven software-gebaseerde controle van ADE plasmide multiplexing en transfectie maakt het zelfs niet-specialisten in het veld mogelijk om een betrouwbare celtransfectie op een snelle en veilige manier uit te voeren. Deze methode maakt snelle identificatie van optimale instellingen voor een bepaald celtype mogelijk en kan worden omgezet naar een hogere schaal en handmatige benaderingen. Het protocol vergemakkelijkt toepassingen, zoals humaan ORFeome eiwit (set van open Lees kaders [Orf’s] in een genoom) expressie of CRISPR Cas9 gebaseerde genfunctie validatie, in niet-gepoolde screening strategieën.
Introduction
De hier gepresenteerde methode beschrijft in detail hoe DNA-plasmide multiplexing en transfectie in zoogdiercellen bij hoge doorvoer te voeren met behulp van een akoestische vloeibare nano dispenser in een 384-well plaat, zelfs voor niet-specialisten in het veld. Deze onlangs gepubliceerde methode1 maakt het uitvoeren van zoveel 384 onafhankelijke plasmide DNA multiplexing en transfectie voorwaarden in één experiment, in minder dan 1 h. enkelvoudige of cotransfectie experimenten waren succesvol en bereikten een nabije 100% cotransfectie binnen de populatie van de getransfunteerde cellen. Dit protocol maakt transfectie gemakkelijker omdat de meeste vervelende, tijdrovende en foutgevoelige stappen nu software-gedreven zijn (Zie afbeelding 1 voor een algemeen overzicht). Er zijn verdere inspanningen geleverd om speciale instrumenten te ontwikkelen om het gebruiksgemak te verbeteren en tegelijkertijd menselijke fouten tijdens het algehele proces te voorkomen en om succesvolle Transfectie te bevorderen, zelfs voor niet-specialisten in het veld. Het beschreven protocol bevat een “gebruiksvriendelijk” macro-spreadsheet dat we hebben ontwikkeld om 384 onafhankelijke transfectie condities te beheren met multiplexing mogelijkheden van maximaal vier plasmiden in elke put. De macro genereert automatisch sjablonen van de bron plaat (en) om het verwachte DNA-plasmide volume te laden bij het starten van voorraadoplossingen en de bestanden die nodig zijn om de nanodispenser software te best Epen op het experimentele ontwerp dat is ingevoerd. Omdat het handmatig doseren van DNA in een 384-bron plaat vervelend en foutgevoelig is, ontwikkelden we ook een speciale Tablet-gebaseerde applicatie om de gebruiker te begeleiden tijdens het doseren van de DNA-oplossing volgens de sjabloon.
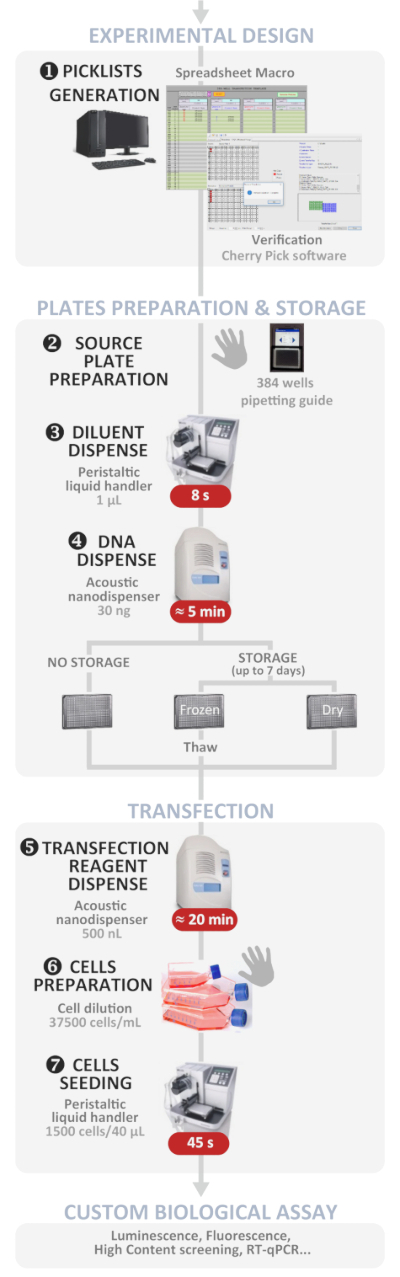
Figuur 1: experimentele workflow. Schematische weergave van het optimale geautomatiseerde omgekeerde transfectie protocol met hoge doorvoer (van experimenteel ontwerp tot aangepaste biologische assay). Handmatige stappen worden aangegeven door het hand symbool en de geschatte tijd voor elke stap wordt in een rood vak geschreven. Klik hier om een grotere versie van dit cijfer te bekijken.
Veel op cellen gebaseerde experimenten beginnen met plasmide DNA-transfectie, en zelfs als veel speciale reagentia zijn en nog steeds worden ontwikkeld om de transfectie-efficiëntie te verbeteren en/of de procedure te verlichten, moet er nog veel worden gedaan2,3 , 4. DNA plasmide celtransfectie omvat verschillende stappen om een hoog rendement te bereiken, zoals een initiële complexe opname, endosomale ontsnapping en cytoplasmisch transport naar de Nucleus5,6. Naast calcium neerslag of fysische technieken zoals elektroporation of Microinjection met behulp van speciale apparaten7, moderne chemische methoden hebben gericht op het verbeteren van DNA-cel levering terwijl het verlagen van de cel cytoxiciteit8, 9. Het gebruik van lipiden of kationische polymeren die liposomen-achtige complexen vormen en, meer recentelijk, nonliposomale polymere chemie systemen heeft transfectie gemakkelijker en efficiënter gemaakt10. Ondanks deze ontwikkelingen vereist celtransfectie nog steeds dat specifieke vaardigheden nauwkeurig worden uitgevoerd, omdat de meeste van deze fysische of chemische transfectie protocollen wetenschappers verplichten om handmatig elke DNA-transfectie reactie voorwaarde voor te bereiden, dus de doorvoer aantasten. Om dit probleem te omzeilen, zijn reverse transfectie-protocollen ontwikkeld met behulp van chemische transfectie reagentia11,12,13, waardoor de gebruiker meerdere plasmiden op een snellere manier kon testen of combineren. In deze protocollen worden nucleïnezuur complexen met transfectie reagentia gevormd voordat de cellen op de complexen worden zaaien. Deze omgekeerde protocollen worden echter nog steeds beperkt door de manuele behandeling van DNA-oplossingen en door de combinatie van elk van de onafhankelijke voorwaarden. Hoewel het haalbaar is om ze uit te voeren in een 96-goed plaat formaat, zullen de DNA-voorbereiding en-bedeling vervelend zijn en zullen er waarschijnlijk fouten zijn. Wanneer verschillende hoeveelheden van verschillende DNA plasmiden nodig zijn en Multiplexed met elkaar, wordt celtransfectie nog moeilijker te bereiken en meer tijdrovende, en menselijke fouten worden heel onvermijdelijk. Opschalen naar de 384-well plate formaat in een omgekeerde transfectie aanpak, ondanks enkele Multiplexed DNA transfectie omstandigheden, wordt een onmogelijke uitdaging om de volgende redenen. i) de DNA-bedragen, het transfectiereagens of het reactiemengsel dat moet worden beheerd, zijn voor elke put lager dan 1 μL. II) de multiplexing van plasmiden voor 384 onafhankelijke omstandigheden wordt uiterst ingewikkeld. De levering in elk van de 384 Wells is ook III) zeer tijdrovend en IV) foutgevoelig. Inderdaad, het doseren van de juiste oplossing in de verwachte putten is moeilijk te beheren omdat de lage volumes die al zijn gedoseerd geen visuele controle tussen de lege en reeds gevulde putten toestaan. v) ten slotte is er een hoog risico op het drogen van het mengsel door verdamping voordat de cellen worden toegevoegd als gevolg van de tijd die nodig is om de nodige doseerstappen uit te voeren. Samengevat, de beperkende factor voor het instellen van een hoge doorvoer DNA plasmide transfectie-assays lijkt de miniaturisatie van de assay te zijn, wat een laag volume multiplexing en beheer inhoudt dat niet meer handmatig kan worden afgehandeld, maar ook nauwelijks haalbaar is in een betrouwbare manier door klassieke peristatische vloeistof behandellers.
Als een bewijs van moeilijkheden om dergelijke testen te automatiseren en hoge doorvoer te krijgen, zijn er tot nu toe slechts een paar pogingen om Transfectie te automatisering gepubliceerd: a 96-well plate Format met behulp van een commerciële vloeistof handling apparaat en calciumfosfaat neerslag14 en, meer recentelijk, een lipoplex-reagens en een microfluïdische chip die 280 onafhankelijke transfecties mogelijk maakt15 , maar die gespecialiseerde vaardigheden op dit gebied vereisen. Een andere methode, acoustophoresis, die vloeistof levitatie mogelijk maakt en leidt tot vloeiende manipulatie en menging, werd gebruikt om DNA-transfectie uit te voeren in 24-tot 96-well plate formaten16. Hoewel haalbaar, deze aanpak lijdt aan een extreem lage doorvoer als het mengen van cellen met DNA-transfectie mengsel vereist een 60 s incubatie voor elk afzonderlijk punt voor het zaaien. Dit impliceert een duur van minstens 96 min voor een complete 96-well plaat. Bovendien is dit protocol verre van vatbaar voor het publiek van de algemene biologen, omdat dit werk werd gedaan met een in-House ontworpen en gefabriceerd apparaat dat momenteel niet op de markt verkrijgbaar is. Integendeel, in de afgelopen jaren is een eenvoudig te gebruiken software-gestuurde, op akoestiek gebaseerde doseertechnologie ontstaan met nano volume dispenser apparaten. Met behulp van gerichte akoestische energie, kunnen deze apparaten de strak gecontroleerde ejectie van kleine vloeibare volumes van 2,5 nL naar 500 nL van een bron plaat naar een bestemming één17. Deze technologie, genaamd Acoustic druppel uitwerp (ADE), heeft tal van voordelen: het is volledig geautomatiseerd, contactloos, tipless, nauwkeurig, nauwkeurig en zeer reproduceerbaar, en heeft een hoge doorvoer18. Voor het eerst gewijd aan het leveren van Dimethylfumaraat sulfoxide (DMSO) oplossingen, zijn de instellingen verbeterd om water buffers te doseren19. Akoestische nano dispensers lijken dan geschikt voor Reverse Cell transfectie protocols en kunnen de meeste van bovengenoemde handmatige beperkingen omzeilen. Omdat er voorheen geen plasmide transfectie pogingen werden beschreven met behulp van deze technologie, evalueerden we onlangs de geschiktheid van een akoestisch-gebaseerd doseersysteem om omgekeerde celtransfectie uit te voeren.
Door de doorvoer en het gebruiksgemak van de nano dispenser te benutten, hebben we een reverse transfectie-protocol voor HeLa-cellen geoptimaliseerd door verschillende parameters te cross-testen die de DNA-trans fectie op een 384-put, één plaat kunnen beïnvloeden, namelijk de totale DNA-hoeveelheid en Bron-DNA start concentratie, verdunnings vloeistofvolume, transfectie reagens, en aantal verspreidings cellen. Het ontwikkelde protocol omzeilt de hierboven beschreven handmatige beperkingen van celtransfectie en presenteert verschillende voordelen ten opzichte van andere geautomatiseerde transfectie pogingen. Ten eerste wordt het geminiaturiseerd, waardoor kostenbesparend transfectie-reagens kan worden bespaard door DNA-plasmide preparaten en transfectie-reagens op te slaan. Ten tweede, het is veel meer hoge doorvoer en reproduceerbare dan de handmatige Protocol (zelfs voor beginners), als transfectie van een hele 384-goed plaat kan worden bereikt in minder dan 1 h. Tot slot, het is software-gedreven, waardoor de controle van de gedoseerde DNA-hoeveelheid en de multiplexing van verschillende plasmiden. Inderdaad, dankzij de nano dispenser software (tabel van de materialen), kan de gebruiker een studie plan uitwerken om de volumes te controleren die van een gedefinieerde bron goed plaat naar een bestemming worden gedoseerd.
Het protocol dat hier wordt gepresenteerd, is vooral bedoeld voor diegenen die toegang hebben tot een nano dispenser en die transfectie experimenten willen opzetten met een hoge doorvoer, maar ook voor diegenen die hun transfectie parameters voor een bepaald celtype snel willen optimaliseren door Dit protocol toepassen om verschillende parameters bij hoge doorvoer te cross-testen. Inderdaad, we hebben aangetoond dat geoptimaliseerde parameters geïdentificeerd met dit nanoschaal protocol kunnen worden omgezet in grotere schaal en handmatige transfectie experimenten. Ten slotte, aangezien het in dit Protocol gebruikte transfectie reagens DNA of siRNA transfectie toestaat volgens de fabrikant, is het protocol ook van belang voor diegenen die zich richten op het uitvoeren van array benaderingen voor genoverexpressie of knockdown. De bestemmings platen die met DNA zijn gevuld, kunnen tot 7 dagen voor gebruik in een transfectie test worden bewaard zonder verlies van werkzaamheid, wat een ander voordeel is van het volgende protocol voor dit soort toepassingen.
Protocol
Representative Results
Discussion
Het opzetten en optimaliseren van een nauwkeurige hoge doorvoer transfectie methode voor een bepaalde cellijn vereisen wetenschappers om een aantal belangrijke parameters beschreven in deze sectie te volgen. We moedigen ten zeerste aan om te beginnen met de aanbevolen waarden in het Protocol, omdat deze instellingen die zijn geoptimaliseerd voor HeLa-cellen ook efficiënt bleken te zijn voor HEK-cellen. Aangezien de beste parameters echter afhankelijk kunnen zijn van de cellijnen en transfectie reagentia, kunnen optimale…
Declarações
The authors have nothing to disclose.
Acknowledgements
De auteurs onthulde een ontvangst van de volgende financiële steun voor het onderzoek, het auteurschap en/of de publicatie van dit artikel: INSERM, Universiteit van Lille, Lille Pasteur Institute, Conseil Régional du Nord, PRIM-HCV1 en 2 (Pôle de recherche Interdisciplinaire sur le Médicament), Agence nationale de la recherche (ANR-10-EQPX-04-01), de Feder (12001407 (D-AL) Equipex Imaginex BioMed) en de Europese Gemeenschap (ERC-STG INTRACELLTB n ° 260901). De auteurs willen Dr. S. Moureu, Dr. B. Villemagne, Dr. R. Ferru-Clément en Dr. H. Groult bedanken voor hun kritische beoordeling en correcties van het manuscript.
Materials
| 384LDV Microplate | Labcyte | LP-0200 | |
| 384-well Microplate μClear Black | Greiner | 781906 | |
| Ampicilin | Sigma | A9393-5G | Selection antibiotic for bacteria transformed with ampicilin expressing vector |
| Android Tablet | Samsung | Galaxy Note 8 | used to guide the user while the source plate manual dispense |
| Aniospray Surf 29 | Anios | 2421073 | disinfectant to clean the MicroFlo head |
| Columbus software | Perkin Elmer | image analysis software | |
| Dulbecco's Modified Eagle Medium (DMEM), high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 10566032 | cell culture medium |
| Echo Cherry Pick 1.5.3 software | Labcyte | Software enabling ADE-based dispenses by the Echo550 device from a *.csv file; nanodispenser software | |
| Echo550 | Labcyte | ADE-based dispenser | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | to add in cell culture medium |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | to fix cell |
| HeLa cells | ATCC | HeLa (ATCC® CCL-2™) | |
| Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | 10 mg/mL Solution in Water |
| INCell Analyzer 6000 | GE Healthcare | 29043323 | automated laser-based confocal imaging platform |
| LB medium | Thermoischer Scientific LB Broth Base (Lennox L Broth Base)®, powder |
12780052 | culture medium for bacteria growth |
| Lysis Buffer (A2) | Macherey-Nagel | 740912.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| MicroFlo 10µL cassette | Biotek Instruments Inc | 7170013 | to use with the Microflo Dispenser |
| MicroFlo 1μL cassette | Biotek Instruments Inc | 7170012 | to use with the Microflo Dispenser |
| MicroFlo Dispenser | Biotek Instruments Inc | 7171000 | peristaltic pump-based liquid handler device |
| Microvolume spectrophotometer | Denovix | DS-11 Spectrophotometer | Measure the DNA concentration of samples |
| mVenus plasmid | mVenus cDNA was cloned by enzymatic restriction digestion and ligation in Age1/BsrG1 sites of the tdTomato-N1 plasmid | Vector type: Mammalian Expression, Fusion Protein: mVenus | |
| Neutralization Buffer (A3) | Macherey-Nagel | 740913.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| NucleoSpin Plasmid kit | Macherey-Nagel | 740588.50 | used to prepare plasmid from bacterial culture |
| Optimal-Modified Eagle Medium (Opti-MEM) Medium | Thermo Fisher Scientific | 31985070 | |
| optional Wash bufferWash Buffer (A4) | Macherey-Nagel | 740914.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| orbital shaker | incubated large capacity shaker | 444-7084 | Used to grow bacteria under gentle agitation and 37°C |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 10,000 U/mL |
| Phosphate-Buffered Saline | Thermo Fisher Scientific | 10010001 | |
| Plasmid mini-columns | Macherey-Nagel | 740499.250 | Silica membrane mini-column to prepare plasmid from bacterial culture |
| Resuspension Buffer (A1) | Macherey-Nagel | 740911.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| RNAse A | Macherey-Nagel | 740505 | Enzyme from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| tdTomato-N1 plasmid | Addgene | Plasmid #54642 | Vector type: Mammalian Expression, Fusion Protein: tdTomato |
| TransIT-X2 Dynamic Delivery System | Mirus Bio | MIR 6000 | |
| Wash Buffer (AW) | Macherey-Nagel | 740916.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| 3D printer | Creality | CR10S | used to print the plate adapter |
| Blender Software | https://www.blender.org/ Free software under GNU General Public License (GPL). |
version 2.79b | used to design the plate adapter |
Referências
- Colin, B., Deprez, B., Couturier, C. High-Throughput DNA Plasmid Transfection Using Acoustic Droplet Ejection Technology. SLAS Discovery: Advancing Life Sciences R & D. , 2472555218803064 (2018).
- Mirus Bio. . Optimising Transfection Performance. , (2019).
- Thermo Fisher Scientific. . Factors Influencing Transfection Efficiency | Thermo Fisher Scientific – FR. , (2019).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Figueroa, E., et al. A mechanistic investigation exploring the differential transfection efficiencies between the easy-to-transfect SK-BR3 and difficult-to-transfect CT26 cell lines. Journal of Nanobiotechnology. 15 (1), 36 (2017).
- Kirchenbuechler, I., Kirchenbuechler, D., Elbaum, M. Correlation between cationic lipid-based transfection and cell division. Experimental Cell Research. 345 (1), 1-5 (2016).
- Zhang, Z., Qiu, S., Zhang, X., Chen, W. Optimized DNA electroporation for primary human T cell engineering. BMC Biotechnology. 18 (1), 4 (2018).
- Cao, D., et al. Transfection activity and the mechanism of pDNA-complexes based on the hybrid of low-generation PAMAM and branched PEI-1.8k. Molecular bioSystems. 9 (12), 3175-3186 (2013).
- Bos, A. B., et al. Development of a semi-automated high throughput transient transfection system. Journal of Biotechnology. 180, 10-16 (2014).
- Colosimo, A., et al. Transfer and expression of foreign genes in mammalian cells. BioTechniques. 29 (2), 314-318 (2000).
- Villa-Diaz, L. G., Garcia-Perez, J. L., Krebsbach, P. H. Enhanced transfection efficiency of human embryonic stem cells by the incorporation of DNA liposomes in extracellular matrix. Stem Cells and Development. 19 (12), 1949-1957 (2010).
- Sabatini, D. M. . Reverse transfection method. , WO2001020015A1 (2001).
- Raymond, C., et al. A simplified polyethylenimine-mediated transfection process for large-scale and high-throughput applications. Methods (San Diego, CA). 55 (1), 44-51 (2011).
- Junquera, E., Aicart, E. Recent progress in gene therapy to deliver nucleic acids with multivalent cationic vectors. Advances in Colloid and Interface Science. 233, 161-175 (2016).
- Woodruff, K., Maerkl, S. J. A High-Throughput Microfluidic Platform for Mammalian Cell Transfection and Culturing. Scientific Reports. 6, 23937 (2016).
- Vasileiou, T., Foresti, D., Bayram, A., Poulikakos, D., Ferrari, A. Toward Contactless Biology: Acoustophoretic DNA Transfection. Scientific Reports. 6, 20023 (2016).
- Hadimioglu, B., Stearns, R., Ellson, R. Moving Liquids with Sound: The Physics of Acoustic Droplet Ejection for Robust Laboratory Automation in Life Sciences. Journal of Laboratory Automation. 21 (1), 4-18 (2016).
- Grant, R. J., et al. Achieving accurate compound concentration in cell-based screening: validation of acoustic droplet ejection technology. Journal of Biomolecular Screening. 14 (5), 452-459 (2009).
- Sackmann, E. K., et al. Technologies That Enable Accurate and Precise Nano- to Milliliter-Scale Liquid Dispensing of Aqueous Reagents Using Acoustic Droplet Ejection. Journal of Laboratory Automation. 21 (1), 166-177 (2016).
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chemical Society Reviews. 38 (10), 2887-2921 (2009).
- Zielinski, D., Gordon, A., Zaks, B. L., Erlich, Y. iPipet: sample handling using a tablet. Nature Methods. 11 (8), 784-785 (2014).
- Brunner, S., et al. Cell cycle dependence of gene transfer by lipoplex, polyplex and recombinant adenovirus. Gene Therapy. 7 (5), 401-407 (2000).
- Nii, T., et al. Single-Cell-State Culture of Human Pluripotent Stem Cells Increases Transfection Efficiency. BioResearch Open Access. 5 (1), 127-136 (2016).
- Noonan, D. J., Henry, K., Twaroski, M. L. A High-Throughput Mammalian Cell-Based Transient Transfection Assay. Signal Transduction Protocols. 284, 051-066 (2004).
- . . Transfection | TransIT Transfection Reagents | Mirus Bio. , (2015).
- American Type Culture Collection. . General protocol for transfection of stem cells, primary cells, and continuous cell lines with ATCC TransfeX Transfection Reagent. , (2017).
- American Type Culture Collection. . Transfection Reagents for Nucleic Acid Transfer into ATCC Cells. , (2017).
- de Los Milagros Bassani Molinas, M., Beer, C., Hesse, F., Wirth, M., Wagner, R. Optimizing the transient transfection process of HEK-293 suspension cells for protein production by nucleotide ratio monitoring. Cytotechnology. 66 (3), 493-514 (2014).
- Promega. . FuGENE® 6 Transfection Reagent. , (2019).
- Olden, B. R., Cheng, Y., Yu, J. L., Pun, S. H. Cationic polymers for non-viral gene delivery to human T cells. Journal of Controlled Release: Official Journal of the Controlled Release Society. 282, 140-147 (2018).
- Park, E., Cho, H. B., Takimoto, K. Effective gene delivery into adipose-derived stem cells: transfection of cells in suspension with the use of a nuclear localization signal peptide-conjugated polyethylenimine. Cytotherapy. 17 (5), 536-542 (2015).
- Wood, R. W., Loomis, A. L. The physical and biological effects of high-frequency sound-waves of great intensity. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 4 (22), 417-436 (1927).
- Mamat, U., et al. Eliminating Endotoxin at the Source – A Novel Competent Cell Line with Modified Lipopolysaccharide for Low-Endotoxin Plasmid Production. , (2014).
- Ivanova, N. V., Kuzmina, M. L. Protocols for dry DNA storage and shipment at room temperature. Molecular Ecology Resources. 13 (5), 890-898 (2013).
- Lesnick, J., Lejeune-Dodge, A., Ruppert, N., Jarman, C. . High-Precision Cell Dispensing with the Labcyte Echo® Liquid Handler. , (2017).
- Yang, X., et al. A public genome-scale lentiviral expression library of human ORFs. Nature Methods. 8 (8), 659-661 (2011).
- Peng, J., Zhou, Y., Zhu, S., Wei, W. High-throughput screens in mammalian cells using the CRISPR-Cas9 system. The FEBS journal. 282 (11), 2089-2096 (2015).

