ध्वनिक नैनोडिजिंग प्रौद्योगिकी का उपयोग करते हुए उच्च-थ्रूपुट डीएनए प्लास्मिड मल्टीप्लेक्सिंग और ट्रांसफेक्शन
Summary
इस प्रोटोकॉल ध्वनिक छोटी बूंद इंजेक्शन प्रौद्योगिकी का उपयोग कर एक 384 अच्छी तरह से थाली में स्तनधारी कोशिकाओं के उच्च-थ्रूपुट प्लाज्मिड transfection का वर्णन करता है। समय लेने वाली, त्रुटि-प्रवण डीएनए वितरण और मल्टीप्लेक्सिंग, लेकिन यह भी ट्रांसफ़ेक्शन अभिकर्मक वितरण, सॉफ्टवेयर संचालित कर रहे हैं और एक नैनोडिस्पेंसर डिवाइस द्वारा प्रदर्शन किया। कोशिकाओं तो इन prefilled कुओं में बीज रहे हैं.
Abstract
सेल transfection, कई जैविक अध्ययन के लिए अपरिहार्य, एक सटीक और सफल उपलब्धि के लिए कई मापदंडों को नियंत्रित करने की आवश्यकता है. अक्सर कम थ्रूपुट पर प्रदर्शन किया जाता है, यह अधिक समय लेने वाली और त्रुटि-प्रवण होता है, और भी अधिक जब कई प्लाज्मिड्स का संकेत होता है। हम ध्वनिक छोटी बूंद इंजेक्शन (एडीई) प्रौद्योगिकी का उपयोग कर एक 384 अच्छी तरह से प्लेट लेआउट में सेल transfection प्रदर्शन करने के लिए एक आसान, तेज, और सटीक विधि विकसित की है। इस अध्ययन में इस्तेमाल किया नैनोडिस्पेंसर डिवाइस इस तकनीक पर आधारित है और एक स्रोत अच्छी तरह से प्लेट से एक गंतव्य के लिए उच्च गति पर सटीक नैनोvolume वितरण की अनुमति देता है। यह एक पूर्व डिजाइन स्प्रेडशीट के अनुसार और मल्टीप्लेक्स डीएनए और transfection अभिकर्मक वितरित कर सकते हैं. यहाँ हम एडीई आधारित उच्च-थ्रूपुट प्लाज्मिड ट्रांसफेक्शन करने के लिए एक इष्टतम प्रोटोकॉल प्रस्तुत करते हैं जो 90% तक की दक्षता तक पहुंचना संभव बनाता है और सह-परिवर्तन प्रयोगों में लगभग 100% सह-परिवर्तन करता है। हम एक उपयोगकर्ता के अनुकूल स्प्रेडशीट आधारित मैक्रो का प्रस्ताव द्वारा प्रारंभिक काम का विस्तार, अप करने के लिए एक पुस्तकालय से चार plasmids / मैक्रो स्रोत प्लेट (ओं) के आवश्यक टेम्पलेट (ओं) डिजाइन और नैनोडिस्पेंसर और टैबलेट आधारित आवेदन के लिए तैयार करने के लिए उपयोग फ़ाइलों को उत्पन्न करता है। चार कदम transfection प्रोटोकॉल मैं शामिल है) एक शास्त्रीय तरल हैंडलर के साथ एक diluent वितरण, ii) प्लाज्मिड वितरण और मल्टीप्लेक्सिंग, iii) नैनोडिस्पेंसर द्वारा एक transfection अभिकर्मक वितरण, और iv) सेल prefilled कुओं पर चढ़ाना. एई प्लाज्मिड मल्टीप्लेक्सिंग और ट्रांसफेक्शन का वर्णित सॉफ्टवेयर आधारित नियंत्रण क्षेत्र में गैर-विशेषज्ञों को भी एक तेज और सुरक्षित तरीके से एक विश्वसनीय सेल ट्रांसफेक्शन करने की अनुमति देता है। इस विधि एक दिया सेल प्रकार के लिए इष्टतम सेटिंग्स की तेजी से पहचान सक्षम बनाता है और उच्च पैमाने पर और मैनुअल दृष्टिकोण को स्थानांतरित किया जा सकता है. प्रोटोकॉल ऐसे मानव ORFeome प्रोटीन के रूप में अनुप्रयोगों को आसान बनाता है (एक जीनोम में खुला पढ़ने फ्रेम [ORFs] का सेट) अभिव्यक्ति या CRISPR-Cas9 आधारित जीन समारोह सत्यापन, nonpooled स्क्रीनिंग रणनीतियों में.
Introduction
यहाँ प्रस्तुत विधि विस्तार से वर्णन करता है कि कैसे डीएनए प्लाज्मिड मल्टीप्लेक्सिंग और उच्च थ्रूपुट में स्तनधारी कोशिकाओं में ट्रांसफेक्शन करने के लिए एक ध्वनिक-आधारित तरल नैनोडिस्पेंसर का उपयोग करते हुए 384-वेल प्लेट में, यहां तक कि क्षेत्र में गैर विशेषज्ञों के लिए। यह हाल ही में प्रकाशित विधि1 के रूप में ज्यादा के रूप में प्रदर्शन की अनुमति देता है 384 स्वतंत्र प्लाज्मिड डीएनए multiplexing और एक प्रयोग में transfection शर्तों, कम से कम 1 ज. एकल या cotransfection प्रयोगों सफल रहे थे, एक के पास तक पहुँचने 100% transfected कोशिकाओं की आबादी के भीतर cotransfection. इस प्रोटोकॉल transfection आसान बनाता है क्योंकि थकाऊ, समय लेने वाली, और त्रुटि प्रवण कदम के सबसे अब सॉफ्टवेयर संचालित कर रहे हैं (एक सामान्य सिंहावलोकन के लिए चित्र 1 देखें). समग्र प्रक्रिया के दौरान मानव त्रुटियों से बचने और क्षेत्र में गैर-विशेषज्ञों के लिए भी सफल ट्रांसफेक्शन को बढ़ावा देने के दौरान उपयोग में आसानी को बढ़ाने के लिए समर्पित उपकरण विकसित करने के लिए और भी प्रयास किए गए हैं। वर्णित प्रोटोकॉल में एक “उपयोगकर्ता-अनुकूल” मैक्रो स्प्रेडशीट शामिल है जिसे हमने प्रत्येक कुएं में चार प्लाज्मिड ्स्स तक के मल्टीप्लेक्सिंग संभावनाओं के साथ 384 स्वतंत्र ट्रांसफेक्शन स्थितियों का प्रबंधन करने के लिए विकसित किया है। मैक्रो स्वचालित रूप से स्टॉक समाधान शुरू करने से अपेक्षित डीएनए प्लाज्मिड वॉल्यूम लोड करने के लिए स्रोत प्लेट (ओं) के टेम्पलेट्स उत्पन्न करता है और इनपुट किए गए प्रयोगात्मक डिजाइन पर नैनोडिस्पेंसर सॉफ्टवेयर को चलाने के लिए आवश्यक फ़ाइलें। एक 384-वेल स्रोत प्लेट में डीएनए के मैनुअल वितरण थकाऊ और त्रुटि-प्रवण है के रूप में, हम भी एक समर्पित गोली आधारित आवेदन विकसित करने के लिए उपयोगकर्ता मार्गदर्शन करते हुए टेम्पलेट के अनुसार डीएनए समाधान वितरण.
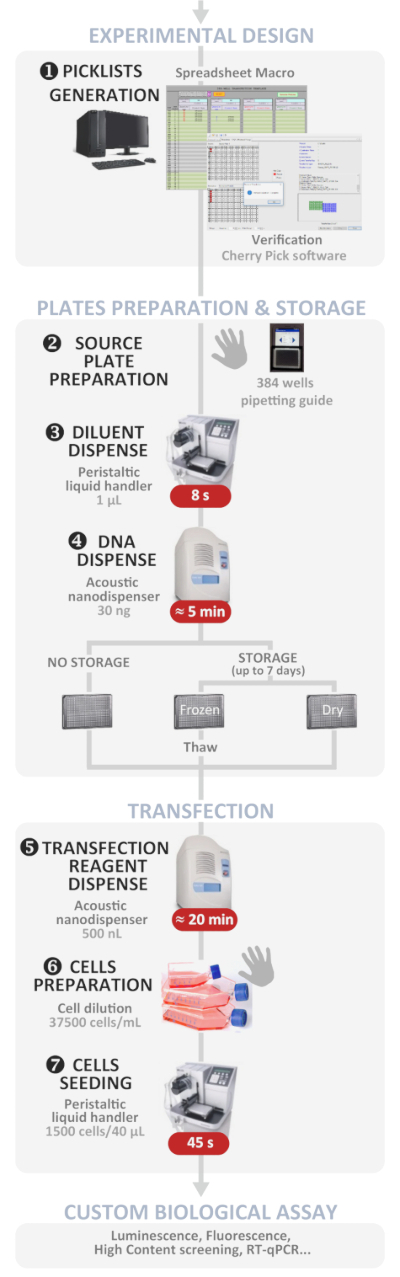
चित्र 1: प्रायोगिक कार्यप्रवाह. इष्टतम स्वचालित उच्च-थ्रूपुट रिवर्स ट्रांसफेक्शन प्रोटोकॉल (प्रयोगात्मक डिजाइन से कस्टम जैविक परख तक) का योजनाबद्ध प्रतिनिधित्व। मैनुअल कदम हाथ प्रतीक द्वारा इंगित कर रहे हैं और प्रत्येक चरण के लिए अनुमानित समय एक लाल बॉक्स में लिखा है. कृपया इस चित्र का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
कई सेल आधारित प्रयोगों प्लाज्मिड डीएनए transfection के साथ शुरू, और यहां तक कि अगर कई समर्पित अभिकर्मकों गया है और अभी भी transfection दक्षता बढ़ाने के लिए विकसितकिया जा रहा है और / , 4. डीएनए प्लाज्मिड सेल ट्रांसफेक्शन में उच्च दक्षता तक पहुंचने के लिए कई कदम शामिल हैं, जैसे प्रारंभिक जटिल तेज, एंडोसोमल पलायन, और कोशिकाद्रव्यी परिवहन नाभिक5,6. कैल्शियम वर्षा या समर्पित उपकरणों का उपयोग कर microporation या माइक्रोइंजेक्शन के रूप में शारीरिक तकनीकों के अलावा7, आधुनिक रासायनिक तरीकों डीएनए सेल वितरण को बढ़ाने पर ध्यान केंद्रित किया है, जबकि सेल cytoxicity8को कमकरने , 9. लिपिड या cationic पॉलिमर का उपयोग liposome की तरह परिसरों बनाने और, हाल ही में, nonliposomal बहुलक रसायन प्रणालियों transfection आसान और अधिक कुशल10बना दिया है. इन घटनाओं के बावजूद, सेल transfection अभी भी इन भौतिक या रासायनिक transfection प्रोटोकॉल के अधिकांश के रूप में सही प्रदर्शन किया जा करने के लिए विशिष्ट कौशल की आवश्यकता है मैन्युअल रूप से प्रत्येक डीएनए transfection प्रतिक्रिया हालत तैयार करने के लिए वैज्ञानिकों की आवश्यकता है, इस प्रकार थ्रूपुट को बाधित करना. इस समस्या को दरकिनार करने के लिए, रिवर्स ट्रांसफेक्शन प्रोटोकॉल को रासायनिक ट्रांसफेक्शन अभिकर्मकों11,12,13का उपयोग करके विकसित किया गया है, जिससे उपयोगकर्ता को कई प्लाज्मिड को तेज़ तरीके से परीक्षण करने या संयोजित करने में सक्षम बनाया जा सकता है। इन प्रोटोकॉल में, ट्रांसफेक्शन अभिकर्मकों के साथ न्यूक्लिक एसिड कॉम्प्लेक्स परिसरों पर कोशिकाओं को बोने से पहले बनते हैं। हालांकि, इन रिवर्स प्रोटोकॉल अभी भी डीएनए समाधान के मैनुअल हैंडलिंग द्वारा और स्वतंत्र स्थितियों में से प्रत्येक के संयोजन से सीमित हैं. हालांकि यह उन्हें एक 96 अच्छी तरह से प्लेट प्रारूप में प्रदर्शन करने के लिए संभव है, डीएनए की तैयारी और dispenses थकाऊ हो जाएगा, और वहाँ की संभावना गलतियों हो जाएगा. जब कई डीएनए प्लाज्मिड की विभिन्न मात्रा ओंटीया जाता है और एक दूसरे के साथ multiplexed होते हैं, तो सेल ट्रांसफेक्शन को प्राप्त करना और अधिक समय लेने वाली और अधिक समय लेने वाली और मानव त्रुटियों को प्राप्त करना और मानवीय त्रुटियां काफी अपरिहार्य हो जाती हैं। रिवर्स ट्रांसफेक्शन दृष्टिकोण में 384-वेल प्लेट प्रारूप तक स्केलिंग, कुछ बहुसंकेतित डीएनए ट्रांसफेक्शन स्थितियों के बावजूद, निम्नलिखित कारणों के कारण एक असंभव चुनौती बन जाती है। i) डीएनए मात्रा, transfection अभिकर्मक, या प्रतिक्रिया मिश्रण मात्रा का प्रबंधन करने के लिए प्रत्येक अच्छी तरह से के लिए 1 डिग्री सेल्सियस से कम कर रहे हैं. ii) 384 स्वतंत्र स्थितियों के लिए प्लाज्मिड का बहुसंकेतन अत्यंत जटिल हो जाता है। प्रत्येक 384 कुओं में वितरण भी iii) अत्यधिक समय लेने वाली और iv) त्रुटि-प्रवण है। वास्तव में, उम्मीद कुओं में सही समाधान वितरण का प्रबंधन करना मुश्किल है क्योंकि पहले से ही कम मात्रा में वितरित खाली और पहले से ही भरे कुओं के बीच दृश्य निगरानी की अनुमति नहीं है. v) अंत में, आवश्यक वितरण चरणों को करने के लिए आवश्यक समय के कारण कोशिकाओं को जोड़ने से पहले वाष्पीकरण द्वारा मिश्रण को सुखाने का उच्च जोखिम होता है। संक्षेप में, उच्च-थ्रूपुट डीएनए प्लाज्मिड ट्रांसफेक्शन परख स्थापित करने के लिए सीमित कारक परख का लघुकरण प्रतीत होता है, जिसका अर्थ है कि कम मात्रा वाले मल्टीप्लेक्सिंग और प्रबंधन जिसे मैन्युअल रूप से अब और नहीं संभाला जा सकता है, लेकिन यह भी शायद ही एक में प्राप्त किया जा सकता है शास्त्रीय peristatic तरल संचालकों द्वारा विश्वसनीय तरीका है.
कठिनाई का एक सबूत के रूप में इस तरह के assays automatize और उच्च-थ्रूपुट लाभ, केवल कुछ प्रयास transfection को स्वचालित करने के लिए अब तक प्रकाशित किया गया है: एक 96 अच्छी तरह से प्लेट प्रारूप एक वाणिज्यिक तरल हैंडलिंग डिवाइस और कैल्शियम फॉस्फेट वर्षा14 का उपयोग कर और, हाल ही में, एक lipoplex अभिकर्मक, और एक microfluidic चिप सक्षम करने के 280 स्वतंत्र transfections15 लेकिन इस क्षेत्र में विशेष कौशल की आवश्यकता होती है. एक अन्य विधि, acoustophoresis, तरल levitation की अनुमति और तरल पदार्थ हेरफेर और मिश्रण करने के लिए अग्रणी, 24 में डीएनए transfection प्रदर्शन करने के लिए इस्तेमाल किया गया था 96 अच्छी तरह से प्लेट प्रारूपों16. हालांकि संभव है, इस दृष्टिकोण एक बहुत कम थ्रूपुट से ग्रस्त है क्योंकि डीएनए ट्रांसफेक्शन मिश्रण के साथ कोशिकाओं के मिश्रण को बोने से पहले हर एक बिंदु के लिए 60 एस ऊष्मायन की आवश्यकता होती है। यह एक पूर्ण 96 अच्छी तरह से थाली के लिए कम से कम 96 मिनट की अवधि का तात्पर्य है. इसके अलावा, इस प्रोटोकॉल दूर समग्र जीवविज्ञानियों ‘दर्शकों के लिए अनुकूल होने से दूर है के रूप में यह काम एक घर में डिजाइन और निर्मित उपकरण है जो वर्तमान में बाजार पर उपलब्ध नहीं है के साथ किया गया था. इसके विपरीत, पिछले कुछ वर्षों में, सॉफ्टवेयर संचालित ध्वनिक आधारित वितरण प्रौद्योगिकी का उपयोग करने के लिए एक आसान नैनोवॉल्यूम मशीन उपकरणों के साथ उभरा है। केंद्रित ध्वनिक ऊर्जा का उपयोग करके, इन उपकरणों के एक गंतव्य एक17करने के लिए एक स्रोत प्लेट से 500 एनएल करने के लिए 2.5 एनएल से छोटे तरल मात्रा के कसकर नियंत्रित निष्कासन की अनुमति देते हैं। इस तकनीक, ध्वनिक छोटी बूंद निष्कासन (एडीई) कहा जाता है, कई फायदे हैं: यह पूरी तरह से स्वचालित है, contactless, tipless, सटीक, सटीक, और अत्यधिक reproduible, और यह एक उच्च थ्रूपुट18है. सबसे पहले डाइमेथिल सल्फोक्साइड (DMSO) समाधान देने के लिए समर्पित, सेटिंग्स जलीय बफ़र्स19वितरित करने के लिए बढ़ाया गया है। ध्वनिक नैनोडिस्पेंसर, तो, रिवर्स सेल ट्रांसफेक्शन प्रोटोकॉल के लिए उपयुक्त लगते हैं और उपर्युक्त मैनुअल सीमाओं में से अधिकांश को दरकिनार कर सकते हैं। के रूप में कोई प्लाज्मिड transfection प्रयास पहले इस तकनीक का उपयोग कर वर्णित किया गया था, हम हाल ही में रिवर्स सेल transfection प्रदर्शन करने के लिए एक ध्वनिक आधारित वितरण प्रणाली की उपयुक्तता का मूल्यांकन किया।
नैनोडिस्पेंसर थ्रूपुट और उपयोग में आसानी का लाभ उठाते हुए, हमने Hela कोशिकाओं के लिए एक रिवर्स ट्रांसफेक्शन प्रोटोकॉल को कई पैरामीटरों का क्रॉस-टेस्टिंग करके अनुकूलित किया है जो 384-वेल पर डीएनए ट्रांसफेक्शन को प्रभावित कर सकते हैं, एकल प्लेट, अर्थात्, कुल डीएनए राशि और स्रोत डीएनए शुरू एकाग्रता, diluent मात्रा, transfection अभिकर्मक, और प्रसार कोशिकाओं की संख्या. विकसित प्रोटोकॉल सेल transfection के ऊपर वर्णित मैनुअल सीमाओं को दरकिनार और अन्य स्वचालित transfection प्रयासों पर कई लाभ प्रस्तुत करता है. सबसे पहले, यह miniaturized है, इस प्रकार डीएनए प्लाज्मिड तैयारी और transfection अभिकर्मक को बचाने के द्वारा लागत प्रभावी transfection अभिकर्मक के लिए अनुमति देता है. दूसरे, यह बहुत अधिक उच्च throughput और मैनुअल प्रोटोकॉल की तुलना में reproducible है (यहां तक कि शुरुआती के लिए), एक पूरे 384 अच्छी तरह से थाली के transfection के रूप में कम से कम 1 एच में प्राप्त किया जा सकता है. अंत में, यह सॉफ्टवेयर संचालित है, वितरित डीएनए राशि के नियंत्रण और कई प्लाज्मिड के multixing की अनुमति. दरअसल, नैनोडिस्पेंसर सॉफ्टवेयर(सामग्री कीतालिका) के लिए धन्यवाद, उपयोगकर्ता एक निर्धारित स्रोत अच्छी तरह से एक गंतव्य के लिए प्लेट से वितरित किया जा करने के लिए मात्रा को नियंत्रित करने के लिए एक अध्ययन योजना विस्तृत कर सकते हैं।
यहाँ प्रस्तुत प्रोटोकॉल मुख्य रूप से जो एक नैनोडिस्पेंसर के लिए उपयोग किया है और उच्च थ्रूपुट पर transfection प्रयोगों की स्थापना करना चाहते हैं के लिए करना है, लेकिन यह भी जो तेजी से एक दिया सेल प्रकार के लिए अपने transfection मापदंडों का अनुकूलन करना चाहते हैं के लिए उच्च थ्रूपुट पर कई पैरामीटर का क्रॉस-परीक्षण करने के लिए इस प्रोटोकॉल को लागू करना. वास्तव में, हमने दिखाया है कि इस नैनोस्केल प्रोटोकॉल के साथ पहचाने गए अनुकूलित पैरामीटरों को बड़े पैमाने पर और मैन्युअल ट्रांसफेलेशन प्रयोगों में स्थानांतरित किया जा सकता है। अंत में, के रूप में वर्तमान प्रोटोकॉल में इस्तेमाल transfection अभिकर्मक निर्माता के अनुसार डीएनए या siRNA transfection की अनुमति देता है, प्रोटोकॉल भी जीन overexpression या knockdown के लिए सरणी दृष्टिकोण प्रदर्शन करने पर लक्ष्य उन लोगों के लिए ब्याज की है. गंतव्य प्लेटें डीएनए के साथ prefilled अप करने के लिए संरक्षित किया जा सकता है 7 प्रभावोत्पादकता के नुकसान के बिना एक transfection परख में उपयोग करने से पहले, जो आवेदन के इस प्रकार के लिए निम्नलिखित प्रोटोकॉल का एक और लाभ है.
Protocol
Representative Results
Discussion
किसी दिए गए सेल लाइन के लिए एक सटीक उच्च-थ्रूपुट ट्रांसफेक्शन विधि की स्थापना और अनुकूलन के लिए वैज्ञानिकों को इस खंड में वर्णित कुछ प्रमुख मापदंडों का पालन करने की आवश्यकता होती है। हम दृढ़ता से प्रो?…
Declarações
The authors have nothing to disclose.
Acknowledgements
लेखकों अनुसंधान, authorship, और / या इस लेख के प्रकाशन के लिए निम्नलिखित वित्तीय सहायता की एक रसीद का खुलासा किया: Inserm, लील पाश्चर संस्थान, Conseil R$gional du Nord, और PRIM-HCV1 और 2 (P$le de Recherche Interdisciplinaire sur le M$dicament), Agence Nationale de la Recherche (ANR-10-EQPX-04-01), फेडर (12001407 (D-AL) लैसेक्स कल्पना बायोमेड) और यूरोपीय समुदाय (ईआरसी-एसटीजी इन्ट्रासेलटीबी एन डिग्री 260901)। लेखक डॉ एस Moureu, डॉ बी Villemagne, डॉ आर Feru-Clment, और डॉ एच Groult उनकी महत्वपूर्ण समीक्षा और पांडुलिपि के सुधार के लिए धन्यवाद देना चाहते हैं।
Materials
| 384LDV Microplate | Labcyte | LP-0200 | |
| 384-well Microplate μClear Black | Greiner | 781906 | |
| Ampicilin | Sigma | A9393-5G | Selection antibiotic for bacteria transformed with ampicilin expressing vector |
| Android Tablet | Samsung | Galaxy Note 8 | used to guide the user while the source plate manual dispense |
| Aniospray Surf 29 | Anios | 2421073 | disinfectant to clean the MicroFlo head |
| Columbus software | Perkin Elmer | image analysis software | |
| Dulbecco's Modified Eagle Medium (DMEM), high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 10566032 | cell culture medium |
| Echo Cherry Pick 1.5.3 software | Labcyte | Software enabling ADE-based dispenses by the Echo550 device from a *.csv file; nanodispenser software | |
| Echo550 | Labcyte | ADE-based dispenser | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | to add in cell culture medium |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | to fix cell |
| HeLa cells | ATCC | HeLa (ATCC® CCL-2™) | |
| Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | 10 mg/mL Solution in Water |
| INCell Analyzer 6000 | GE Healthcare | 29043323 | automated laser-based confocal imaging platform |
| LB medium | Thermoischer Scientific LB Broth Base (Lennox L Broth Base)®, powder |
12780052 | culture medium for bacteria growth |
| Lysis Buffer (A2) | Macherey-Nagel | 740912.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| MicroFlo 10µL cassette | Biotek Instruments Inc | 7170013 | to use with the Microflo Dispenser |
| MicroFlo 1μL cassette | Biotek Instruments Inc | 7170012 | to use with the Microflo Dispenser |
| MicroFlo Dispenser | Biotek Instruments Inc | 7171000 | peristaltic pump-based liquid handler device |
| Microvolume spectrophotometer | Denovix | DS-11 Spectrophotometer | Measure the DNA concentration of samples |
| mVenus plasmid | mVenus cDNA was cloned by enzymatic restriction digestion and ligation in Age1/BsrG1 sites of the tdTomato-N1 plasmid | Vector type: Mammalian Expression, Fusion Protein: mVenus | |
| Neutralization Buffer (A3) | Macherey-Nagel | 740913.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| NucleoSpin Plasmid kit | Macherey-Nagel | 740588.50 | used to prepare plasmid from bacterial culture |
| Optimal-Modified Eagle Medium (Opti-MEM) Medium | Thermo Fisher Scientific | 31985070 | |
| optional Wash bufferWash Buffer (A4) | Macherey-Nagel | 740914.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| orbital shaker | incubated large capacity shaker | 444-7084 | Used to grow bacteria under gentle agitation and 37°C |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 10,000 U/mL |
| Phosphate-Buffered Saline | Thermo Fisher Scientific | 10010001 | |
| Plasmid mini-columns | Macherey-Nagel | 740499.250 | Silica membrane mini-column to prepare plasmid from bacterial culture |
| Resuspension Buffer (A1) | Macherey-Nagel | 740911.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| RNAse A | Macherey-Nagel | 740505 | Enzyme from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| tdTomato-N1 plasmid | Addgene | Plasmid #54642 | Vector type: Mammalian Expression, Fusion Protein: tdTomato |
| TransIT-X2 Dynamic Delivery System | Mirus Bio | MIR 6000 | |
| Wash Buffer (AW) | Macherey-Nagel | 740916.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| 3D printer | Creality | CR10S | used to print the plate adapter |
| Blender Software | https://www.blender.org/ Free software under GNU General Public License (GPL). |
version 2.79b | used to design the plate adapter |
Referências
- Colin, B., Deprez, B., Couturier, C. High-Throughput DNA Plasmid Transfection Using Acoustic Droplet Ejection Technology. SLAS Discovery: Advancing Life Sciences R & D. , 2472555218803064 (2018).
- Mirus Bio. . Optimising Transfection Performance. , (2019).
- Thermo Fisher Scientific. . Factors Influencing Transfection Efficiency | Thermo Fisher Scientific – FR. , (2019).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Figueroa, E., et al. A mechanistic investigation exploring the differential transfection efficiencies between the easy-to-transfect SK-BR3 and difficult-to-transfect CT26 cell lines. Journal of Nanobiotechnology. 15 (1), 36 (2017).
- Kirchenbuechler, I., Kirchenbuechler, D., Elbaum, M. Correlation between cationic lipid-based transfection and cell division. Experimental Cell Research. 345 (1), 1-5 (2016).
- Zhang, Z., Qiu, S., Zhang, X., Chen, W. Optimized DNA electroporation for primary human T cell engineering. BMC Biotechnology. 18 (1), 4 (2018).
- Cao, D., et al. Transfection activity and the mechanism of pDNA-complexes based on the hybrid of low-generation PAMAM and branched PEI-1.8k. Molecular bioSystems. 9 (12), 3175-3186 (2013).
- Bos, A. B., et al. Development of a semi-automated high throughput transient transfection system. Journal of Biotechnology. 180, 10-16 (2014).
- Colosimo, A., et al. Transfer and expression of foreign genes in mammalian cells. BioTechniques. 29 (2), 314-318 (2000).
- Villa-Diaz, L. G., Garcia-Perez, J. L., Krebsbach, P. H. Enhanced transfection efficiency of human embryonic stem cells by the incorporation of DNA liposomes in extracellular matrix. Stem Cells and Development. 19 (12), 1949-1957 (2010).
- Sabatini, D. M. . Reverse transfection method. , WO2001020015A1 (2001).
- Raymond, C., et al. A simplified polyethylenimine-mediated transfection process for large-scale and high-throughput applications. Methods (San Diego, CA). 55 (1), 44-51 (2011).
- Junquera, E., Aicart, E. Recent progress in gene therapy to deliver nucleic acids with multivalent cationic vectors. Advances in Colloid and Interface Science. 233, 161-175 (2016).
- Woodruff, K., Maerkl, S. J. A High-Throughput Microfluidic Platform for Mammalian Cell Transfection and Culturing. Scientific Reports. 6, 23937 (2016).
- Vasileiou, T., Foresti, D., Bayram, A., Poulikakos, D., Ferrari, A. Toward Contactless Biology: Acoustophoretic DNA Transfection. Scientific Reports. 6, 20023 (2016).
- Hadimioglu, B., Stearns, R., Ellson, R. Moving Liquids with Sound: The Physics of Acoustic Droplet Ejection for Robust Laboratory Automation in Life Sciences. Journal of Laboratory Automation. 21 (1), 4-18 (2016).
- Grant, R. J., et al. Achieving accurate compound concentration in cell-based screening: validation of acoustic droplet ejection technology. Journal of Biomolecular Screening. 14 (5), 452-459 (2009).
- Sackmann, E. K., et al. Technologies That Enable Accurate and Precise Nano- to Milliliter-Scale Liquid Dispensing of Aqueous Reagents Using Acoustic Droplet Ejection. Journal of Laboratory Automation. 21 (1), 166-177 (2016).
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chemical Society Reviews. 38 (10), 2887-2921 (2009).
- Zielinski, D., Gordon, A., Zaks, B. L., Erlich, Y. iPipet: sample handling using a tablet. Nature Methods. 11 (8), 784-785 (2014).
- Brunner, S., et al. Cell cycle dependence of gene transfer by lipoplex, polyplex and recombinant adenovirus. Gene Therapy. 7 (5), 401-407 (2000).
- Nii, T., et al. Single-Cell-State Culture of Human Pluripotent Stem Cells Increases Transfection Efficiency. BioResearch Open Access. 5 (1), 127-136 (2016).
- Noonan, D. J., Henry, K., Twaroski, M. L. A High-Throughput Mammalian Cell-Based Transient Transfection Assay. Signal Transduction Protocols. 284, 051-066 (2004).
- . . Transfection | TransIT Transfection Reagents | Mirus Bio. , (2015).
- American Type Culture Collection. . General protocol for transfection of stem cells, primary cells, and continuous cell lines with ATCC TransfeX Transfection Reagent. , (2017).
- American Type Culture Collection. . Transfection Reagents for Nucleic Acid Transfer into ATCC Cells. , (2017).
- de Los Milagros Bassani Molinas, M., Beer, C., Hesse, F., Wirth, M., Wagner, R. Optimizing the transient transfection process of HEK-293 suspension cells for protein production by nucleotide ratio monitoring. Cytotechnology. 66 (3), 493-514 (2014).
- Promega. . FuGENE® 6 Transfection Reagent. , (2019).
- Olden, B. R., Cheng, Y., Yu, J. L., Pun, S. H. Cationic polymers for non-viral gene delivery to human T cells. Journal of Controlled Release: Official Journal of the Controlled Release Society. 282, 140-147 (2018).
- Park, E., Cho, H. B., Takimoto, K. Effective gene delivery into adipose-derived stem cells: transfection of cells in suspension with the use of a nuclear localization signal peptide-conjugated polyethylenimine. Cytotherapy. 17 (5), 536-542 (2015).
- Wood, R. W., Loomis, A. L. The physical and biological effects of high-frequency sound-waves of great intensity. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 4 (22), 417-436 (1927).
- Mamat, U., et al. Eliminating Endotoxin at the Source – A Novel Competent Cell Line with Modified Lipopolysaccharide for Low-Endotoxin Plasmid Production. , (2014).
- Ivanova, N. V., Kuzmina, M. L. Protocols for dry DNA storage and shipment at room temperature. Molecular Ecology Resources. 13 (5), 890-898 (2013).
- Lesnick, J., Lejeune-Dodge, A., Ruppert, N., Jarman, C. . High-Precision Cell Dispensing with the Labcyte Echo® Liquid Handler. , (2017).
- Yang, X., et al. A public genome-scale lentiviral expression library of human ORFs. Nature Methods. 8 (8), 659-661 (2011).
- Peng, J., Zhou, Y., Zhu, S., Wei, W. High-throughput screens in mammalian cells using the CRISPR-Cas9 system. The FEBS journal. 282 (11), 2089-2096 (2015).

