음향 나노 디스펜싱 기술을 사용한 고처리량 DNA 플라스미드 멀티플렉싱 및 트랜스펙션
Summary
이 프로토콜은 음향 액적 배출 기술을 사용하여 384 웰 플레이트에서 포유류 세포의 고처리량 플라스미드 형질 감염을 설명합니다. 시간이 많이 소요되고 오류가 발생하기 쉬운 DNA 디스펜싱과 트랜스펙션 시약 디스펜싱은 나노 에스터디터 장치에 의해 소프트웨어 구동 및 수행됩니다. 세포는 다음 이 미리 채워진 우물에서 파종됩니다.
Abstract
많은 생물학적 연구에 필수적인 세포 형질감염은 정확하고 성공적인 성취를 위해 많은 매개 변수를 제어해야 합니다. 대부분의 경우 낮은 처리량에서 수행, 그것은 또한 시간이 많이 걸리고 오류가 발생하기 쉬운, 더 많은 그래서 여러 플라스미드를 다중화 할 때. 우리는 음향 액적 배출 (ADE) 기술을 사용하여 384 웰 플레이트 레이아웃에서 세포 변환을 수행하는 쉽고 빠르며 정확한 방법을 개발했습니다. 본 연구에 사용되는 나노 디스펜서 장치는 이 기술을 기반으로 하며 소스 웰 플레이트에서 대상 플레이트까지 고속으로 정밀한 나노부피 전달을 허용합니다. 미리 디자인된 스프레드시트에 따라 DNA 및 트랜스펙트 시약을 분배하고 분배할 수 있습니다. 여기에서 우리는 최대 90%의 효율과 cotransfection 실험에서 거의 100%의 연전율에 도달할 수 있게 하는 ADE 기반고처리량 플라스미드 형혈을 수행하기 위한 최적의 프로토콜을 제시합니다. 사용자 친화적인 스프레드시트 기반 매크로를 제안하여 최대 1,536개의 플라스미드를 포함하는 라이브러리에서 최대 4개의 플라스미드/웰을 관리할 수 있으며 태블릿 기반 파이펫팅 가이드 응용 프로그램을 제안하여 초기 작업을 확장합니다. 매크로는 소스 플레이트의 필요한 템플릿을 설계하고 나노 디스펜서 및 태블릿 기반 응용 프로그램에 대한 즉시 사용 파일을 생성합니다. 4단계 형질전환 프로토콜은 i) 고전적인 액체 처리기를 가진 희석제 디스펜스, ii) 플라스미드 분포 및 멀티플렉싱, iii) 나노디스펜서에 의한 트랜스펙션 시약 디스펜스, 및 iv) 미리 채워진 웰상에서의 세포 도금과 관련이 있다. ADE 플라스미드 멀티플렉싱 및 트랜스펙션의 기술된 소프트웨어 기반 제어를 통해 현장의 비전문가조차도 빠르고 안전한 방법으로 신뢰할 수 있는 세포 형질변환을 수행할 수 있습니다. 이 방법을 사용하면 지정된 셀 유형에 대한 최적의 설정을 신속하게 식별할 수 있으며 더 높은 규모및 수동 접근법으로 전환할 수 있습니다. 이 프로토콜은 비풀스닝 전략에서 인간 ORFeome 단백질(게놈에서 열린 판독 프레임 [ORFs] 세트) 발현 또는 CRISPR-Cas9 기반 유전자 기능 유효성 검사와 같은 응용을 용이하게 합니다.
Introduction
여기에 제시된 방법은 384웰 플레이트에서 음향 기반 액체 나노디스터를 사용하여 높은 처리량에서 포유류 세포에서 DNA 플라스미드 멀티플렉싱 및 트랜스펙션을 수행하는 방법을 자세히 설명하며, 심지어 현장의 비전문가를 위한 것입니다. 이 최근 발표된 방법 1은 한 실험에서 384개의 독립적인 플라스미드 DNA 다중화 및 형질전환 조건을 1시간 미만으로 수행할 수 있게 해주며, 단일 또는 배전 실험이 성공하여 거의 100%에 이르렀습니다. 형질 감염된 세포 집단 내의 환전. 이 프로토콜은 지루하고 시간이 많이 소요되며 오류가 발생하기 쉬운 대부분의 단계가 이제 소프트웨어 기반이기 때문에 더 쉽게 변환할 수 있습니다(일반적인 개요의 경우 그림 1 참조). 또한 전체 프로세스 중에 사람의 실수를 피하면서 사용 편의성을 높이고 현장의 비전문가에게도 성공적인 트랜스펙션을 촉진하기 위한 전용 도구를 개발하기 위해 더욱 노력했습니다. 설명된 프로토콜에는 384개의 독립적인 형질감염 조건을 관리하기 위해 개발한 “사용자 친화적인” 매크로 스프레드시트가 포함되어 있으며, 각 우물에서 최대 4개의 플라스미드의 다중화 가능성이 있습니다. 매크로는 소스 플레이트의 템플릿을 자동으로 생성하여 시작 스톡 솔루션에서 예상되는 DNA 플라스미드 볼륨을 로드하고 입력된 실험 설계에 나노 스테스터 소프트웨어를 구동하는 데 필요한 파일을 생성합니다. 384웰 소스 플레이트에서 DNA의 수동 분배는 지루하고 오류가 발생하기 쉽기 때문에 템플릿에 따라 DNA 솔루션을 분배하는 동안 사용자를 안내하는 전용 태블릿 기반 응용 프로그램을 개발했습니다.
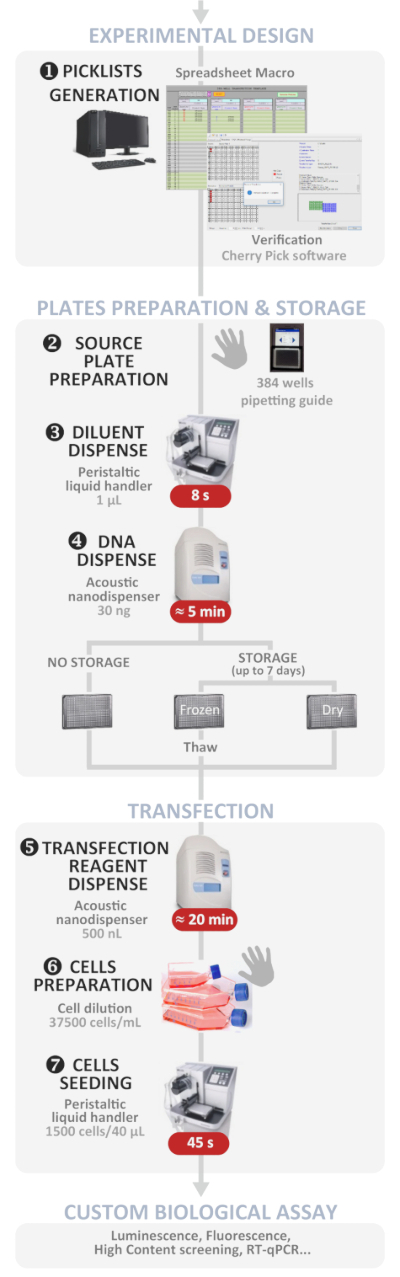
그림 1: 실험 워크플로우. 최적의 자동화 된 고처리량 역형 변환 프로토콜 (실험 설계에서 맞춤형 생물학적 분석)의 회로도 표현. 수동 단계는 손 기호로 표시되고 각 단계의 대략적인 시간은 빨간색 상자에 기록됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
많은 세포 기반 실험은 플라스미드 DNA 형혈로 시작하며, 많은 전용 시약이 형질 감염 효율을 향상시키고 절차를 용이하게하기 위해 여전히 개발되고 있더라도많은것이 2,3을 수행해야합니다. , 4.DNA 플라스미드 세포 형질감염은 초기 복합적인 흡기, 내인성 탈출, 및 핵으로의 세포질 수송과 같은 고효율에 도달하기 위한 여러 단계를 수반한다 5,6. 칼슘 침전 또는 전용 장치를 사용하여 전기 천공 또는 미세주입과 같은 물리적 기술 이외에 7, 현대 화학 적 방법은 세포 독성을 낮추면서 DNA 세포 전달을 향상시키는 데 중점을 두어8, 9. 지질 또는 양이온 폴리머를 사용하여 리포솜과 같은 복합체를 형성하고, 최근에는 비리포솜 중합체 화학 시스템을 사용하여 형질전환을 쉽고 효율적으로10. 이러한 발달에도 불구하고, 세포 형질감염은 여전히 이러한 물리적 또는 화학적 형질감염 프로토콜의 대부분이 과학자들이 각 DNA 형질감염 반응 상태를 수동으로 준비하도록 요구하기 때문에 정확하게 수행되어야 하는 특정 기술을 필요로 합니다. 처리량을 손상시게 할 수 있습니다. 이 문제를 우회하기 위해, 역형질 감염 프로토콜은 화학형질 감염 시약11,12,13을사용하여 개발되어 사용자가 더 빠른 방법으로 여러 플라스미드를 테스트하거나 결합할 수 있게 합니다. 이 프로토콜에서, 형질감염 시약을 가진 핵산 복합체는 복합체에 세포를 파종하기 전에 형성된다. 그러나, 이러한 역프로토콜은 DNA 솔루션의 수동 처리및 각각의 독립적인 조건의 조합에 의해 여전히 제한된다. 96 웰 플레이트 형식으로 수행하는 것이 가능하지만 DNA 준비 및 분배는 지루할 것이며 실수가 있을 것입니다. 여러 DNA 플라스미드의 다른 양이 필요하고 서로 다중화 될 때, 세포 형질전환은 달성하기 가 더욱 어려워지고 더 많은 시간이 소요되고, 인간의 오류는 매우 피할 수없게된다. 역형질 접근법에서 384 웰 플레이트 포맷까지 스케일링하면 다중화 된 DNA 형질 감염 조건에도 불구하고 다음과 같은 이유로 인해 불가능한 도전이됩니다. i) 관리해야 할 DNA 양, 형질감염 시약 또는 반응 혼합물 부피는 각각의 웰에 대해 1 μL 보다 낮다. ii) 384 개의 독립적 인 조건에 대한 플라스 미드의 멀티플렉싱은 매우 복잡해집니다. 각각의 384웰의 전달은 또한 iii) 매우 시간이 많이 소요되고 iv) 오류가 발생하기 쉽다. 실제로, 이미 분배된 낮은 볼륨은 빈 우물과 이미 채워진 웰 사이의 시각적 모니터링을 허용하지 않기 때문에 예상 웰에서 올바른 솔루션을 분배하는 것은 관리하기 가 어렵습니다. v) 마지막으로, 필요한 디스펜싱 단계를 수행하는 데 필요한 시간으로 인해 세포가 첨가되기 전에 증발에 의해 혼합물을 건조할 위험이 높다. 요약하면, 고처리량 DNA 플라스미드 형질감염 분석제를 설정하는 제한 요인은 더 이상 수동으로 처리할 수 없는 저용량 멀티플렉싱 및 관리를 의미하는 분석의 소형화로 보이지만, 고전적인 주압 액체 처리기에 의해 신뢰할 수있는 방법.
이러한 분석을 자동화하고 높은 처리량을 얻는 데 어려움을 입증하기 위해, 형혈을 자동화하는 몇 가지 시도만이 지금까지 발표되었습니다 : 상업용 액체 처리 장치 및 칼슘 인산염 침전물을 사용하는 96 웰 플레이트 형식14 그리고, 최근에는 리포플렉스 시약, 및 280개의 독립적인 형질전환15를 가능하게 하는 미세유체 칩이지만 이 분야에서 는 전문기술이 요구되고 있다. 또 다른 방법, acoustophoresis, 액체 부양을 허용하고 유체 조작 및 혼합으로 이어지는, 24- 96 웰 플레이트 포맷16에서DNA 형질 변환을 수행하는 데 사용되었다. 가능하지만, 이 접근법은 DNA 형질전환 혼합물과 세포의 혼합이 파종되기 전에 모든 단일 지점에 대해 60 초의 배양을 필요로 하기 때문에 매우 낮은 처리량을 겪습니다. 이것은 완전한 96 웰 플레이트에 대해 적어도 96 분의 지속 시간을 의미합니다. 또한,이 프로토콜은 이 작업이 현재 시장에서 사용할 수없는 사내 설계 및 제조 장치로 수행되었기 때문에 전체 생물학자의 청중에게 허용되지 않습니다. 반대로, 지난 몇 년 동안, 사용하기 쉬운 소프트웨어 기반 음향 기반 디스펜싱 기술은 나노 볼륨 디스펜서 장치와 함께 등장했다. 집중된 음향 에너지를 사용하여 이러한 장치는 소스 플레이트에서 목적지17까지2.5 nL ~ 500 nL의 작은 액체 볼륨을 엄격하게 제어할 수 있습니다. 음향 액적 배출 (ADE)이라고 불리는이 기술은 많은 장점을 가지고 있습니다 : 그것은 완전히 자동화되고, 비접촉식, 팁리스, 정확하고, 매우 재현 가능하며, 높은 처리량18을가지고 있습니다. 먼저 디메틸 설폭사이드(DMSO) 솔루션을 제공하는 데 전념하여 수성버퍼(19)를분배하도록 설정이 향상되었습니다. 그런 다음 음향 나노 에스터는 역세포 형질 감염 프로토콜에 적합한 것처럼 보이며 위에서 언급 한 대부분의 수동 제한 사항을 우회 할 수 있습니다. 이 기술을 사용하여 플라스미드 형질 전환 시도가 이전에 설명되지 않았던 것처럼, 우리는 최근에 역세포 형질변환을 수행하기 위한 음향 기반 디스펜싱 시스템의 적합성을 평가했습니다.
나노 에스터디스터 처리량과 사용 편의성을 활용하여 384 웰, 단일 플레이트, 즉 총 DNA 양에 대한 DNA 형질감염에 영향을 줄 수 있는 여러 매개 변수를 교차 테스트하여 HeLa 세포에 대한 역형질 감염 프로토콜을 최적화하고 소스 DNA 시작 농도, 희석제 볼륨, 형질 전환 시약, 및 확산 세포의 수. 개발된 프로토콜은 전술한 세포 형질감염의 수동 한계를 우회하고 다른 자동화된 형질감염 시도에 비해 몇 가지 이점을 제시한다. 첫째, 그것은 소형화되어 DNA 플라스미드 제제 및 형질감염 시약을 저장하여 비용 효율적인 형질 감염 시약을 허용합니다. 둘째, 전체 384 웰 플레이트의 트랜스펙션이 1시간 미만으로 달성될 수 있기 때문에 수동 프로토콜(초보자도 마찬가지)보다 훨씬 높은 처리량과 재현력이 있습니다. 마지막으로, 그것은 소프트웨어 구동, 디스펜싱 된 DNA 양의 제어 및 여러 플라스미드의 멀티플렉싱을 허용. 실제로, 나노에스터 소프트웨어(TableofMaterials)를 통해 사용자는 정의된 소스 웰 플레이트로부터 대상플레이트로 분배되는 부피를 제어하는 연구 계획을 정교하게 할 수 있다.
여기에 제시 된 프로토콜은 주로 나노 에이체에 액세스 할 수 있고 높은 처리량에서 형질 감염 실험을 설정하고자하는 사람들을 위한 것입니다, 뿐만 아니라 신속하게 주어진 세포 유형에 대한 자신의 형질 감염 매개 변수를 최적화하고자하는 사람들을 위해 처리량이 높은 여러 매개 변수를 교차 테스트하기 위해 이 프로토콜을 적용합니다. 실제로, 우리는 이 나노 스케일 프로토콜로 확인된 최적화된 파라미터가 더 큰 규모와 수동 형질전환 실험으로 전치될 수 있음을 보여주었습니다. 마지막으로, 본 프로토콜에 사용되는 형질감염 시약은 제조사에 따라 DNA 또는 siRNA 형질변환을 허용함에 따라, 프로토콜은 유전자 과발현 또는 녹다운에 대한 어레이 접근법을 수행하는 것을 목표로 하는 사람들에게도 관심이 있다. DNA로 미리 채워진 대상 플레이트는 효능의 손실 없이 형질전환 분석에서 사용하기 7일까지 보존될 수 있으며, 이는 이러한 종류의 적용에 대한 다음 프로토콜의 또 다른 장점이다.
Protocol
Representative Results
Discussion
주어진 세포주에 대한 정확한 고처리량 형벌 방법의 확립 및 최적화는 과학자들이 이 섹션에서 설명하는 몇 가지 주요 매개 변수를 따라야 합니다. HeLa 세포에 최적화된 이러한 설정도 HEK 세포에 대해 효율적이라는 것이 입증됨에 따라 프로토콜 전반에 걸쳐 권장값으로 시작하는 것이 좋습니다. 그러나, 최상의 파라미터는 세포주 및 형질감염 시약에 의존할 수 있기 때문에, 최적의 조건은 세포 ?…
Declarações
The authors have nothing to disclose.
Acknowledgements
저자는 이 문서의 연구, 저자 및/또는 출판에 대한 다음과 같은 재정적 지원의 영수증을 공개했다: Inserm, 릴 대학, 릴 파스퇴르 연구소, Conseil 레지오날 뒤 노르, PRIM-HCV1 과 2 (폴 드 레체 Interdisciplinaire sur le Médicament), 에이전시 내셔널 드 라 레체 (ANR-10-EQPX-04-01), 페더 (12001407 (D-AL) Equipex Imaginex BioMed) 및 유럽 공동체 (ERC-STG INTRACELLTB n° 260901). 저자는 원고의 비판적 검토와 수정에 대해 S. Moureu 박사, B. Villemagne 박사, R. 페루 클레멘트 박사, H. Groult 박사에게 감사를 표하고자 합니다.
Materials
| 384LDV Microplate | Labcyte | LP-0200 | |
| 384-well Microplate μClear Black | Greiner | 781906 | |
| Ampicilin | Sigma | A9393-5G | Selection antibiotic for bacteria transformed with ampicilin expressing vector |
| Android Tablet | Samsung | Galaxy Note 8 | used to guide the user while the source plate manual dispense |
| Aniospray Surf 29 | Anios | 2421073 | disinfectant to clean the MicroFlo head |
| Columbus software | Perkin Elmer | image analysis software | |
| Dulbecco's Modified Eagle Medium (DMEM), high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 10566032 | cell culture medium |
| Echo Cherry Pick 1.5.3 software | Labcyte | Software enabling ADE-based dispenses by the Echo550 device from a *.csv file; nanodispenser software | |
| Echo550 | Labcyte | ADE-based dispenser | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | to add in cell culture medium |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | to fix cell |
| HeLa cells | ATCC | HeLa (ATCC® CCL-2™) | |
| Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | 10 mg/mL Solution in Water |
| INCell Analyzer 6000 | GE Healthcare | 29043323 | automated laser-based confocal imaging platform |
| LB medium | Thermoischer Scientific LB Broth Base (Lennox L Broth Base)®, powder |
12780052 | culture medium for bacteria growth |
| Lysis Buffer (A2) | Macherey-Nagel | 740912.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| MicroFlo 10µL cassette | Biotek Instruments Inc | 7170013 | to use with the Microflo Dispenser |
| MicroFlo 1μL cassette | Biotek Instruments Inc | 7170012 | to use with the Microflo Dispenser |
| MicroFlo Dispenser | Biotek Instruments Inc | 7171000 | peristaltic pump-based liquid handler device |
| Microvolume spectrophotometer | Denovix | DS-11 Spectrophotometer | Measure the DNA concentration of samples |
| mVenus plasmid | mVenus cDNA was cloned by enzymatic restriction digestion and ligation in Age1/BsrG1 sites of the tdTomato-N1 plasmid | Vector type: Mammalian Expression, Fusion Protein: mVenus | |
| Neutralization Buffer (A3) | Macherey-Nagel | 740913.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| NucleoSpin Plasmid kit | Macherey-Nagel | 740588.50 | used to prepare plasmid from bacterial culture |
| Optimal-Modified Eagle Medium (Opti-MEM) Medium | Thermo Fisher Scientific | 31985070 | |
| optional Wash bufferWash Buffer (A4) | Macherey-Nagel | 740914.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| orbital shaker | incubated large capacity shaker | 444-7084 | Used to grow bacteria under gentle agitation and 37°C |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 10,000 U/mL |
| Phosphate-Buffered Saline | Thermo Fisher Scientific | 10010001 | |
| Plasmid mini-columns | Macherey-Nagel | 740499.250 | Silica membrane mini-column to prepare plasmid from bacterial culture |
| Resuspension Buffer (A1) | Macherey-Nagel | 740911.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| RNAse A | Macherey-Nagel | 740505 | Enzyme from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| tdTomato-N1 plasmid | Addgene | Plasmid #54642 | Vector type: Mammalian Expression, Fusion Protein: tdTomato |
| TransIT-X2 Dynamic Delivery System | Mirus Bio | MIR 6000 | |
| Wash Buffer (AW) | Macherey-Nagel | 740916.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| 3D printer | Creality | CR10S | used to print the plate adapter |
| Blender Software | https://www.blender.org/ Free software under GNU General Public License (GPL). |
version 2.79b | used to design the plate adapter |
Referências
- Colin, B., Deprez, B., Couturier, C. High-Throughput DNA Plasmid Transfection Using Acoustic Droplet Ejection Technology. SLAS Discovery: Advancing Life Sciences R & D. , 2472555218803064 (2018).
- Mirus Bio. . Optimising Transfection Performance. , (2019).
- Thermo Fisher Scientific. . Factors Influencing Transfection Efficiency | Thermo Fisher Scientific – FR. , (2019).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Figueroa, E., et al. A mechanistic investigation exploring the differential transfection efficiencies between the easy-to-transfect SK-BR3 and difficult-to-transfect CT26 cell lines. Journal of Nanobiotechnology. 15 (1), 36 (2017).
- Kirchenbuechler, I., Kirchenbuechler, D., Elbaum, M. Correlation between cationic lipid-based transfection and cell division. Experimental Cell Research. 345 (1), 1-5 (2016).
- Zhang, Z., Qiu, S., Zhang, X., Chen, W. Optimized DNA electroporation for primary human T cell engineering. BMC Biotechnology. 18 (1), 4 (2018).
- Cao, D., et al. Transfection activity and the mechanism of pDNA-complexes based on the hybrid of low-generation PAMAM and branched PEI-1.8k. Molecular bioSystems. 9 (12), 3175-3186 (2013).
- Bos, A. B., et al. Development of a semi-automated high throughput transient transfection system. Journal of Biotechnology. 180, 10-16 (2014).
- Colosimo, A., et al. Transfer and expression of foreign genes in mammalian cells. BioTechniques. 29 (2), 314-318 (2000).
- Villa-Diaz, L. G., Garcia-Perez, J. L., Krebsbach, P. H. Enhanced transfection efficiency of human embryonic stem cells by the incorporation of DNA liposomes in extracellular matrix. Stem Cells and Development. 19 (12), 1949-1957 (2010).
- Sabatini, D. M. . Reverse transfection method. , WO2001020015A1 (2001).
- Raymond, C., et al. A simplified polyethylenimine-mediated transfection process for large-scale and high-throughput applications. Methods (San Diego, CA). 55 (1), 44-51 (2011).
- Junquera, E., Aicart, E. Recent progress in gene therapy to deliver nucleic acids with multivalent cationic vectors. Advances in Colloid and Interface Science. 233, 161-175 (2016).
- Woodruff, K., Maerkl, S. J. A High-Throughput Microfluidic Platform for Mammalian Cell Transfection and Culturing. Scientific Reports. 6, 23937 (2016).
- Vasileiou, T., Foresti, D., Bayram, A., Poulikakos, D., Ferrari, A. Toward Contactless Biology: Acoustophoretic DNA Transfection. Scientific Reports. 6, 20023 (2016).
- Hadimioglu, B., Stearns, R., Ellson, R. Moving Liquids with Sound: The Physics of Acoustic Droplet Ejection for Robust Laboratory Automation in Life Sciences. Journal of Laboratory Automation. 21 (1), 4-18 (2016).
- Grant, R. J., et al. Achieving accurate compound concentration in cell-based screening: validation of acoustic droplet ejection technology. Journal of Biomolecular Screening. 14 (5), 452-459 (2009).
- Sackmann, E. K., et al. Technologies That Enable Accurate and Precise Nano- to Milliliter-Scale Liquid Dispensing of Aqueous Reagents Using Acoustic Droplet Ejection. Journal of Laboratory Automation. 21 (1), 166-177 (2016).
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chemical Society Reviews. 38 (10), 2887-2921 (2009).
- Zielinski, D., Gordon, A., Zaks, B. L., Erlich, Y. iPipet: sample handling using a tablet. Nature Methods. 11 (8), 784-785 (2014).
- Brunner, S., et al. Cell cycle dependence of gene transfer by lipoplex, polyplex and recombinant adenovirus. Gene Therapy. 7 (5), 401-407 (2000).
- Nii, T., et al. Single-Cell-State Culture of Human Pluripotent Stem Cells Increases Transfection Efficiency. BioResearch Open Access. 5 (1), 127-136 (2016).
- Noonan, D. J., Henry, K., Twaroski, M. L. A High-Throughput Mammalian Cell-Based Transient Transfection Assay. Signal Transduction Protocols. 284, 051-066 (2004).
- . . Transfection | TransIT Transfection Reagents | Mirus Bio. , (2015).
- American Type Culture Collection. . General protocol for transfection of stem cells, primary cells, and continuous cell lines with ATCC TransfeX Transfection Reagent. , (2017).
- American Type Culture Collection. . Transfection Reagents for Nucleic Acid Transfer into ATCC Cells. , (2017).
- de Los Milagros Bassani Molinas, M., Beer, C., Hesse, F., Wirth, M., Wagner, R. Optimizing the transient transfection process of HEK-293 suspension cells for protein production by nucleotide ratio monitoring. Cytotechnology. 66 (3), 493-514 (2014).
- Promega. . FuGENE® 6 Transfection Reagent. , (2019).
- Olden, B. R., Cheng, Y., Yu, J. L., Pun, S. H. Cationic polymers for non-viral gene delivery to human T cells. Journal of Controlled Release: Official Journal of the Controlled Release Society. 282, 140-147 (2018).
- Park, E., Cho, H. B., Takimoto, K. Effective gene delivery into adipose-derived stem cells: transfection of cells in suspension with the use of a nuclear localization signal peptide-conjugated polyethylenimine. Cytotherapy. 17 (5), 536-542 (2015).
- Wood, R. W., Loomis, A. L. The physical and biological effects of high-frequency sound-waves of great intensity. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 4 (22), 417-436 (1927).
- Mamat, U., et al. Eliminating Endotoxin at the Source – A Novel Competent Cell Line with Modified Lipopolysaccharide for Low-Endotoxin Plasmid Production. , (2014).
- Ivanova, N. V., Kuzmina, M. L. Protocols for dry DNA storage and shipment at room temperature. Molecular Ecology Resources. 13 (5), 890-898 (2013).
- Lesnick, J., Lejeune-Dodge, A., Ruppert, N., Jarman, C. . High-Precision Cell Dispensing with the Labcyte Echo® Liquid Handler. , (2017).
- Yang, X., et al. A public genome-scale lentiviral expression library of human ORFs. Nature Methods. 8 (8), 659-661 (2011).
- Peng, J., Zhou, Y., Zhu, S., Wei, W. High-throughput screens in mammalian cells using the CRISPR-Cas9 system. The FEBS journal. 282 (11), 2089-2096 (2015).

