Hög genomströmning DNA plasmid Multiplexing och transfektion med akustisk Nanodispenseringsteknik
Summary
Detta protokoll beskriver hög genomströmning plasmid transfektion av däggdjursceller i en 384-brunn plattan med hjälp av akustisk dropp ejektion teknik. Den tidskrävande, felbenägna DNA dispensering och Multiplexing, men också transfection reagens dispensering, är programvara driven och utförs av en nanodispenser enhet. Cellerna är sedan seedade i dessa förfyllda brunnar.
Abstract
Cell transfektion, oumbärlig för många biologiska studier, kräver att kontrollera många parametrar för en korrekt och framgångsrik prestation. Oftast utförs vid låga genomströmning, är det dessutom tidskrävande och felbenägna, ännu mer så när Multiplexing flera plasmider. Vi utvecklade en enkel, snabb och noggrann metod för att utföra cell transfektion i en 384-well tallrik layout med akustisk dropp ejektionsfraktion (ade) teknik. Den nanodispenseringsenhet som används i denna studie är baserad på denna teknik och möjliggör exakt nanovolymleverans med hög hastighet från en källbrunn plattan till en destination en. Det kan dispensera och multiplex DNA och transfektion reagens enligt en färdigdesignad kalkylblad. Här presenterar vi ett optimalt protokoll för att utföra ADE-baserade hög genomströmning plasmid transfektion som gör det möjligt att nå en effektivitet på upp till 90% och en nästan 100% cotransfection i cotransfection experiment. Vi utökar det initiala arbetet genom att föreslå ett användarvänligt kalkylbladsbaserat makro, som kan hantera upp till fyra plasmider/brunnar från ett bibliotek som innehåller upp till 1 536 olika plasmider, och en tablett-baserad pipettering guide ansökan. Makrot utformar den eller de nödvändiga mallen (-erna) på käll plattan (-erna) och genererar färdiga filer för nanodispensern och tablettbaserade program. De fyra stegen transfektion protokollet innebär i) en spädningsvätska avstå från en klassisk flytande handler, II) plasmid distribution och Multiplexing, III) en transfektion reagens dispensering av nanodispenser, och IV) cellplätering på de förfyllda brunnarna. Den beskrivna mjukvarubaserad kontroll av ADE plasmid Multiplexing och transfektion tillåter även icke-specialister inom området för att utföra en tillförlitlig cell transfektion på ett snabbt och säkert sätt. Den här metoden möjliggör snabb identifiering av optimala inställningar för en given celltyp och kan överföras till högre skala och manuella metoder. Protokollet underlättar tillämpningar, såsom human ORFeome protein (uppsättning av öppna läsramar [ORFs] i ett genom) uttryck eller CRISPR-Cas9-baserad genfunktion validering, i nonpoolade screening strategier.
Introduction
Den metod som presenteras här beskriver i detalj hur man utför DNA plasmid Multiplexing och transfektion i däggdjursceller vid hög genomströmning med hjälp av en akustisk-baserade flytande nanodispenser i en 384-bra tallrik, även för icke-specialister inom området. Detta nyligen publicerad metod1 gör det möjligt att utföra så mycket som 384 oberoende PLASMID DNA Multiplexing och transfektion villkor i ett experiment, på mindre än 1 h. enstaka eller cotransfektion experiment var framgångsrika, når en nära 100% transfektion inom den överförda cellpopulationen. Detta protokoll gör transfection lättare eftersom de flesta av de tråkiga, tidskrävande och felbenägna steg är nu programvara driven (se figur 1 för en allmän översikt). Ytterligare ansträngningar har gjorts för att utveckla dedikerade verktyg för att förbättra användarvänlighet och samtidigt undvika mänskliga fel under den övergripande processen och att främja framgångsrika transfektion även för icke-specialister inom området. Den beskrev protokoll omfattar en “förbrukaren-vänlig” makro Spreadsheet så pass vi vecklat upp for att hantera 384 oberoende transfektion författningarna med Multiplexing möjlighet av upp till fyra plasmider i var brunn. Makrot genererar automatiskt mallar av käll plattan (s) för att ladda den förväntade DNA plasmid volymen från att starta lagerlösningar och de filer som krävs för att driva nanodispensern programvara på experimentell design som har matas in. Eftersom manuell dispensering av DNA i en 384-well käll plattan är långtråkig och felbenägna, utvecklade vi också en dedikerad tablett-baserad applikation för att vägleda användaren medan dispensering DNA-lösning enligt mallen.
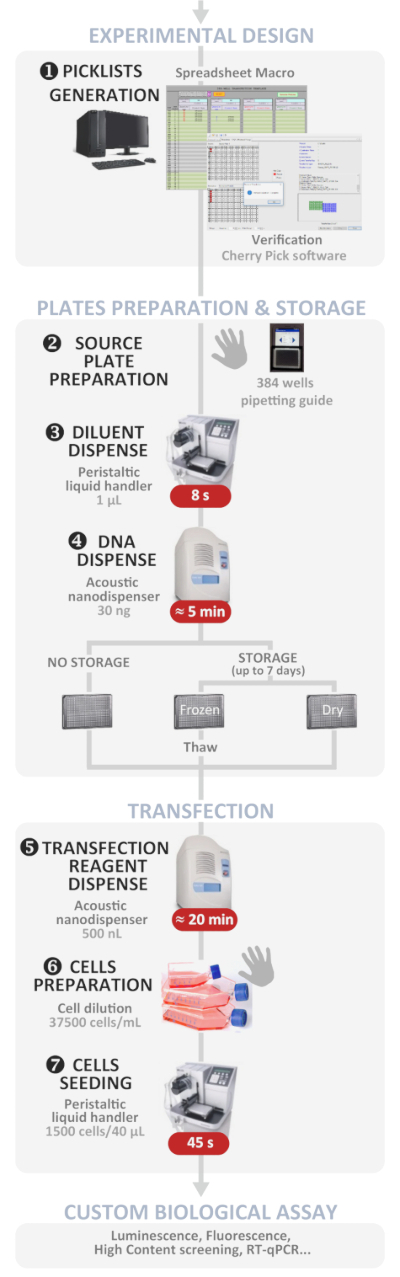
Figur 1: experimentellt arbetsflöde. Schematisk representation av den optimala automatiserade hög genomströmningen omvänd transfection protokoll (från experimentell design till anpassad biologisk analys). Manuella steg indikeras av hand symbolen och Ungefärlig tid för varje steg skrivs i en röd ruta. Vänligen klicka här för att se en större version av denna siffra.
Många cell-baserade experiment börjar med plasmid DNA-transfektion, och även om många dedikerade reagenser har varit och fortfarande utvecklas för att öka transfektion effektivitet och/eller underlätta förfarandet, mycket återstår att göra2,3 , 4. DNA-plasmid cell transfektion innebär flera steg för att nå hög effektivitet, såsom ett initialt komplext upptag, endosomala flykt, och cytoplasmiska transport till Nucleus5,6. Förutom kalcium nederbörd eller fysiska tekniker såsom elektroporation eller mikroinjektion med hjälp av dedikerade enheter7, moderna kemiska metoder har fokuserat på att förbättra DNA-cellleverans samtidigt sänka cell cytoxicitet8, 9. Användningen av lipider eller katjoniska polymerer bildar liposomer-liknande komplex och, mer nyligen, nonliposomal polymera kemisystem har gjort transfektion enklare och effektivare10. Trots denna utveckling, cell transfektion kräver fortfarande specifika färdigheter som skall utföras korrekt som de flesta av dessa fysiska eller kemiska transfektion protokoll kräver forskare att manuellt förbereda varje DNA transfektion reaktions tillstånd, vilket försämrar dataflödet. För att kringgå detta problem har omvända transfektion protokoll utvecklats med hjälp av kemiska transfektion reagens11,12,13, så att användaren kan testa eller kombinera flera plasmider på ett snabbare sätt. I dessa protokoll bildas nukleinsyrafkomplexen med transfektionsmedel innan de sådd cellerna på komplexen. Dessa omvända protokoll begränsas dock fortfarande av den manuella hanteringen av DNA-lösningar och av kombinationen av var och en av de oberoende förhållandena. Även om det är möjligt att utföra dem i en 96-bra plåtformat, DNA-förberedelse och dispenserar kommer att vara långtråkig, och det kommer sannolikt att bli misstag. När olika mängder av flera DNA-plasmider krävs och multiplexade med varandra, cell transfektion blir ännu svårare att uppnå och mer tidskrävande, och mänskliga fel blir ganska oundvikligt. Skala upp till 384-well plattan format i en omvänd transfektion strategi, trots få multiplexade DNA transfektion villkor, blir en omöjlig utmaning på grund av följande skäl. i) DNA-mängderna, transfektionsreagens eller reaktions blandnings volymer som ska hanteras är lägre än 1 μL för varje brunn. II) multiplexering av plasmider för 384 oberoende förhållanden blir oerhört komplicerat. Leveransen i var och en av de 384 brunnar är också III) mycket tidskrävande och IV) felbenägna. I själva verket är det svårt att hantera den rätta lösningen i de förväntade brunnarna eftersom de låga volymerna som redan dispenseras inte tillåter visuell övervakning mellan de tomma och redan fyllda brunnarna. v) Slutligen finns det en hög risk för torkning av blandningen genom avdunstning innan cellerna tillsätts på grund av den tid som behövs för att utföra nödvändiga dispenseringssteg. Sammanfattnings faktorn, den begränsande faktor för att inrätta hög genomströmning DNA plasmid transfektion analyser verkar vara miniatyrisering av analysen, vilket innebär låg volym multiplexering och hantera som inte kan hanteras manuellt längre men är också knappast möjligt i en tillförlitligt sätt av klassiska peristatiska vätske hanterare.
Som ett bevis på svårigheter att automatisera sådana analyser och få hög genomströmning, endast ett fåtal försök att automatisera transfektion har publicerats hittills: en 96-väl plattan format med hjälp av en kommersiell vätskehantering enhet och kalciumfosfat nederbörd14 och, mer nyligen, en lipoplex reagens, och en mikroflödessystem chip möjliggör 280 oberoende transfektioner15 men kräver specialiserade färdigheter inom detta område. En annan metod, acoustophoresis, vilket möjliggör flytande levitation och leder till vätske manipulation och blandning, användes för att utföra DNA-transfektion i 24-till 96-väl platta format16. Även om möjligt, denna metod lider av en extremt låg genomströmning som blandning av celler med DNA-transfektion blandning kräver en 60 s inkubering för varje enskild punkt före seedning. Detta innebär en varaktighet på minst 96 min för en komplett 96-brunn plattan. Dessutom är detta protokoll långt ifrån att vara mottagliga för den totala biologer publik eftersom detta arbete utfördes med en egen konstruerad och tillverkad enhet som för närvarande inte finns på marknaden. Tvärtom, under de senaste åren, en lättanvänd programvara driven akustiska-baserade dispenseringsteknik har uppstått med nano dispenser enheter. Med hjälp av fokuserad akustisk energi, dessa enheter tillåter tätt kontrollerad utmatning av små vätskevolymer från 2,5 nL till 500 nL från en källa plattan till en destination en17. Denna teknik, som kallas akustisk dropp utmatning (ade), har många fördelar: det är helt automatiserad, kontaktlös, tipless, exakt, exakt, och mycket reproducerbara, och den har en hög genomströmning18. Först ägnas åt att leverera dimetylsulfoxid (DMSO) lösningar, har inställningarna förbättrats för att avstå vattenhaltiga buffertar19. Akustiska nanodispensers, sedan, verkar lämplig för omvänd cell transfektion protokoll och kan kringgå de flesta av de ovan nämnda manuella begränsningar. Eftersom inga plasmid-transfektionförsök tidigare beskrivits med denna teknik, utvärderade vi nyligen lämpligheten av en akustisk-baserade dispenseringssystem för att utföra omvänd cell transfektion.
Dra nytta av nanodispenser genomströmning och användarvänlighet, vi optimerat en omvänd transfection protokoll för HeLa celler genom att korstesta flera parametrar som kan påverka DNA-transfektion på en 384-väl, enda platta, nämligen den totala DNA-mängden och källans DNA-startkoncentration, spädnings volym, transfektionsreagens och antal spridda celler. Det framkallade protokollet kringtar de ovan beskrivna manuella begränsningarna av cell transfektion och presenterar flera fördelar jämfört med andra automatiserade transfektionförsök. Först är det miniatyriserade, vilket möjliggör kostnadseffektiv transfektion reagens genom att spara DNA plasmid preparat och transfektion reagens. För det andra är det mycket mer hög genomströmning och reproducerbara än den manuella protokoll (även för nybörjare), som transfektion av en hel 384-väl plattan kan uppnås på mindre än 1 h. Slutligen är det programvara driven, vilket gör det möjligt att kontrollera den dispenserade DNA-mängden och multiplexering av flera plasmider. Faktum är att tack vare nanodispensern programvara (tabell över material), kan användaren utarbeta en studieplan för att kontrollera de volymer som ska dispenseras från en definierad källa väl plattan till en destination en.
Det protokoll som presenteras här är främst avsett för dem som har tillgång till en nanodispenser och skulle vilja inrätta transfektion experiment vid hög genomströmning, men också för dem som vill snabbt optimera sina transfection parametrar för en given celltyp av tillämpa detta protokoll för att korstesta flera parametrar vid högt dataflöde. Vi har faktiskt visat att optimerade parametrar som identifierats med detta nanoskala-protokoll kan överföras till storskaliga och manuella transfektionsexperiment. Slutligen, eftersom det transfektionsreagens som används i detta protokoll tillåter DNA-eller siRNA-transfektion enligt tillverkaren, är protokollet också av intresse för dem som siktar på att utföra array-metoder för genöveruttryck eller knockdown. Destinations plattorna förifyllda med DNA kan bevaras upp till 7 dagar före användning i en transfektion test utan förlust av effekt, vilket är en annan fördel med följande protokoll för denna typ av ansökan.
Protocol
Representative Results
Discussion
Etablering och optimering av en exakt hög genomströmning metod för en given cellinjer kräver forskare att följa några viktiga parametrar som beskrivs i det här avsnittet. Vi uppmuntrar starkt att börja med de rekommenderade värdena i hela protokollet eftersom dessa inställningar optimerade för HeLa celler också visat sig vara effektiva för HEK-celler. Men eftersom de bästa parametrarna kan bero på cellinjer och transfektion reagenser, optimala förhållanden kan definieras genom att variera cell nummer, sp…
Declarações
The authors have nothing to disclose.
Acknowledgements
Författarna avslöjade ett kvitto på följande ekonomiska stöd för forskning, författarskap, och/eller publicering av denna artikel: INSERM, Lille University, Lille Pasteur Institute, Conseil Régional du Nord, och PRIM-HCV1 och 2 (Pôle de Recherche Interdisciplinaire sur le Médicament), Agence nationale de la Recherche (ANR-10-EQPX-04-01), Feder (12001407 (D-AL) Equipex Imaginex BioMed) och Europeiska gemenskapen (ERC-STG INTRACELLTB n ° 260901). Författarna vill tacka Dr. S. Moureu, Dr. B. villemagne, Dr. R. Ferru-Clément, och Dr. H. Groult för deras kritiska granskning och korrigeringar av manuskriptet.
Materials
| 384LDV Microplate | Labcyte | LP-0200 | |
| 384-well Microplate μClear Black | Greiner | 781906 | |
| Ampicilin | Sigma | A9393-5G | Selection antibiotic for bacteria transformed with ampicilin expressing vector |
| Android Tablet | Samsung | Galaxy Note 8 | used to guide the user while the source plate manual dispense |
| Aniospray Surf 29 | Anios | 2421073 | disinfectant to clean the MicroFlo head |
| Columbus software | Perkin Elmer | image analysis software | |
| Dulbecco's Modified Eagle Medium (DMEM), high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 10566032 | cell culture medium |
| Echo Cherry Pick 1.5.3 software | Labcyte | Software enabling ADE-based dispenses by the Echo550 device from a *.csv file; nanodispenser software | |
| Echo550 | Labcyte | ADE-based dispenser | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | to add in cell culture medium |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | to fix cell |
| HeLa cells | ATCC | HeLa (ATCC® CCL-2™) | |
| Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | 10 mg/mL Solution in Water |
| INCell Analyzer 6000 | GE Healthcare | 29043323 | automated laser-based confocal imaging platform |
| LB medium | Thermoischer Scientific LB Broth Base (Lennox L Broth Base)®, powder |
12780052 | culture medium for bacteria growth |
| Lysis Buffer (A2) | Macherey-Nagel | 740912.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| MicroFlo 10µL cassette | Biotek Instruments Inc | 7170013 | to use with the Microflo Dispenser |
| MicroFlo 1μL cassette | Biotek Instruments Inc | 7170012 | to use with the Microflo Dispenser |
| MicroFlo Dispenser | Biotek Instruments Inc | 7171000 | peristaltic pump-based liquid handler device |
| Microvolume spectrophotometer | Denovix | DS-11 Spectrophotometer | Measure the DNA concentration of samples |
| mVenus plasmid | mVenus cDNA was cloned by enzymatic restriction digestion and ligation in Age1/BsrG1 sites of the tdTomato-N1 plasmid | Vector type: Mammalian Expression, Fusion Protein: mVenus | |
| Neutralization Buffer (A3) | Macherey-Nagel | 740913.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| NucleoSpin Plasmid kit | Macherey-Nagel | 740588.50 | used to prepare plasmid from bacterial culture |
| Optimal-Modified Eagle Medium (Opti-MEM) Medium | Thermo Fisher Scientific | 31985070 | |
| optional Wash bufferWash Buffer (A4) | Macherey-Nagel | 740914.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| orbital shaker | incubated large capacity shaker | 444-7084 | Used to grow bacteria under gentle agitation and 37°C |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 10,000 U/mL |
| Phosphate-Buffered Saline | Thermo Fisher Scientific | 10010001 | |
| Plasmid mini-columns | Macherey-Nagel | 740499.250 | Silica membrane mini-column to prepare plasmid from bacterial culture |
| Resuspension Buffer (A1) | Macherey-Nagel | 740911.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| RNAse A | Macherey-Nagel | 740505 | Enzyme from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| tdTomato-N1 plasmid | Addgene | Plasmid #54642 | Vector type: Mammalian Expression, Fusion Protein: tdTomato |
| TransIT-X2 Dynamic Delivery System | Mirus Bio | MIR 6000 | |
| Wash Buffer (AW) | Macherey-Nagel | 740916.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| 3D printer | Creality | CR10S | used to print the plate adapter |
| Blender Software | https://www.blender.org/ Free software under GNU General Public License (GPL). |
version 2.79b | used to design the plate adapter |
Referências
- Colin, B., Deprez, B., Couturier, C. High-Throughput DNA Plasmid Transfection Using Acoustic Droplet Ejection Technology. SLAS Discovery: Advancing Life Sciences R & D. , 2472555218803064 (2018).
- Mirus Bio. . Optimising Transfection Performance. , (2019).
- Thermo Fisher Scientific. . Factors Influencing Transfection Efficiency | Thermo Fisher Scientific – FR. , (2019).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Figueroa, E., et al. A mechanistic investigation exploring the differential transfection efficiencies between the easy-to-transfect SK-BR3 and difficult-to-transfect CT26 cell lines. Journal of Nanobiotechnology. 15 (1), 36 (2017).
- Kirchenbuechler, I., Kirchenbuechler, D., Elbaum, M. Correlation between cationic lipid-based transfection and cell division. Experimental Cell Research. 345 (1), 1-5 (2016).
- Zhang, Z., Qiu, S., Zhang, X., Chen, W. Optimized DNA electroporation for primary human T cell engineering. BMC Biotechnology. 18 (1), 4 (2018).
- Cao, D., et al. Transfection activity and the mechanism of pDNA-complexes based on the hybrid of low-generation PAMAM and branched PEI-1.8k. Molecular bioSystems. 9 (12), 3175-3186 (2013).
- Bos, A. B., et al. Development of a semi-automated high throughput transient transfection system. Journal of Biotechnology. 180, 10-16 (2014).
- Colosimo, A., et al. Transfer and expression of foreign genes in mammalian cells. BioTechniques. 29 (2), 314-318 (2000).
- Villa-Diaz, L. G., Garcia-Perez, J. L., Krebsbach, P. H. Enhanced transfection efficiency of human embryonic stem cells by the incorporation of DNA liposomes in extracellular matrix. Stem Cells and Development. 19 (12), 1949-1957 (2010).
- Sabatini, D. M. . Reverse transfection method. , WO2001020015A1 (2001).
- Raymond, C., et al. A simplified polyethylenimine-mediated transfection process for large-scale and high-throughput applications. Methods (San Diego, CA). 55 (1), 44-51 (2011).
- Junquera, E., Aicart, E. Recent progress in gene therapy to deliver nucleic acids with multivalent cationic vectors. Advances in Colloid and Interface Science. 233, 161-175 (2016).
- Woodruff, K., Maerkl, S. J. A High-Throughput Microfluidic Platform for Mammalian Cell Transfection and Culturing. Scientific Reports. 6, 23937 (2016).
- Vasileiou, T., Foresti, D., Bayram, A., Poulikakos, D., Ferrari, A. Toward Contactless Biology: Acoustophoretic DNA Transfection. Scientific Reports. 6, 20023 (2016).
- Hadimioglu, B., Stearns, R., Ellson, R. Moving Liquids with Sound: The Physics of Acoustic Droplet Ejection for Robust Laboratory Automation in Life Sciences. Journal of Laboratory Automation. 21 (1), 4-18 (2016).
- Grant, R. J., et al. Achieving accurate compound concentration in cell-based screening: validation of acoustic droplet ejection technology. Journal of Biomolecular Screening. 14 (5), 452-459 (2009).
- Sackmann, E. K., et al. Technologies That Enable Accurate and Precise Nano- to Milliliter-Scale Liquid Dispensing of Aqueous Reagents Using Acoustic Droplet Ejection. Journal of Laboratory Automation. 21 (1), 166-177 (2016).
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chemical Society Reviews. 38 (10), 2887-2921 (2009).
- Zielinski, D., Gordon, A., Zaks, B. L., Erlich, Y. iPipet: sample handling using a tablet. Nature Methods. 11 (8), 784-785 (2014).
- Brunner, S., et al. Cell cycle dependence of gene transfer by lipoplex, polyplex and recombinant adenovirus. Gene Therapy. 7 (5), 401-407 (2000).
- Nii, T., et al. Single-Cell-State Culture of Human Pluripotent Stem Cells Increases Transfection Efficiency. BioResearch Open Access. 5 (1), 127-136 (2016).
- Noonan, D. J., Henry, K., Twaroski, M. L. A High-Throughput Mammalian Cell-Based Transient Transfection Assay. Signal Transduction Protocols. 284, 051-066 (2004).
- . . Transfection | TransIT Transfection Reagents | Mirus Bio. , (2015).
- American Type Culture Collection. . General protocol for transfection of stem cells, primary cells, and continuous cell lines with ATCC TransfeX Transfection Reagent. , (2017).
- American Type Culture Collection. . Transfection Reagents for Nucleic Acid Transfer into ATCC Cells. , (2017).
- de Los Milagros Bassani Molinas, M., Beer, C., Hesse, F., Wirth, M., Wagner, R. Optimizing the transient transfection process of HEK-293 suspension cells for protein production by nucleotide ratio monitoring. Cytotechnology. 66 (3), 493-514 (2014).
- Promega. . FuGENE® 6 Transfection Reagent. , (2019).
- Olden, B. R., Cheng, Y., Yu, J. L., Pun, S. H. Cationic polymers for non-viral gene delivery to human T cells. Journal of Controlled Release: Official Journal of the Controlled Release Society. 282, 140-147 (2018).
- Park, E., Cho, H. B., Takimoto, K. Effective gene delivery into adipose-derived stem cells: transfection of cells in suspension with the use of a nuclear localization signal peptide-conjugated polyethylenimine. Cytotherapy. 17 (5), 536-542 (2015).
- Wood, R. W., Loomis, A. L. The physical and biological effects of high-frequency sound-waves of great intensity. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 4 (22), 417-436 (1927).
- Mamat, U., et al. Eliminating Endotoxin at the Source – A Novel Competent Cell Line with Modified Lipopolysaccharide for Low-Endotoxin Plasmid Production. , (2014).
- Ivanova, N. V., Kuzmina, M. L. Protocols for dry DNA storage and shipment at room temperature. Molecular Ecology Resources. 13 (5), 890-898 (2013).
- Lesnick, J., Lejeune-Dodge, A., Ruppert, N., Jarman, C. . High-Precision Cell Dispensing with the Labcyte Echo® Liquid Handler. , (2017).
- Yang, X., et al. A public genome-scale lentiviral expression library of human ORFs. Nature Methods. 8 (8), 659-661 (2011).
- Peng, J., Zhou, Y., Zhu, S., Wei, W. High-throughput screens in mammalian cells using the CRISPR-Cas9 system. The FEBS journal. 282 (11), 2089-2096 (2015).

