Laserfangst mikrodisseksjon RNA-sekvensering for romlig og temporal vevspesifikt genuttrykksanalyse i planter
Summary
Presentert her er en protokoll for laser-fangst mikrodisseksjon (LCM) av plantevev. LCM er en mikroskopisk teknikk for å isolere områder av vev på en forurensningsfri måte. Prosedyren inkluderer vev fiksering, parafin innebygging, snitting, LCM og RNA ekstraksjon. RNA brukes i nedstrøms vevsspesifikke, tidsmessig løste analyser av transkripsjoner.
Abstract
Utviklingen av en kompleks flercellet organisme styres av forskjellige celletyper som har forskjellige transkripsjonsprofiler. For å identifisere transkripsjonelle regulatoriske nettverk som styrer utviklingsprosesser, er det nødvendig å måle de romlige og timelige genuttrykksprofilene til disse individuelle celletypene. Derfor er innsikt i spatio-temporal kontroll av genuttrykk avgjørende for å få forståelse for hvordan biologiske og utviklingsprosesser reguleres. Her beskriver vi en laserfangst mikrodisseksjonsmetode (LCM) for å isolere lite antall celler fra tre byggembryoorganer over et tidsforløpet under spiring etterfulgt av transkripsjonsprofilering. Metoden består av vevfiksering, vevsbehandling, parafininnbygging, snitting, LCM og RNA-ekstraksjon etterfulgt av sanntids PCR eller RNA-seq. Denne metoden har gjort oss i stand til å få romlige og timelige profiler av frø organ transkripsjoner fra varierende antall celler (titalls til hundrevis), noe som gir mye større vev-spesifisitet enn typiske bulk-vev analyser. Fra disse dataene var vi i stand til å definere og sammenligne transkripsjonelle regulatoriske nettverk samt forutsi kandidat regulatoriske transkripsjonsfaktorer for individuelle vev. Metoden skal gjelde for andre plantevev med minimal optimalisering.
Introduction
Planteutvikling og vekst innebærer koordinert handling av transkripsjonelle regulatoriske nettverk i forskjellige celler som finnes i et komplekst cellulært miljø. For å forstå aktiviteten til disse regulatoriske nettverkene, krever vi kunnskap om romlig og timelig genuttrykk innenfor ulike celletyper på tvers av utviklingsstadier. Analyser av genuttrykk utføres imidlertid oftere i hele organer eller bulkvevsprøver på grunn av den tekniske utfordringen med å isolere og analysere et lite antall celler. Metoden vi beskriver her har tillatt å skaffe romlig og temporal vevsspesifikk transkripsjonsanalyse ved å koble LCM med RNA-seq.
LCM ble utviklet for to tiår siden av Emmert-Buck og kolleger1. Teknikken gjorde det mulig for forskere å nøyaktig isolere enkeltceller eller klynger av celler fra deres miljø ved hjelp av direkte mikroskopisk visualisering og manipulasjon med en smal strålelaser1. Siden da har metoden vært mye brukt i kreftbiologi og patologi2,3. Mange planteforskningsgrupper har også tilpasset LCM for bruk med ulike plantearter og ulike vevstyper4,5,6,7,8,9,10,11. Nylig har flere papirer også brukt LCM på eudicot og monocot frø for å studere embryo, endpermer og andre frøstrukturer under frøutvikling ogspiring 10,12,13. De fleste av de andre vanlige encellede isolasjonsmetodene som mikropipettering, cellesortering, magnetisk separasjon og mikrofluidiske plattformer er avhengige av enzymatisk fordøyelse eller mekanisk homogenisering for å dissosiere celler. Dette kan påvirke genuttrykket, og introdusere tekniske gjenstander som forvirrer datatolkning14,15. Disse metodene krever også tidligere kunnskap om markørgener for hver celletype for å relatere de dissosierte cellene til deres romlige plassering og sann celletype. En annen gruppe teknikker avhenger av affinitetsbasert isolering av subcellulære strukturer i stedet for hele celler, for eksempel INTAKT (Isolering av Nuclei merket i celletyper) og TRAP (Translating Ribosome Affinity Purification)16,17. Affinitetsmerking og rensing av kjerner eller ribosomer er imidlertid teknisk utfordrende hos plantearter som ikke har veletablerte transformasjonsprotokoller. LCM utnytter rask vevfiksering for å bevare transkripsjonsnivåer og konvensjonell histologisk identifikasjon ved direkte visualisering av celler i normal vev / organkontekst, noe som gjør at diskrete celler kan isoleres på kort tid18,19.
Protokollen som presenteres her er en optimalisert metode for isolering av spesifikke celler eller celletyper fra vevsdelene av kornfrø, som kan brukes på de fleste cellene som kan histologisk identifiseres. LCM gir en kontaktfri metode for celleisolasjon, noe som reduserer forurensning og øker integriteten til gjenvunnet RNA. Videre illustrerer metoden kraften i LCM på store genom brede studier som starter med små mengder biologiske materialer. Vi beskriver også lineær forsterkning av RNA for å generere tilstrekkelig inndatamateriale for nedstrøms transkripsjon/transkripsjonsanalyser.
Det er ti hovedtrinn i denne LCM RNA-seq protokollen for romlig og temporal vev-spesifikke transkripsjoner, inkludert fiksering av vevsprøver, dehydrering, parafin infiltrasjon, innebygging, snitting, LCM, RNA ekstraksjon, RNA forsterkning, RNA kvantifisering og qRT-PCR og / eller RNA-seq (Figur 1).
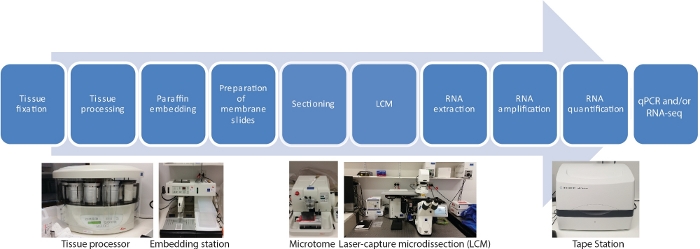
Figur 1: Flytskjema for LCM etterfulgt av RNA-seq eller qRT-PCR. LCM er en romlig presis og kontaktfri teknikk for å samle celler fra faste vevsseksjoner ved hjelp av en laserstråle under mikroskopisk visualisering. Prosessen starter med fiksering av vevsprøver, etterfulgt av dehydrering ved hjelp av en gradientserie av etanol og xylen, og avsluttet med parafininfiltrasjon. Prosessen kan være helautomatisk ved hjelp av en vevsprosessor. Når vevet er infiltrert med parafin, er det innebygd i en mugg med smeltet parafin ved hjelp av en innebyggingsstasjon. Snitting utføres ved hjelp av mikrotom satt til ønsket tykkelse. Lysbilder er forberedt og LCM utføres umiddelbart før RNA skal ekstraheres fra fangede celler. RNA-ekstraksjon etterfølges direkte av to runder med RNA-forsterkning før qRT-PCR og/eller RNA-seq. Vennligst klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Mange vevsspesifikke genuttrykksstudier har vært begrenset av hånddeksjon av prøver, som er tidkrevende, arbeidsintensive, har høy risiko for forurensning og kan bare bruke prøver som en menneskelig operativ er tilstrekkelig dexterous å høste. LCM er en presis og kontaktfri teknikk for å samle celler fra faste vevsseksjoner ved hjelp av en mekanisk drevet laserstråle under mikroskopisk visualisering.
God prøveklargjøring er avgjørende for LCM. Prosessen er avhengig av riktig fikser…
Declarações
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av Australian Research Council Centre of Excellence in Plant Energy Biology (CE140100008) til JW. M.G.L ble støttet av en La Trobe University starter stipend. Vi takker La Trobe Genomics Platform for deres støtte i sekvensering og dataanalyse med høy gjennomstrømning. Vi takker førsteamanuensis Matthew Tucker for ekspertråd om å etablere LCM i laboratoriet vårt.
Materials
| Acetic acid 100 % ACS/R. | AnalaR NORMAPUR (BioStrategies) | VWRC20104.323 | |
| AdhesiveCap 200 opaque | Zeiss | 415190-9181-000 | |
| Clear base moulds 8 X 10 | Leica | 3803015 | |
| Diethyl pyrocarbonate | Sigma-Aldrich | 40718-25ML | |
| High Sensitivity RNA ScreenTape | Agilent | 5067-5579 | |
| Lowprofile disp.blades DB80LS | Leica | 14035843489 | |
| MembraneSlide 1.0 PEN | Zeiss | 415190-9041-000 | |
| MessageAmp II aRNA Amplification Kit | Ambion (ThermoFisher) | AMB17515 | |
| On-Column DNase I Digestion Set | Sigma-Aldrich | DNASE70 | |
| Ovation RNA-Seq System V2 | NuGen (Integrated Science) | 7102-08 | |
| Paraffin (Surgipath Paraplast) | Leica | 39601006 | |
| PicoPure RNA Isolation Kit | ABI (ThermoFisher) | KIT0214 | |
| RNaseZap RNase Decontamination Solution | Ambion (ThermoFisher) | AM9780 | |
| Xylene | AnalaR NORMAPUR (BioStrategies) | VWRC28975.360 | |
| Leica Benchtop Tissue Processor | Leica Biosystems | TP1020 | |
| Leica Heated Paraffin Embedding Module | Leica Biosystems | EG1150H | |
| Leica Cold Plate | Leica Biosystems | EG1150C | |
| Safemate Class 2 Biological Safety Cabinets | LAF Technologies Pty Ltd | Safemate 1.5 | |
| Leica Fully Automated Rotary Microtome | Leica Biosystems | RM2265 | with PALMRobo v 4.6 software |
| Zeiss PALM MicroBeam LCM system | Zeiss miscroscopy | ||
| TapeStation | Agilent | TapeStation 2200 |
Referências
- Emmert-Buck, M. R., et al. Laser capture microdissection. Science. 274 (5289), 998-1001 (1996).
- Alevizos, I., et al. Oral cancer in vivo gene expression profiling assisted by laser capture microdissection and microarray analysis. Oncogene. 20 (43), 6196-6204 (2001).
- Cong, P., et al. In situ localization of follicular lymphoma: description and analysis by laser capture microdissection. Blood, The Journal of the American Society of Hematology. 99 (9), 3376-3382 (2002).
- Blokhina, O., et al. Laser capture microdissection protocol for xylem tissues of woody plants. Frontiers in Plant Science. 7, 1965 (2017).
- Casson, S., Spencer, M., Walker, K., Lindsey, K. Laser capture microdissection for the analysis of gene expression during embryogenesis of Arabidopsis. The Plant Journal. 42 (1), 111-123 (2005).
- Chen, Z., et al. LCM-seq reveals the crucial role of LsSOC1 in heat-promoted bolting of lettuce (Lactuca sativa L.). The Plant Journal. 95 (3), 516-528 (2018).
- Jiao, Y., et al. A transcriptome atlas of rice cell types uncovers cellular, functional and developmental hierarchies. Nature Genetics. 41 (2), 258-263 (2009).
- Kivivirta, K., et al. A protocol for laser microdissection (LMD) followed by transcriptome analysis of plant reproductive tissue in phylogenetically distant angiosperms. Plant Methods. 15 (1), 1-11 (2019).
- Li, P., et al. The developmental dynamics of the maize leaf transcriptome. Nature Genetics. 42 (12), 1060-1067 (2010).
- Liew, L. C., et al. Temporal tissue-specific regulation of transcriptomes during barley (Hordeum vulgare) seed germination. The Plant Journal. 101 (3), 700-715 (2020).
- Matas, A. J., et al. Tissue-and cell-type specific transcriptome profiling of expanding tomato fruit provides insights into metabolic and regulatory specialization and cuticle formation. The Plant Cell. 23 (11), 3893-3910 (2011).
- Sakai, K., et al. Combining laser-assisted microdissection (LAM) and RNA-seq allows to perform a comprehensive transcriptomic analysis of epidermal cells of Arabidopsis embryo. Plant Methods. 14 (1), 10 (2018).
- Zhan, J., et al. RNA Sequencing of Laser-Capture Microdissected compartments of the maize kernel identifies regulatory modules associated with endosperm cell differentiation. The Plant Cell. 27 (3), 513-531 (2015).
- Hwang, B., Lee, J. H., Bang, D. Single-cell RNA sequencing technologies and bioinformatics pipelines. Experimental & Molecular Medicine. 50 (8), 1-14 (2018).
- Zeb, Q., Wang, C., Shafiq, S., Liu, L. . Single-Cell Omics. , 101-135 (2019).
- Deal, R. B., Henikoff, S. The INTACT method for cell type-specific gene expression and chromatin profiling in Arabidopsis thaliana. Nature Protocols. 6 (1), 56 (2011).
- Heiman, M., Kulicke, R., Fenster, R. J., Greengard, P., Heintz, N. Cell type-specific mRNA purification by translating ribosome affinity purification (TRAP). Nature Protocols. 9 (6), 1282 (2014).
- Bevilacqua, C., Ducos, B. Laser microdissection: A powerful tool for genomics at cell level. Molecular Aspects of Medicine. 59, 5-27 (2018).
- Nelson, T., Tausta, S. L., Gandotra, N., Liu, T. Laser microdissection of plant tissue: what you see is what you get. Annual Reviews in Plant Biology. 57, 181-201 (2006).
- Day, R. C., Grossniklaus, U., Macknight, R. C. Be more specific! Laser-assisted microdissection of plant cells. Trends in Plant Science. 10 (8), 397-406 (2005).
- Takahashi, H., et al. A method for obtaining high quality RNA from paraffin sections of plant tissues by laser microdissection. Journal of Plant Research. 123 (6), 807-813 (2010).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7 (1), 3 (2006).
- Ferreira, E. N., et al. Linear mRNA amplification approach for RNAseq from limited amount of RNA. Gene. 564 (2), 220-227 (2015).
- Schneider, J., et al. Systematic analysis of T7 RNA polymerase based in vitro linear RNA amplification for use in microarray experiments. BMC Genomics. 5 (1), 29 (2004).
- Shanker, S., et al. Evaluation of commercially available RNA amplification kits for RNA sequencing using very low input amounts of total RNA. Journal of Biomolecular Techniques. 26 (1), 4 (2015).
- Bhattacherjee, V., et al. Laser capture microdissection of fluorescently labeled embryonic cranial neural crest cells. Genesis. 39 (1), 58-64 (2004).
- Clément-Ziza, M., Munnich, A., Lyonnet, S., Jaubert, F., Besmond, C. Stabilization of RNA during laser capture microdissection by performing experiments under argon atmosphere or using ethanol as a solvent in staining solutions. RNA. 14 (12), 2698-2704 (2008).
- Blokhina, O., et al. Parenchymal Cells Contribute to Lignification of Tracheids in Developing Xylem of Norway Spruce. Plant Physiology. 181 (4), 1552-1572 (2019).
- Schad, M., Lipton, M. S., Giavalisco, P., Smith, R. D., Kehr, J. Evaluation of two-dimensional electrophoresis and liquid chromatography-tandem mass spectrometry for tissue-specific protein profiling of laser-microdissected plant samples. Electrophoresis. 26 (14), 2729-2738 (2005).
- Schad, M., Mungur, R., Fiehn, O., Kehr, J. Metabolic profiling of laser microdissected vascular bundles of Arabidopsis thaliana. Plant Methods. 1 (1), 2 (2005).
- Latrasse, D., et al. The quest for epigenetic regulation underlying unisexual flower development in Cucumis melo. Epigenetics & Chromatin. 10 (1), 22 (2017).
- Turco, G. M., et al. DNA methylation and gene expression regulation associated with vascularization in Sorghum bicolor. The New Phytologist. 214 (3), 1213-1229 (2017).
- Gomez, S. K., Harrison, M. J. Laser microdissection and its application to analyze gene expression in arbuscular mycorrhizal symbiosis. Pest Management Science: Formerly Pesticide Science. 65 (5), 504-511 (2009).
- Roux, B., et al. An integrated analysis of plant and bacterial gene expression in symbiotic root nodules using laser-capture microdissection coupled to RNA sequencing. The Plant Journal. 77 (6), 817-837 (2014).
- Tang, W., Coughlan, S., Crane, E., Beatty, M., Duvick, J. The application of laser microdissection to in planta gene expression profiling of the maize anthracnose stalk rot fungus Colletotrichum graminicola. Molecular Plant-Microbe Interactions. 19 (11), 1240-1250 (2006).

