Uma cultura de explanta de cauda 3D para estudar segmentação de vertebrados em zebrafish
Summary
Aqui, apresentamos o protocolo para a cultura tecidual 3D do eixo corporal posterior do zebrafish, possibilitando o estudo ao vivo da segmentação de vertebrados. Este modelo de explant fornece controle sobre o alongamento do eixo, alteração de fontes de morfógeno e imagem viva de nível de tecido de resolução subcelular.
Abstract
Embriões vertebrados padronizam seu eixo corporal principal como somites repetitivos, os precursores de vértebras, músculos e pele. As somitas se segmentam progressivamente do mesoderme presomótico (PSM) à medida que a extremidade traseira do embrião alonga posteriormente. As somitas formam-se com periodicidade regular e escala em tamanho. O zebrafish é um organismo modelo popular, pois é geneticamente tratável e possui embriões transparentes que permitem imagens vivas. No entanto, durante a somitogênese, os embriões de peixe são enrolados em torno de uma grande gema arredondada. Esta geometria limita a imagem viva do tecido PSM em embriões de zebrafish, particularmente em resoluções mais altas que requerem uma distância de trabalho objetiva próxima. Aqui, apresentamos um método de cultura de tecido 3D achatado para imagens vivas de explants de cauda de zebrafish. Explantas de cauda imitam embriões intactos exibindo uma desaceleração proporcional do alongamento do eixo e encurtamento dos comprimentos de somite rostrocaudal. Ainda podemos parar a velocidade de alongamento do eixo através da cultura explant. Isso, pela primeira vez, nos permite desembaraçar a entrada química de gradientes de sinalização da entrada mecanicista do alongamento axial. Em estudos futuros, este método pode ser combinado com uma configuração microfluida para permitir perturbações farmacêuticas controladas pelo tempo ou triagem da segmentação de vertebrados sem qualquer preocupação com a penetração de medicamentos.
Introduction
A segmentação metamérica de organismos é amplamente utilizada na natureza. Estruturas repetidas são essenciais para a funcionalidade de órgãos laterais como vértebras, músculos, nervos, vasos, membros ou folhas em um plano corporal1. Como resultado de tais restrições fisiológicas e geométricas da simetria axial, a maioria da phyla de Bilateria- como annelids, artrópodes e cordatas-exposição segmentação de seus tecidos embrionários (por exemplo, ectoderme, mesoderme) antero-posteriormente.
Embriões vertebrados segmentam sequencialmente seu mesoderme paraxial ao longo do eixo principal do corpo em somitas com intervalos específicos de espécies, contagens e distribuições de tamanho. Apesar de tal robustez entre embriões individuais dentro de uma espécie, a segmentação de somite é versátil entre espécies de vertebrados. A segmentação acontece em um vasto regime de intervalos de tempo (de 25 minutos em zebrafish a 5 h em humanos), tamanhos (de ~20 μm em somitas de cauda de zebrafish a ~200 μm em somitas tronco de camundongos) e conta (de 32 em zebrafish a ~300 em cobras de milho)2. O mais interessante é que os embriões de peixe podem desenvolver-se em uma ampla gama de temperaturas (de ~20,5 °C até 34 °C para zebrafish) mantendo seus somitas intactos com distribuições de tamanho adequado, compensando tanto os intervalos de segmentação quanto as velocidades de alongamento axial. Além dessas características interessantes, o zebrafish permanece como um organismo modelo útil para estudar a segmentação em vertebrados devido ao desenvolvimento externo, síncrono e transparente de uma plenitude de embriões irmãos, bem como suas ferramentas genéticas acessíveis. Adversamente a partir de uma perspectiva de microscopia, os embriões teleost desenvolvem-se em uma gema esférica volumosa, esticando e arredondando o tecido gastrulating ao seu redor(Figura 1A). Neste artigo, apresentamos uma cultura de explante de tecido 3D achatada para caudas de zebrafish. Este sistema de explant contorna as restrições esféricas da massa de gema, permitindo o acesso a imagens vivas de alta resolução de embriões de peixes para padronização de somite.
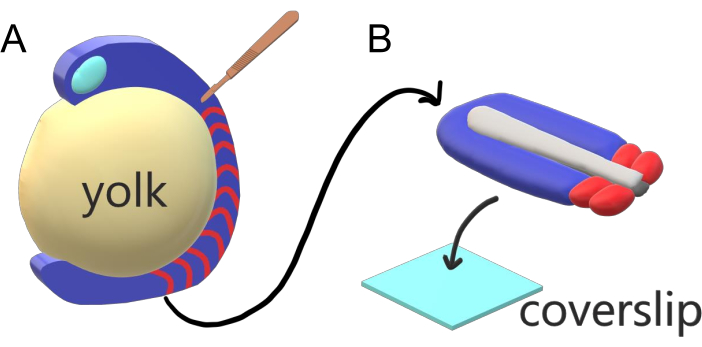
Figura 1: Sistema de Explantação de Câmara de Slides para Embriões de Zebrafish. (A) Os embriões de zebrafish têm vantagens para imagens vivas, como a transparência do tecido embrionário gastrulating (azul), mas o tecido se forma em torno de uma massa de gema esférica volumosa (amarela) que previne imagens quase objetivas e de alta resolução em embriões intactos. Explantas de cauda podem ser dissecadas começando com uma faca microcirúrgica (marrom) cortada do tecido anterior de somites (vermelho) e continuando na borda com a gema posteriormente. (B) Explantas traseiras dissecadas podem ser colocadas em um deslizamento (azul claro) dorsoventrally; mantendo tecido neural (cinza claro) em cima e notochord (cinza escuro) na parte inferior. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Este artigo apresenta um protocolo detalhado de uma técnica de explant de cultura de tecido que desenvolvemos e usamos recentemente5 para embriões de zebrafish. Nossa técnica baseia-se nos métodos anteriores de explantagem emfilhotes 8 e zebrafish9,10,11 organismos modelo. Explantas de cauda preparadas com este protocolo podem sobreviver desde >12 h em uma simples câmara de sl…
Declarações
The authors have nothing to disclose.
Acknowledgements
Agradecemos ao AECOM Zebrafish Core Facility e ao Serviço Veterinário Infantil de Cincinnati pela manutenção de peixes, ao Núcleo de Imagem Infantil de Cincinnati por assistência técnica, Didar Saparov pela assistência com a produção de vídeo e Hannah Seawall para a edição do manuscrito. A pesquisa relatada nesta publicação foi apoiada pelo Instituto Nacional de Ciências Médicas Gerais dos Institutos Nacionais de Saúde sob o Prêmio Número R35GM140805 a E.M.Ö. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente as opiniões oficiais dos Institutos Nacionais de Saúde.
Materials
| 1 mL Sub-Q Syringe with PrecisionGlide Needle | Becton, Dickinson and Co. | REF 309597 | for dechorionating embryos and manipulations |
| 200 Proof Ethanol, Anhydrous | Decon Labs | 2701 | for immunostaining |
| Antibiotic Antimycotic Solution (100×) | Sigma-Aldrich | A5955 | for tissue dissection media |
| Calcium Chloride Anhydrous, Powder | Sigma-Aldrich | 499609 | for tissue dissection media |
| Dimethylsulfoxide | Sigma-Aldrich | D5879 | for immunostaining |
| Disposable Scalpel, #10 Stainless Steel | Integra-Miltex | MIL4-411 | for preparing tape slide wells |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | 886-86-2 | (optional) for anesthesizing tissues older than 20 somites stage |
| Fetal Bovine Serum (FBS) | ThermoFisher | A3160601 | additional for tissue culture media |
| Goat anti-Mouse IgG2b, Alexa Fluor 594 | Invitrogen | Cat#A-21145; RRID: AB_2535781 | secondary antibody for immunostaining |
| L-15 Medium with L-Glutamine w/o Phenol Red | GIBCO | 21083-027 | for tissue dissection media |
| Methanol | Sigma-Aldrich | 179337 | for immunostaining |
| Microsurgical Corneal Knife 2.85 mm Angled Tip Double Bevel Blade | Surgical Specialties | 72-2863 | for tissue dissection |
| Mouse monoclonal anti-ppERK | Sigma-Aldrich | Cat#M8159; RRID:AB_477245 | for ppERK immunostaining |
| NucRed Live 647 ReadyProbes Reagent | Invitrogen | R37106 | (optional) for live staining of cell nuclei |
| Paraformaldehyde Powder, 95% | Sigma-Aldrich | 158127 | for fixation of samples for immunostaining |
| Rat Tail Collagen Coating Solution | Sigma-Aldrich | 122-20 | (optional) for chemically activating slide chambers |
| Stage Top Incubator | Tokai Hit | tokai-hit-stxg | (optional) for temperature control during live imaging |
| Transparent Tape 3/4'' | Scotch | S-9782 | for preparing tape slide wells |
| Triton X-100 | Sigma-Aldrich | X100 | for immunostaining |
| Tween 20 | Sigma-Aldrich | P1379 | for immunostaining |
| Zebrafish: Tg(actb2:2xMCP-NLS-EGFP) | Campbell et al., 2015 | ZFIN: ZDB-TGCONSTRCT-150624-4 | transgenic fish with nuclear localized EGFP |
| Zebrafish: Tg(Ola.Actb:Hsa.HRAS-EGFP) | Cooper et al., 2005 | ZFIN: ZDB-TGCONSTRCT-070117-75 | transgenic fish with cell membrane localized EGFP |
Referências
- Assheton, R. . Growth in length: Embryological Essays. , (1916).
- Gomez, C., et al. Control of segment number in vertebrate embryos. Nature. 454 (7202), 335-339 (2008).
- Westerfield, M. . The Zebrafish Book: a guide for the laboratory use of zebrafish (Danio rerio), 3rd edition. , (1995).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (1700003), (2017).
- Simsek, M. F., Ozbudak, E. M. Spatial fold change of Fgf signaling encodes positional information for segmental determination in zebrafish. Cell Reports. 24 (1), 66-78 (2018).
- Dubrulle, J., Pourquié, O. fgf8 mRNA decay establishes a gradient that couples axial elongation to patterning in the vertebrate embryo. Nature. 427 (6973), 419-422 (2004).
- Diez del Corral, R., et al. Opposing FGF and Retinoid Pathways Control Ventral Neural Pattern, Neuronal Differentiation, and Segmentation during Body Axis Extension. Neuron. 40 (1), 65-79 (2003).
- Stern, H. M., Hauschka, S. D. Neural tube and notochord promote in vitro myogenesis in single somite explants. Biologia do Desenvolvimento. 167 (1), 87-103 (1995).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics. 228 (3), 464-474 (2003).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in molecular biology. 546 (11), 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Biologia do Desenvolvimento. 406 (2), 172-185 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).

