Live Imaging av mikrokolonier med høy gjennomstrømning for å måle heterogenitet i vekst og genuttrykk
Summary
Gjærvekst fenotyper måles nøyaktig gjennom svært parallell tidsforløpavbildning av immobiliserte celler som vokser til mikrokolonier. Samtidig kan stresstoleranse, proteinuttrykk og proteinlokalisering overvåkes, og genererer integrerte datasett for å studere hvordan miljømessige og genetiske forskjeller, samt genuttrykks heterogenitet blant isogene celler, modulerer vekst.
Abstract
Presise målinger av mellom- og understamme heterogenitet i mikrobielle vekstrater er avgjørende for å forstå genetiske og miljømessige tilførsler til stresstoleranse, patogenisitet og andre viktige komponenter i kondisjon. Dette manuskriptet beskriver en mikroskopbasert analyse som sporer omtrent 105 Saccharomyces cerevisiae mikrokolonier per eksperiment. Etter automatisert tidsforløpsavbildning av gjær immobilisert i en multiwell plate, analyseres mikrokoloni vekstrater enkelt med tilpasset bildeanalyseprogramvare. For hver mikrokoloni kan uttrykk og lokalisering av fluorescerende proteiner og overlevelse av akutt stress også overvåkes. Denne analysen muliggjør presis estimering av stammenes gjennomsnittlige vekstrater, samt omfattende måling av heterogenitet i vekst, genuttrykk og stresstoleranse i kloniske populasjoner.
Introduction
Vekst fenotyper bidrar kritisk til gjær fitness. Naturlig utvalg kan effektivt skille mellom avstamninger med vekstrater forskjellig fra det motsatte av den effektive befolkningsstørrelsen, som kan overstige 108 personer1. Videre er variasjon av vekstrater blant individer i en befolkning en evolusjonært relevant parameter, da den kan tjene som grunnlag for overlevelsesstrategier sominnsatssikring 2,3,4,5,6. Derfor er analyser som tillater svært nøyaktige målinger av vekstfenotyper og deres fordelinger avgjørende for studiet av mikroorganismer. Mikrokolonivekstanalysen som er beskrevet her, kan generere individuelle vekstratemålinger for ~ 105 mikrokolonier per eksperiment. Denne analysen gir derfor en kraftig protokoll for å studere gjær evolusjonær genetikk og genomikk. Det egner seg spesielt godt til å teste hvordan variasjon i populasjoner av genetisk identiske enkeltceller genereres, vedlikeholdes og bidrar til befolkningsform7,8,9,10.
Metoden som er beskrevet her (Figur 1), bruker periodisk fangede, lavforstørrelsesbilder av celler som vokser i flytende medier på en 96- eller 384-brønns glassbunnplate for å spore vekst i mikrokolonier. Cellene holder seg til lectin concanavalin A, som dekker bunnen av mikroskopplaten, og danner todimensjonale kolonier. Fordi mikrokoloniene vokser i en monolayer, er mikrokoloniområdet svært korrelert med celle nummer7. Derfor kan nøyaktige estimater av mikrokoloni vekstrate og oppholdstid genereres med tilpasset bildeanalyseprogramvare som sporer endringshastigheten for området for hvert mikrokoloni. Videre kan det eksperimentelle oppsettet overvåke overflod og til og med subcellulære lokaliseringer av fluorescerende merkede proteiner uttrykt i disse mikrokoloniene. Nedstrøms behandling av data fra denne mikrokoloni vekstanalysen kan oppnås ved tilpasset analyse eller av eksisterende bildeanalyseprogramvare, for eksempel Processing Images Easily (PIE)11, en algoritme for robust koloniområdegjenkjenning og vekstanalyse med høy gjennomstrømning fra lavforstørrelse, brightfield-bilder, som er tilgjengelig via GitHub12.
Fordi vekstrateestimater avledet fra mikrokoloni-vekstanalysen genereres fra et stort antall enkeltkolonimålinger, er de ekstremt nøyaktige, med standardfeil flere størrelsesordener mindre enn estimatene selv for et rimelig stort eksperiment. Derfor er analysens kraft til å oppdage vekstratforskjeller mellom forskjellige genotyper, behandlinger eller miljøforhold høy. Multiwell-plateformatet gjør at mange forskjellige miljø- og genotypekombinasjoner kan sammenlignes i et enkelt eksperiment. Hvis stammer uttrykker forskjellige fluorescerende markører, kan de blandes i samme brønn og preges av påfølgende bildeanalyse, noe som kan øke kraften ytterligere ved å tillate brønn-for-brønn data normalisering.
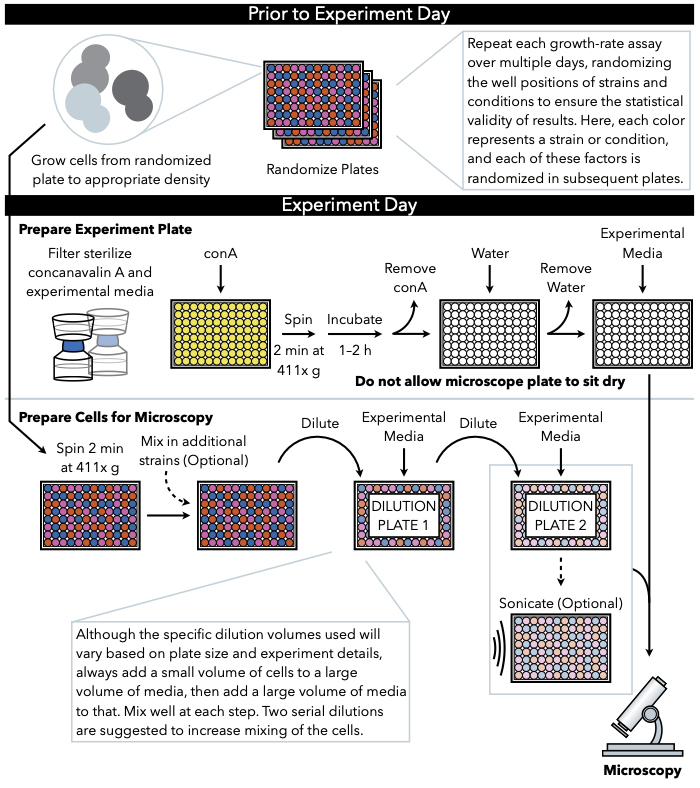
Figur 1: Skjematisk representasjon av protokollen. Denne protokollen følger to hovedtrinn, som er utarbeidelsen av eksperimentell plate og forberedelsen av cellene til bilde. Randomisering av plater og vekst av celler bør utføres før og før eksperimentdagen. Gjentatt blanding av celler på hvert trinn under fortynning er viktig i trinnene til plating, og derfor anbefales det å forberede den eksperimentelle platen først, slik at den er klar til plating umiddelbart etter ferdigstillelse av cellefortynning. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Protokollen som er beskrevet her er en allsidig analyse som gjør at cellevekst og genuttrykk kan overvåkes samtidig på nivået av individuelle mikrokolonier. Å kombinere disse to modalitetene gir unik biologisk innsikt. For eksempel har tidligere arbeid brukt denne analysen til å vise en negativ sammenheng mellom uttrykk for TSL1-genet og mikrokolonivekstraten i isogene wildtype-celler ved å måle begge samtidig7,10. Det er også mulig å overvåke…
Declarações
The authors have nothing to disclose.
Acknowledgements
Vi takker Naomi Ziv, Sasha Levy og Shuang Li for deres bidrag til å utvikle denne protokollen, David Gresham for delt utstyr, og Marissa Knoll for hjelp med videoproduksjon. Dette arbeidet ble støttet av National Institutes of Health grant R35GM118170.
Materials
| General Materials | |||
| 500 mL Bottletop Filter .22 µm PES Sterilizing, Low Protein Binding, w/45mm Neck | Fisher | CLS431154 | used to filter the media |
| BD Falcon*Tissue Culture Plates, microtest u-bottom | Fisher | 08-772-54 | 96-well culture tubes used to freeze cells, pre-grow cells, and dilutions |
| BD Syringes without Needle, 50 mL | Fisher | 13-689-8 | Used to filter the Concanavalin A |
| Costar Sterile Disposable Reagent Reservoirs | Fisher | 07-200-127 | reagent reservoirs used to pipette solutions with multichannel pipette |
| Costar Thermowell Aluminum Sealing Tape | Fisher | 07-200-684 | 96-well plate seal for pre-growth and freezing |
| lint and static free Kimwipes | Fisher | 06-666A | lint and static free wipes to keep microscope plate bottom free of debris and scratches |
| Nalgene Syringe Filters | ThermoFisher Scientific | 199-2020 | 0.2 μm pore size, 25 mm diameter; used to filter concanavalin A solution |
| Media Components | |||
| Minimal chemically defined media (MD; 2% glucose) | alternative microscopy media used for yeast pre-growth and growth during microscopy | ||
| Synthetic Complete Media (SC; 2% glucose) | microscopy media used for yeast pre-growth and growth during microscopy | ||
| Yeast extract-peptone-dextrose (YEPD; 2% glucose) medium | cell growth prior to freezing down randomized plates | ||
| Microscopy Materials | |||
| Breathe-Easy sealing membrane | Millipore Sigma | Z380059-1PAK | breathable membranes used to seal plate during microscopy experiment. At this stage breathable membranes are reccomended because they prevent condensation in the wells and allow for better microscopy images |
| Brooks 96-well flat clear glass bottom microscope plate | Dot Scientific | MGB096-1-2-LG-L | microscope plate |
| Concanavalin A from canavalia ensiformis (Jack Bean), lyophilized powder | Millipore Sigma | 45-C2010-1G | Make 5x concanavalin A solution and freeze 5ml of 5x concanavalin A in 50 mL conical tubes at -80 °C |
| Strains Used | |||
| MAH.5, MAH.96, MAH.52, MAH.66, MAH.11, MAH.58, MAH.135, MAH.15, MAH.44, MAH.132 | Haploid mutation accumulation strains in a laboratory background, described in Hall and Joseph 2010 | ||
| EP026.2A-2C | Progeny of the ancestral Hall and Joseph 2010 mutation accumulation strain, transformed with YFR054cΔ::Scw11P::GFP | ||
| Equipment | |||
| Misonix Sonicator S-4000 with 96-pin attachment | Sonicator https://www.labx.com/item/misonix-inc-s-4000-sonicator/4771281 | ||
| Nikon Eclipse Ti-E with Perfect Focus System | Inverted microscope with automated stage and autofocus system |
Referências
- Geiler-Samerotte, K. A., Hashimoto, T., Dion, M. F., Budnik, B. A., Airoldi, E. M., Drummond, D. A. Quantifying condition-dependent intracellular protein levels enables high-precision fitness estimates. PloS one. 8 (9), 75320 (2013).
- Kussell, E., Leibler, S. Phenotypic diversity, population growth, and information in fluctuating environments. Science. 309 (5743), 2075-2078 (2005).
- Thattai, M., van Oudenaarden, A. Stochastic gene expression in fluctuating environments. Genética. 167 (1), 523-530 (2004).
- King, O. D., Masel, J. The evolution of bet-hedging adaptations to rare scenarios. Theoretical population biology. 72 (4), 560-575 (2007).
- Acar, M., Mettetal, J. T., van Oudenaarden, A. Stochastic switching as a survival strategy in fluctuating environments. Nature genetics. 40 (4), 471-475 (2008).
- Avery, S. V. Microbial cell individuality and the underlying sources of heterogeneity. Nature reviews. Microbiology. 4 (8), 577-587 (2006).
- Levy, S. F., Ziv, N., Siegal, M. L. Bet hedging in yeast by heterogeneous, age-correlated expression of a stress protectant. PLoS biology. 10 (5), 1001325 (2012).
- van Dijk, D., et al. Slow-growing cells within isogenic populations have increased RNA polymerase error rates and DNA damage. Nature communications. 6, 7972 (2015).
- Ziv, N., Shuster, B. M., Siegal, M. L., Gresham, D. Resolving the Complex Genetic Basis of Phenotypic Variation and Variability of Cellular Growth. Genética. 206 (3), 1645-1657 (2017).
- Li, S., Giardina, D. M., Siegal, M. L. Control of nongenetic heterogeneity in growth rate and stress tolerance of Saccharomyces cerevisiae by cyclic AMP-regulated transcription factors. PLoS genetics. 14 (11), 1007744 (2018).
- Plavskin, Y., Li, S., Ziv, N., Levy, S. F., Siegal, M. L. Robust colony recognition for high-throughput growth analysis from suboptimal low-magnification brightfield micrographs. bioRxiv. , (2018).
- Ziv, N., Siegal, M. L., Gresham, D. Genetic and nongenetic determinants of cell growth variation assessed by high-throughput microscopy. Molecular biology and evolution. 30 (12), 2568-2578 (2013).
- Hall, D. W., Joseph, S. B. A high frequency of beneficial mutations across multiple fitness components in Saccharomyces cerevisiae. Genética. 185 (4), 1397-1409 (2010).
- Saleemuddin, M., Husain, Q. Concanavalin A: a useful ligand for glycoenzyme immobilization–a review. Enzyme and microbial technology. 13 (4), 290-295 (1991).
- Geiler-Samerotte, K. A., Bauer, C. R., Li, S., Ziv, N., Gresham, D., Siegal, M. L. The details in the distributions: why and how to study phenotypic variability. Current opinion in biotechnology. 24 (4), 752-759 (2013).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: a practical guide for biologists. Biological reviews of the Cambridge Philosophical Society. 85 (4), 935-956 (2010).
- Bolker, J. A. Exemplary and surrogate models: two modes of representation in biology. Perspectives in biology and medicine. 52 (4), 485-499 (2009).

