Nanodeeltjes tracking analyse voor de kwantificering en groottebepaling van extracellulaire blaasjes
Summary
We demonstreren hoe we een nieuw nanodeeltjesvolganalyse-instrument kunnen gebruiken om de grootteverdeling en de totale deeltjesconcentratie van extracellulaire blaasjes geïsoleerd uit perigonadaal vetweefsel van muizen en menselijk plasma te schatten.
Abstract
De fysiologische en pathofysiologische rollen van extracellulaire blaasjes (EV’s) zijn steeds meer erkend, waardoor het EV-veld een snel evoluerend onderzoeksgebied is. Er zijn veel verschillende methoden voor EV-isolatie, elk met verschillende voor- en nadelen die van invloed zijn op de stroomafwaartse opbrengst en zuiverheid van EV’s. Het karakteriseren van de EV-prep geïsoleerd uit een bepaalde bron door een gekozen methode is dus belangrijk voor de interpretatie van downstream-resultaten en vergelijking van resultaten tussen laboratoria. Er bestaan verschillende methoden voor het bepalen van de grootte en hoeveelheid EV’s, die kunnen worden gewijzigd door ziektetoestanden of als reactie op externe omstandigheden. Nanoparticle tracking analysis (NTA) is een van de prominente technologieën die worden gebruikt voor high-throughput analyse van individuele EV’s. Hier presenteren we een gedetailleerd protocol voor kwantificering en groottebepaling van EV’s geïsoleerd uit perigonadaal vetweefsel van muizen en menselijk plasma met behulp van een baanbrekende technologie voor NTA die grote vooruitgang in het veld vertegenwoordigt. De resultaten tonen aan dat deze methode reproduceerbare en geldige totale deeltjesconcentratie- en grootteverdelingsgegevens kan leveren voor EV’s die met verschillende methoden uit verschillende bronnen zijn geïsoleerd, zoals bevestigd door transmissie-elektronenmicroscopie. De aanpassing van dit instrument voor NTA zal tegemoet komen aan de behoefte aan standaardisatie in NTA-methoden om de striktheid en reproduceerbaarheid in EV-onderzoek te vergroten.
Introduction
Extracellulaire blaasjes (EV’s) zijn kleine (0,03-2 μm) membraangebonden blaasjes die door bijna alle celtypen worden uitgescheiden1. Ze worden vaak aangeduid als “exosomen”, “microvesicles” of “apoptotische lichamen”, afhankelijk van hun mechanisme van afgifte en grootte2. Hoewel aanvankelijk werd gedacht dat EV’s gewoon een middel waren om afval uit de cel te verwijderen om homeostase te behouden3, weten we nu dat ze ook kunnen deelnemen aan intercellulaire communicatie via overdracht van moleculair materiaal – inclusief DNA, RNA (mRNA, microRNA), lipiden en eiwitten4,5 – en dat ze belangrijke regulatoren zijn van normale fysiologie en pathologische processen1, 5,6,7,8.
Er zijn veel verschillende methoden om EV’s te isoleren en te kwantificeren, die elders zijn beschreven9,10,11,12. Het gebruikte isolatieprotocol en de bron van EV’s kunnen een grote invloed hebben op de ev-opbrengst en -zuiverheid. Zelfs differentiële centrifugatie, lang beschouwd als de “gouden standaard” -benadering voor exosoomisolatie, kan onderhevig zijn aan aanzienlijke variabiliteit die vervolgens van invloed is op de verkregen EV-populatie en downstream-analyses13. De verschillende methoden voor EV-isolatie en kwantificering maken het dus moeilijk om resultaten van experimenten die in de literatuur zijn gerapporteerd, te vergelijken, reproduceren en interpreteren14. Bovendien kan de afgifte van EV’s worden geregeld door cellulaire omstandigheden of verschillende externe factoren. Er is gesuggereerd dat EV’s een rol spelen bij het handhaven van cellulaire homeostase door cellen te beschermen tegen intracellulaire stress15, omdat verschillende studies hebben aangetoond dat cellulaire stress EV-secretie stimuleert. Er is bijvoorbeeld een verhoogde EV-afgifte gemeld na cellulaire blootstelling aan hypoxie, endoplasmatische reticulumstress, oxidatieve stress, mechanische stress, sigarettenrookextract en fijnstofluchtverontreiniging16,17,18,19,20,21,22. Ev-release is ook in vivo aangepast; muizen die werden onderworpen aan een vetrijk dieet of zestien uur vasten, lieten meer adipocyten-EV’s los23. Om te onderzoeken of een specifieke behandeling of aandoening de EV-afgifte verandert, moet het aantal EV’s nauwkeurig worden bepaald. Beoordeling van de EV-grootteverdeling kan ook wijzen op de overheersende subcellulaire oorsprong van EV’s (bv. fusie van late endosomen/multivesiculaire lichamen met het plasmamembraan versus ontluiking van het plasmamembraan)24. Er is dus behoefte aan robuuste methoden om de totale concentratie en de grootteverdeling van de ev-prep die wordt bestudeerd nauwkeurig te meten.
Een snelle en zeer gevoelige methode voor de visualisatie en karakterisering van EV’s in oplossing is nanoparticle tracking analysis (NTA). Een gedetailleerde uitleg van de principes van deze methode en vergelijking met alternatieve methoden voor de beoordeling van ev-grootte en -concentratie zijn eerder beschreven25,26,27,28. Kortom, tijdens NTA-metingen worden EV’s gevisualiseerd door het licht dat wordt verstrooid wanneer ze worden bestraald met een laserstraal. Het verstrooide licht wordt door een microscoop gericht op een camera die de deeltjesbeweging registreert. De NTA-software volgt de willekeurige thermische beweging van elk deeltje, bekend als Brownse beweging, om de diffusiecoëfficiënt te bepalen die wordt gebruikt om de grootte van elk deeltje te berekenen met behulp van de Stokes-Einstein-vergelijking. NTA werd voor het eerst toegepast op het meten van EV’s in een biologisch monster in 201125. Tot voor kort waren er slechts twee reguliere bedrijven die commerciële NTA-instrumentenaanboden 29 tot de introductie van de ViewSizer 3000 (hierna het deeltjesvolginstrument genoemd) die een combinatie van nieuwe hardware- en softwareoplossingen gebruikt om aanzienlijke beperkingen van andere NTA-technieken te overwinnen.
Het deeltjesvolginstrument karakteriseert nanodeeltjes in vloeibare monsters door hun Brownse beweging te analyseren en karakteriseert grotere microngrote deeltjes door zwaartekrachtbezinking te analyseren. Het unieke optische systeem van dit instrument, dat multispectrale verlichting omvat met drie laserlichtbronnen (bij 450 nm, 520 nm en 635 nm), stelt onderzoekers in staat om een breed scala aan deeltjesgroottes (bijv. Exosomen, microvesicles) tegelijkertijd te analyseren. Een schema van de instrumentopstelling is weergegeven in figuur 1.
Hier laten we zien hoe deeltjesgrootteverdeling en concentratiemetingen van geïsoleerde muizen en menselijke EV’s kunnen worden uitgevoerd met behulp van een nieuw NTA-instrument.
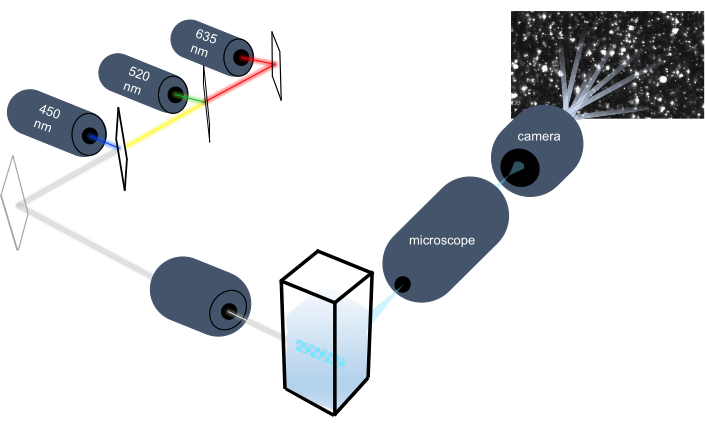
Figuur 1: Deeltjesvolginstrument optisch systeem. Het NTA-instrument verlicht deeltjes met behulp van drie lasers met de volgende golflengten: 450 nm, 520 nm, 635 nm. Video-opname van het verstrooide licht van individuele deeltjes wordt gedetecteerd en gevolgd door een digitale videocamera die 90° van de cuvette is georiënteerd. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Hier demonstreren we een protocol voor NTA van EV’s om de grootteverdeling van een breed scala aan deeltjesgroottes tegelijkertijd te meten en de totale EV-concentratie in een polydisperse-monster te meten. In deze studie werden perigonadaal vetweefsel van muizen en menselijk plasma gebruikt als bron van EV’s. EV’s geïsoleerd uit andere weefsels of biologische vloeistoffen zoals serum, urine, speeksel, moedermelk, vruchtwater en celkweeksupernatant kunnen echter ook worden gebruikt voor NTA. Metingen van polystyreenkraa…
Declarações
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door de National Institutes of Health (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608). We erkennen Jeffrey Bodycomb, Ph.D. van HORIBA Instruments Incorporated voor zijn hulp bij het kalibreren van het instrument.
Materials
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | – | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | – | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | – | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | – | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | – | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | – | Nanoparticle tracking instrument |
Referências
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569 (2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421 (2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D’Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis – An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016 (2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution – a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. . Absorption and Scattering of Light by Small Particles. , (1983).

