Nanopartikkelsporingsanalyse for kvantifisering og størrelsesbestemmelse av ekstracellulære vesicles
Summary
Vi demonstrerer hvordan man bruker et nytt nanopartikkelsporingsanalyseinstrument for å estimere størrelsesfordelingen og den totale partikkelkonsentrasjonen av ekstracellulære vesikler isolert fra musperigonadal fettvev og humant plasma.
Abstract
De fysiologiske og patofysiologiske rollene til ekstracellulære vesikler (ELBILER) har blitt stadig mer anerkjent, noe som gjør EV-feltet til et raskt utviklende forskningsområde. Det er mange forskjellige metoder for EV-isolasjon, hver med klare fordeler og ulemper som påvirker nedstrømsutbyttet og renheten til elbiler. Å karakterisere EV-prep isolert fra en gitt kilde ved en valgt metode er derfor viktig for tolkning av nedstrømsresultater og sammenligning av resultater på tvers av laboratorier. Det finnes ulike metoder for å bestemme størrelsen og mengden elbiler, som kan endres av sykdomstilstander eller som svar på ytre forhold. Nanopartikkelsporingsanalyse (NTA) er en av de fremtredende teknologiene som brukes til høygjennomstrømningsanalyse av individuelle elbiler. Her presenterer vi en detaljert protokoll for kvantifisering og størrelsesbestemmelse av elbiler isolert fra musperigonadal fettvev og humant plasma ved hjelp av en banebrytende teknologi for NTA som representerer store fremskritt innen feltet. Resultatene viser at denne metoden kan levere reproduserbare og gyldige totale partikkelkonsentrasjons- og størrelsesfordelingsdata for elbiler isolert fra forskjellige kilder ved hjelp av forskjellige metoder, som bekreftet ved transmisjonselektronmikroskopi. Tilpasningen av dette instrumentet for NTA vil adressere behovet for standardisering i NTA-metoder for å øke strenghet og reproduserbarhet i EV-forskning.
Introduction
Ekstracellulære vesikler (ELBILER) er små (0,03-2 μm) membranbundne vesikler utskilt av nesten alle celletyper1. De blir ofte referert til som “eksosomer”, “mikrovesicles” eller “apoptotiske kropper” avhengig av deres frigjøringsmekanisme og størrelse2. Mens det først ble antatt at elbiler bare var et middel til å eliminere avfall fra cellen for å opprettholde homeostase3, vet vi nå at de også kan delta i intercellulær kommunikasjon via overføring av molekylært materiale – inkludert DNA, RNA (mRNA, microRNA), lipider og proteiner4,5 – og at de er viktige regulatorer for normal fysiologi samt patologiske prosesser1, 5,6,7,8.
Det finnes mange forskjellige metoder for å isolere og kvantifisere elbiler, som er beskrevet andre steder9,10,11,12. Isolasjonsprotokollen som brukes, så vel som kilden til elbiler, kan i stor grad påvirke EV-utbytte og renhet. Selv differensial sentrifugering, lenge ansett som “gullstandard” tilnærming for eksosomisolasjon, kan bli gjenstand for betydelig variasjon som senere påvirker EV-befolkningen oppnådd og nedstrøms analyser13. Dermed gjør de ulike metodene for EV-isolasjon og kvantifisering det vanskelig å sammenligne, reprodusere og tolke resultater av eksperimenter rapportert i litteraturen14. Videre kan EV-utgivelse reguleres av cellulære forhold eller ulike eksterne faktorer. Det har blitt antydet at elbiler spiller en rolle i å opprettholde cellulær homeostase ved å beskytte celler mot intracellulær stress15, som flere studier har vist at cellulær stress stimulerer EV-sekresjon. For eksempel har økt EV-frigjøring blitt rapportert etter cellulær eksponering for hypoksi, endoplasmisk retikulumspenning, oksidativt stress, mekanisk stress, sigarettrøykekstrakt og partikkelmaterialeluftforurensning 16,17,18,19,20,21,22. EV-utgivelsen har også vist seg å være modifisert in vivo; mus utsatt for et høyt fett diett eller faste i seksten timer utgitt mer adipocyte ELBILER23. For å undersøke om en bestemt behandling eller tilstand endrer EV-utslipp, må antall elbiler bestemmes nøyaktig. Vurdering av EV-størrelsesfordelingen kan også indikere den dominerende subcellulære opprinnelsen til elbiler (f.eks. sammensmelting av sen endosomer/multivesikulære legemer med plasmamembran vs. spirende plasmamembran)24. Dermed er det behov for robuste metoder for å nøyaktig måle den totale konsentrasjonen og størrelsesfordelingen til EV-prep som studeres.
En rask og svært følsom metode for visualisering og karakterisering av elbiler i løsning er nanopartikkelsporingsanalyse (NTA). En detaljert forklaring av prinsippene for denne metoden og sammenligning med alternative metoder for vurdering av EV-størrelse og konsentrasjon er beskrevet tidligere25,26,27,28. Kort sagt, under NTA-måling visualiseres elbiler av lyset spredt når de bestråles med en laserstråle. Det spredte lyset er fokusert av et mikroskop på et kamera som registrerer partikkelbevegelsen. NTA-programvaren sporer den tilfeldige termiske bevegelsen til hver partikkel, kjent som Brownian bevegelse, for å bestemme diffusjonskoeffisienten som brukes til å beregne størrelsen på hver partikkel ved hjelp av Stokes-Einstein-ligningen. NTA ble først brukt på måling av elbiler i et biologisk utvalg i 201125. Inntil nylig var det bare to mainstream-selskaper som tilbyr kommersielle NTA-instrumenter29 frem til innføringen av ViewSizer 3000 (heretter referert til som partikkelsporingsinstrumentet) som bruker en kombinasjon av nye maskinvare- og programvareløsninger for å overvinne betydelige begrensninger i andre NTA-teknikker.
Partikkelsporingsinstrumentet karakteriserer nanopartikler i væskeprøver ved å analysere deres brownske bevegelse og karakteriserer større mikronstore partikler ved å analysere gravitasjonsoppgjør. Dette instrumentets unike optiske system, som inkluderer multispektral belysning med tre laserlyskilder (ved 450 nm, 520 nm og 635 nm), gjør det mulig for forskere å analysere et bredt spekter av partikkelstørrelser (f.eksoser, mikrovesicles) samtidig. Et skjema av instrumentoppsettet vises i figur 1.
Her demonstrerer vi hvordan man utfører partikkelstørrelsesfordeling og konsentrasjonsmålinger av isolert mus og menneskelige elbiler ved hjelp av et nytt NTA-instrument.
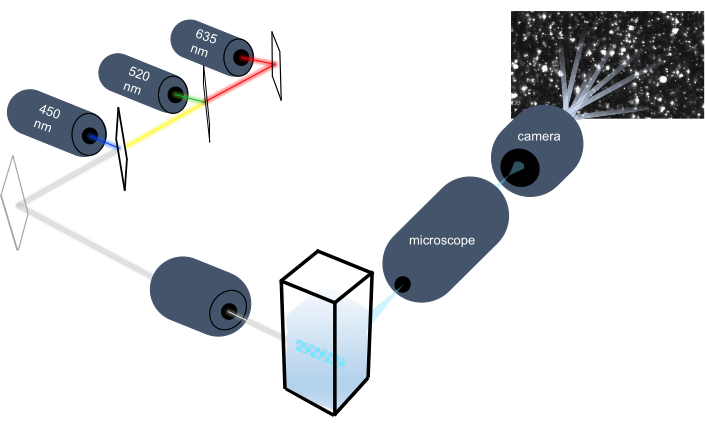
Figur 1: Optisk system for partikkelsporingsinstrument. NTA-instrumentet lyser opp partikler med tre lasere med følgende bølgelengder: 450 nm, 520 nm, 635 nm. Videoopptak av det spredte lyset fra individuelle partikler oppdages og spores av et digitalt videokamera orientert 90° fra cuvette. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Her demonstrerer vi en protokoll for NTA av elbiler for å måle størrelsesfordelingen av et bredt spekter av partikkelstørrelser samtidig og måle total EV-konsentrasjon i en polydisperseprøve. I denne studien ble musperigonadal fettvev og humant plasma brukt som kilde til elbiler. Imidlertid kan elbiler isolert fra andre vev eller biologiske væsker som serum, urin, spytt, morsmelk, fostervann og cellekultur supernatant også brukes til NTA. Målinger av polystyrenperlestandarder sørget for at instrumentet ble rikt…
Declarações
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av National Institutes of Health (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608). Vi anerkjenner Jeffrey Bodycomb, ph.d. i HORIBA Instruments Incorporated for hans hjelp til å kalibrere instrumentet.
Materials
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | – | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | – | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | – | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | – | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | – | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | – | Nanoparticle tracking instrument |
Referências
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569 (2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421 (2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D’Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis – An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016 (2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution – a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. . Absorption and Scattering of Light by Small Particles. , (1983).

