Obstrução microcirúrgica de Testes Fusion em Spodoptera litura
Summary
A folha de alumínio foi microsurgicamente inserida entre os testículos de Spodoptera litura para obstruir a fusão de testis. O procedimento inclui congelamento, fixação, desinfecção, incisão, colocação da barreira, sutura, alimentação pós-operatória e inspeção. Essa abordagem fornece um método para interferir na formação de tecidos.
Abstract
Em vez de usar métodos genéticos como a interferência de RNA (RNAi) e agrupar regularmente repetições palindrômicas curtas interespaçadas (CRISPR)/CRISPR-associated Cas9, uma barreira física foi microsurgicamente inserida entre os testículos de Spodoptera litura para estudar o impacto desta microcirurgia em seu crescimento e reprodução. Após inserir papel alumínio entre os testículos, a fusão de insetos durante a metamorfose prosseguiu normalmente. O crescimento e o desenvolvimento de insetos não foram notavelmente alterados; no entanto, o número de pacotes de esperma mudou se a fusão de testículos fosse interrompida pela microcirurgia. Esses achados implicam que o bloqueio da fusão testicular pode influenciar a capacidade de reprodução masculina. O método pode ser aplicado ainda mais para interromper a comunicação entre órgãos para estudar a função de vias de sinalização específicas. Em comparação com a cirurgia convencional, a microcirurgia requer apenas uma anestesia congelante, que é preferível à anestesia de dióxido de carbono. A microcirurgia também minimiza a área do local da cirurgia e facilita a cicatrização da ferida. No entanto, a seleção de materiais com funções específicas precisa ser aprofundada. Evitar lesões teciduais é crucial ao fazer incisões durante a operação.
Introduction
A fusão é um fenômeno comum no desenvolvimento de tecidos ou órgãos. Exemplos incluem fechamento dorsal e fechamento do tórax em Drosophila1 e morfogênese do paladar, morfogênese do tubo neural e morfogênese cardíaca em camundongos e frango2. CRISPR e RNAi têm sido aplicados para investigar os papéis dos genes no processo de fusão2,3,4.
Spodoptera litura (S. litura, Lepidoptera: Noctuidae) é uma praga polifagosa prejudicial que é amplamente distribuída em áreas tropicais e subtropicais da Ásia, incluindo China4,5,6. A ampla distribuição da S. litura é parcialmente atribuída à sua poderosa capacidade reprodutiva, que é relevante para o desenvolvimento da gônada. A infertilidade masculina é uma abordagem para controlar esta praga. Como mostrado na figura esquemática da estrutura testicular, os testículos são incluídos pela baia testicular, incluindo a baáta externa (baia peritoneal) e a lamina basal interna. A lamina basal se estende internamente para formar o epitélio folicular e separa a área interna dos testículos em quatro câmaras chamadas folículos (Figura 1).
Nos folículos, a espermatogonia se desenvolve em espermatozoides após mitose e meiose, e então os espermatozoides nos sacos de esperma se alinham na mesma direção para formar espermatozoides7. Durante a espermatogênese, os espermatotozóides primários se diferenciam em espermatozoides eupyrenos ou espermatozoides apirenos. Os espermatotozóides na fase larval desenvolvem-se em esperma de eupirrena com uma cauda longa conectada a uma cabeça de um núcleo alongado; estes podem fertilizar ovos. Por outro lado, os espermatocitotas na fase de pupal médio desenvolvem-se em espermatozoides apirene com um núcleo descartado; esses espermatozoides auxiliam na sobrevivência, movimento e fertilização do esperma eupyreno9,10. O sexto dia da pupa é o período durante o qual os testículos têm abundantes pacotes de esperma de eupirrena e apirena.
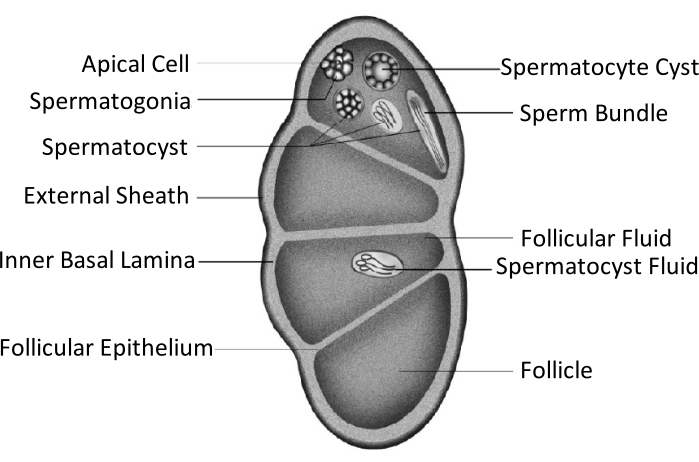
Figura 1: Diagrama esquemático da estrutura testicular dos insetos Lepidoptera11. Clique aqui para ver uma versão maior desta figura.
A fusão testicular ocorre na maioria dos insetos da ordem Lepidoptera11,12, especialmente nas espécies que são pragas agrícolas. A fusão testicular refere-se a um par de testículos crescendo bilateralmente na fase larval, aproximando-se e aderindo uns aos outros, eventualmente integrando-se em uma única gônada11. Em Spodoptera litura, acontece durante a metamorfose da larval ao estágio pupal. Do primeiro dia do 5º instar (L5D1) ao 4º dia da 6ª instar (L6D4), o par de testículos cresce gradualmente em tamanho, e a cor fica amarelo claro do branco-marfim. Torna-se vermelho fraco à medida que atinge a fase prepupal (L6D5 a L6D6). Dois testículos simétricos bilaterais se aproximam durante o estágio prepupal, fundem-se em um, e torcem no sentido anti-horário (visão doral) para produzir um único testículo nas fases pupal e adulta11. Esse fenômeno não ocorre em bichos-da-seda, que têm considerável importância econômica e foram domesticados por 5000 anos13. Assim, supõe-se que a fusão dos testículos melhora a capacidade reprodutiva.
Para determinar a significância da fusão testicular Spodoptera litura , é importante investigar os efeitos do bloqueio do processo. Neste protocolo, a folha de alumínio foi microsurgicamente inserida entre os testículos para mantê-los separados, e foram estudadas as consequentes mudanças no desenvolvimento dos insetos e seus testículos.
Protocol
Representative Results
Discussion
Depois de obstruir microsurgicamente a fusão de testículos em Spodoptera litura, o número de espermatozoides diminuiu, o que apoiou a hipótese de que essa fusão é benéfica para a capacidade reprodutiva. A manipulação cirúrgica tem sido usada para estudar o desenvolvimento fisiológico de insetos desde o início do século XX. Para determinar se o nervo craniano é regulado pela metamorfose de insetos, alguns pesquisadores realizaram procedimentos como ligadura e decapitação em diferentes i…
Declarações
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi apoiado pela National Natural Science Foundation of China (Nos.:31772519, 31720103916; ) e uma bolsa aberta do Laboratório Estadual de Biologia do Genoma da Bicho-Da-Seda da Universidade do Sudoeste (No.: sklsgb2013003).
Materials
| 75% Rubbing alcohol | Qingdao Hainuo Nuowei Disinfection Technology Co., Ltd | Q/370285HNW 001-2019 | |
| Colored Push Pins | Deli Group Co.,LTD | 0042 | |
| Corneal Scissors | Suzhou Xiehe Medical Device Co., Ltd | MR-S221A | Curved and blunt tip |
| Glad Aluminum Foil | Clorox China(Guangzhou) Limited | 831457 | 10 cm*2.5 cm*0.6 |
| Medical Cotton Swabs (Sterile) | Winner Medical Co., Ltd. | 601-022921-01 | |
| Medical Iodine Cotton Swab | Winner Medical Co., Ltd. | 608-000247 | |
| Needle holder | Shanghai Medical Instruments (Group) Ltd., Corp. | J32030 | 14 cm fine needle |
| Sterile surgical blade | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | #11 | |
| Suigical Blade Holder | Shanghai Pudong Jinhuan Medical Supplies Co., LTD | K6-10 | Straight 3# |
| Suture thread with needle | Ningbo Medical Stitch Needle Co., Ltd | needle: 3/8 Circle, 2.5*8 ; Thread: Nylon, 6/0, 25 cm | |
| Tying Forceps | Suzhou Xiehe Medical Device Co., Ltd | MR-F201T-3 | Straight-pointed; long handle; 0.12 mm-wide-head |
Referências
- Zeitlinger, J., Bohmann, D. Thorax closure in Drosophila: involvement of Fos and the JNK pathway. Development. 126 (17), 3947-3956 (1999).
- Ray, H. J., Niswander, L. Mechanisms of tissue fusion during development. Development. 139 (10), 1701-1711 (2012).
- Ducuing, A., Keeley, C., Mollereau, B., Vincent, S. A. DPP-mediated feed-forward loop canalizes morphogenesis during Drosophila dorsal closure. The Journal of Cell Biology. 208 (2), 239-248 (2015).
- Du, Q., et al. Identification and functional characterization of doublesex gene in the testis of Spodoptera litura. Insect Science. 26 (6), 1000-1010 (2019).
- Qin, H. G., Ding, J., Ye, Z. X., Huang, S. J., Luo, R. H. Dynamic analysis of experimental population of Spodoptera litura. Journal of Biosafety. 13 (2), 45-48 (2004).
- Guan, B. B., et al. The research in biology and ecology of Spodoptera litura. Journal of Biosafety. 8 (1), 57-61 (1999).
- Wen, L., et al. The testis development and spermatogenesis in Spodopture litura (lepidoptera: noctuidae). Journal of South China Normal University (Natural Science Edition. 51 (4), 47-56 (2019).
- Friedländer, M., Seth, R. K., Reynolds, S. E. Eupyrene and apyrene sperm: dichotomous spermatogenesis in Lepidoptera. Advances in Insect Physiology. 32, 206 (2010).
- Cook, P. A., Wedell, N. Non-fertile sperm delay female remating. Nature. 397 (6719), 486 (1999).
- Iriki, S. On the function of apyrene spermatozoa in the silk worm. Zoological Magazine. 53, 123-124 (1941).
- Liu, L., Feng, Q. L. The study of fusion of testis in Lepidoptera insects. Journal of South China Normal University (Natural Science Edition). 46 (5), 1-7 (2014).
- Klowden, M. J. . Physiological systems in insects. , (2007).
- Xu, J., et al. Transgenic characterization of two testis-specific promoters in the silkworm, Bombyx mori. Insect Molecular Biology. 24 (2), 183-190 (2015).
- Guo, X. R., Zheng, S. C., Liu, L., Feng, Q. L. The sterol carrier protein 2/3-oxoacyl-CoA thiolase (SCPx) is involved in cholesterol uptake in the midgut of Spodoptera litura: gene cloning, expression, localization and functional analyses. BioMed Central Molecular Biology. 10, 102 (2009).
- Kopeć, S. Studies on the necessity of the brain for the inception of insect metamorphosis. Biological Bulletin. 42 (6), 323-342 (1922).
- Wigglesworth, V. B. Factors controlling moulting and ‘metamorphosis’ in an insect. Nature. 133 (5), 725-726 (1934).
- Williams, C. N. Physiology of insect diapause; the role of the brain in the production and termination of pupal dormancy in the giant silkworm, Platysamia cecropia. Biological Bulletin. 90 (3), 234-243 (1946).
- Fukuda, S. Hormonal control of molting and pupation in the silkworm. Proceedings of the Imperial Academy Tokyo. 16 (8), 417-420 (1940).
- Tian, H. J., Liu, Z. P., Bai, Y. Y. Common methods to detect Sperm quality of mammalian. Journal of Economic Zoology. 8 (4), 198-201 (2004).
- Ji, X. S., Chen, S. L., Zhao, Y., Tian, Y. S. Progress in the quality evaluation of fish sperm. Chinese Fishery Science. 14 (6), 1048-1054 (2007).
- Baulny, B. O. D., Vern, Y. L., Kerboeuf, D., Maisse, G. Flow cytometric evaluation of mitochondrial activity and membrane integrity in fresh and cryopreserved rainbow trout (Oncorhynchus mykiss) spermatozoa. Cryobiology. 34 (2), 141-149 (1997).
- Krasznai, Z., Márián, T., Balkay, I., Emri, M., Trón, L. Permeabilization and structural changes in the membrane of common carp (Cyprinus carpio L.) sperm induced by hypo-osmotic shock. Aquaculture. 129 (1), 134 (1995).
- Kime, D. E., et al. Computer-assisted sperm analysis (CASA) as a tool for monitoring sperm quality in fish. Comparative Biochemistry & Physiology Toxicology & Pharmacology Cbp. 130 (4), 425-433 (2001).
- Rurangwa, E., Volckaert, F. A., Huyskens, G., Kime, D. E., Ollevier, F. Quality control of refrigerated and cryopreserved semen using computer-assisted sperm analysis (CASA), viable staining and standardized fertilization in African catfish (Clarias gariepinus). Theriogenology. 55 (3), 751-769 (2001).
- Seth, R. K., Kaur, J. J., Rao, D. K., Reynolds, S. E. Effects of larval exposure to sublethal concentrations of the ecdysteroid agonists RH-5849 and tebufenozide (RH-5992) on male reproductive physiology in Spodoptera litura. Journal of Insect Physiology. 50 (6), 505-517 (2004).
- Sweeney, R. M., Watterson, R. L. Rib development in chick embryos analyzed by means of tantalum foil blocks. American Journal of Anatomy. 126 (2), 127-149 (1969).
- Wilde, S., Logan, M. P. Application of impermeable barriers combined with candidate factor soaked beads to study inductive signals in the chick. Journal of Visualized Experiments. (117), e54618 (2016).

