Stopped-flow and Small-angle Neutron Scattering을 이용한 나노스케일 물질의 시간 진화 측정
Summary
이 프로토콜은 소각 중성자 산란 측정 중에 여러 액체 용액을 현장에서 신속하게 혼합하고 나노미터 길이 스케일 및 두 번째 시간 스케일에서 동역학 과정을 연구하기 위해 정지 흐름 샘플 환경을 사용합니다.
Abstract
이 논문은 정지 흐름 소각 중성자 산란(SANS) 샘플 환경을 사용하여 액체 샘플을 빠르게 혼합하고 몇 초에서 몇 분의 시간 규모로 나노 스케일 운동 과정을 연구하는 방법을 제시합니다. 흐름이 멈춘 시료 환경에서는 시중에서 판매되는 주사기 펌프를 사용하여 원하는 부피의 액체 시료를 혼합한 다음 동적 믹서를 통해 약 1초 내에 석영 유리 셀에 주입합니다. 시간 분해 SANS 데이터 수집은 혼합 후 용액에서 나노 구조의 진화를 따르기 위해 샘플 혼합과 동기화됩니다.
중성자 빔 시간을 가장 효율적으로 사용하기 위해 일련의 유량 선택 밸브를 사용하여 측정 사이에 셀을 자동으로 로드, 헹굼 및 건조하여 여러 샘플 주입을 통해 반복적인 데이터 수집이 가능합니다. 충분한 중성자 산란 통계가 수집될 때까지 샘플 주입을 반복합니다. 혼합 설정은 다양한 혼합 비율, 시료 농도, 첨가제 농도 및 온도에서 동역학을 측정하기 위해 조건을 체계적으로 변경하도록 프로그래밍할 수 있습니다. 주입당 필요한 최소 시료 부피는 석영 셀의 경로 길이에 따라 약 150μL입니다.
이 정지 흐름 샘플 환경을 사용한 대표적인 결과는 첨가제인 사이클로덱스트린의 존재 하에서 빠른 지질 교환 역학에 대해 제시됩니다. 소포는 몇 초 안에 외부 전엽(외부) 지질을 교환하고 몇 시간 내에 내부 및 외부 지질을 완전히 교환합니다. 지질 교환 동역학을 측정하려면 더 빠른(초) 공정과 느린(분) 공정을 캡처하고 동역학 속도 상수를 추출하기 위해 현장 혼합이 필요합니다. 동일한 샘플 환경을 사용하여 지질 나노입자, 단백질, 계면활성제, 폴리머, 에멀젼 또는 무기 나노입자와 같은 다른 유형의 액체 샘플에서 분자 교환을 조사할 수도 있습니다. 나노 스케일의 구조 변형과 교환 또는 반응 시스템의 동역학을 측정하면 나노 스케일에서 진화하는 프로세스에 대한 새로운 통찰력을 얻을 수 있습니다.
Introduction
소각 중성자 산란(SANS)은 ≈1 nm에서 ≈100 nm까지의 길이 척도에서 다양한 물질의 크기, 모양, 상호 작용 및 조직을 측정하는 고유한 방법을 제공합니다 1,2,3. 포커싱 미러가 있는 VSANS(Very Small-Angle Neutron Scattering) 기기를 포함한 최신 기기는 최대 ≈1000nm까지 더 큰 길이의 스케일을 측정하는 데 한계를 뛰어 넘었습니다 4,5. 일반적으로, 중성자 산란 방법에 내재된 독특한 산란 대비는 제약 제형6의 성분 응집,폴리머 시스템에서의 가교 및 겔화 반응7,8, 막 단백질의 메조 결정화(meso crystallization)9,10, 단백질의 분해 및 풀림(11,12)과 같은 나노스케일 구조의 시간 진화를 측정하는 데 있어 몇 가지 이점을 제공한다 및 실리카계 물질의 성장13,14,15. 고유한 산란 대비는 시간 분해 SANS(TR-SANS)를 다른 정지 흐름 기반 측정에 대한 유용한 보완책으로 만듭니다.
정지 흐름 혼합 방법은 종종 소각 X선 산란(SAXS)16,17,18,19,20,21, 형광 분광법 22,23,24,25,26 및 광 산란27,28,29,30, 밀리초 시간 척도에서 운동 과정을 연구하기 위한 31,32개의 실험. SANS와 SAXS의 중요한 차이점은 중성자 산란은 비파괴 특성화 기술이며, 따라서 SANS는 고플럭스 X선 산란 실험 중에 발생할 수 있는 샘플에 대한 이온화 방사선 손상 없이 몇 시간 또는 며칠 동안 동일한 샘플을 측정하는 데 사용할 수 있다는 것입니다(33). 반복적인 SANS 측정은 프로브 분자 또는 샘플의 화학 구조를 변경하지 않기 때문에, 예를 들어 형광에 의존하는 동역학 측정을 복잡하게 만들 수 있는 광표백의 영향 없이 시간 진화를 연구할 수 있습니다23,24. 또한 SANS는 동적 광 산란과 같은 광 기반 기술로 특성화하기 어려운 고농축 및 광학적으로 불투명한 샘플을 측정하는 데 사용할 수 있습니다.
나노 스케일에 대한 구조 정보를 제공하는 것 외에도 SANS는 중성자 산란 길이 밀도 대비의 변화를 통해 이러한 구조의 국소 구성을 조사하는 데 사용할 수 있습니다. 서로 다른 원소의 산란 길이 밀도(SLD)는 주기율표에서 무작위로 변하며 동일한 원소의 동위원소에 따라 다릅니다. 일반적으로 이용되는 예는 수소 (1H 또는 H)와 중수소 (2H 또는 D)이며, 이들은 중성자 산란 길이가 크게 다릅니다. 따라서 계면활성제, 지질, 단백질, RNA, DNA 및 기타 폴리머와 같은 수소가 풍부한 물질은 시스템의 물리적 특성을 크게 변경하지 않고 SANS를 사용하여 중수소화 용매와 구별할 수 있습니다. 그러나 H/D 교환은 시료의 밀도, 수소 결합 및 상전이 온도에 영향을 미칠 수 있다는 점에 유의해야 합니다. 그럼에도 불구하고 수소가 풍부한 물질에 대한 SANS의 고유한 감도는 SAXS와 같은 X선 기반 기술에서 관심 샘플의 산란 대비와 신호가 낮은 연질 물질 연구에 특히 유용합니다. 동위원소 치환은 또한 SANS를 단순히 H-표지 및 D-표지 분자를 혼합함으로써 수소가 풍부한 물질의 분자 교환 역학을 연구하기 위한 강력한 도구로 만듭니다. 동위원소 치환은 부피가 큰 형광 염료가 관심 있는 계면활성제 또는 지질 분자보다 크고 교환 동역학에 영향을 미칠 수 있는 시스템에서 특히 유용합니다34,35.
시간 분해 SANS 측정은 측정된 강도가 시간, 길이 스케일 및 SLD 대비의 함수이기 때문에 유리합니다. 따라서 TR-SANS 실험은 공간 분포 및 샘플 구성의 시간 의존적 변화를 조사하도록 설계할 수 있습니다. SANS의 이러한 고유한 장점은 계면활성제 36,37,38, 에멀 젼39,40,41, 지질 34,42,43,44,45,46,47,48,49와 같은 많은 연질 재료 시스템에서 운동 과정에 대한 중요한 통찰력을 이끌어 냈습니다 , 50, 및 중합체 51,52,53,54,55,56,57,58,59,60,61,62. 대부분의 TR-SANS 연구는 몇 분에서 몇 시간의 시간 척도에 초점을 맞추었습니다. 그러나 관심 있는 많은 운동 과정은 두 번째 시간 척도에서 발생하며 기본 메커니즘을 이해하는 데 필수적입니다. 이러한 초기 시점을 포착하려면 용액을 신속하게 혼합하고 현장에서 측정해야 하며, 여기서 혼합은 정지 흐름 광 산란 27,28,29,30,31,32, 형광 22,23,24,25,26 및 X선 동안 데이터 수집과 동기화됩니다 16,17,18,19,20,21 실험. 이 작업은 여러 액체 샘플을 신속하게 혼합하고 TR-SANS 측정을 위해 혼합물을 석영 유리 셀에 주입하도록 설계된 샘플 환경의 사용에 대해 설명합니다. 혼합 장치는 최근에 개발된 모세관 rheoSANS 장치(63)를 개량한 것으로, 샘플 혼합을 제어하고 세포 세척을 자동화하기 위해 다중 주사기 펌프 및 밸브를 사용한다. 시린지 펌프를 일련의 유량 선택 밸브에 연결하면 여러 흡입구 스트림을 반복적으로 혼합, 측정, 헹굼 및 건조하여 초 단위의 TR-SANS 측정을 용이하게 할 수 있습니다.
현재 절차에서는 관심 샘플이 식별되고 준비되었다고 가정합니다. 현장 믹싱 설정 및 TR-SANS 데이터 수집 방법에 중점을 둡니다. 중성자 산란 데이터는 NIST 중성자 연구 센터(NCNR)의 VSANS 장비에서 수집되었습니다. 그러나 이 절차는 다른 SANS 기기에도 적용할 수 있어야 합니다. 다른 SANS 장비에서 유사한 프로토콜을 구현하는 데 관심이 있는 독자는 현지 장비 과학자와 상의하여 관심 있는 운동 과정과 가장 관련이 있는 원하는 길이 척도 및 시간 척도에서 중성자 플럭스를 최대화하기 위한 최적의 기기 구성을 결정해야 합니다. 여기에 제시된 데이터는 공간 분해능5의 손실에서 중성자 수를 최대화하기 위해 VSANS에서 높은 플럭스 ‘백색 빔’ 구성을 사용하여 수집되었습니다. 검출기 캐리지는 ≈130 nm에서 ≈13 nm의 길이 스케일에 해당하는 0.005 Å-1 < q < 0.5 Å-1 범위의 산란 벡터(q)를 포함하도록 배치되었습니다. 산란 벡터는 q = 4π/λ sin(θ/2)으로 정의되며, 여기서 λ는 중성자 파장이고 θ는 산란 각도입니다.
TR-SANS 측정에 사용되는 정지 흐름 혼합 장치는 그림 1과 같이 여러 펌프, 헹굼 주사기, 샘플 주사기, 유량 선택기, 비동적 믹서, 샘플 셀 및 혼합 샘플 용기로 구성됩니다. 모든 밀봉된 유체 경로는 주사기, 밸브, 연결 튜브, 다이나믹 믹서 및 샘플 셀을 포함하는 에어컨이 설치된 인클로저 내부에 있습니다. 풀그릴 열전 에어 컨디셔너는 ±1 °C 내의 10 °C에서 50 °C에 범위에 있는 울안 온도를 통제하기 위하여 이용됩니다. 장치의 작동 부분을 표시하기 위해 인클로저 단열재 중 일부가 제거되었습니다. 메인 믹싱 장치 인클로저는 NCNR의 NG3 VSANS 빔 라인의 병진 스테이지에 위치합니다. 인클로저 위치는 중성자 빔의 경로(노란색 점선)에 샘플 셀을 배치하기 위해 변환 단계를 사용하여 조정됩니다.

그림 1: NIST Center for Neutron Research의 VSANS 빔라인에서 정지 흐름 혼합 및 소각 중성자 산란 측정을 결합하기 위한 설정 예. 이 설정에는 4개의 주사기 펌프, 용매 헹굼용 주사기 2개, 시료 주입용 주사기 2개, 펌프 선택 밸브 4개, 믹서 선택 밸브 2개, 다이내믹 믹서, 플로우 스루 석영 셀 및 혼합 시료 용기가 포함되어 있습니다. 입사 중성자는 샘플 셀 내부에 위치한 혼합 샘플에서 산란됩니다. 석영 창과 열전 냉방 장치가 있는 절연 인클로저를 사용하여 샘플과 모든 장비를 일정한 온도로 제어합니다. 노란색 점선은 중성자 빔 경로를 나타냅니다. 스케일 바 = 10cm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 1에 표시된 장치는 2개의 샘플 주사기, 2개의 헹굼 주사기 및 1 개의 샘플 셀로 구성됩니다. 프로토콜의 여러 단계에 해당하는 흐름도는 그림 2에 나와 있습니다. 두 개의 서로 다른 샘플의 원하는 부피가 믹서와 샘플 셀에 주입됩니다(그림 2A). 시료 셀이 채워지면 입구 스위치 밸브(ISV)와 출구 스위치 밸브(OSV)가 닫혀 동적 혼합기에서 시료 셀을 분리하고 TR-SANS 데이터 수집 중에 시료가 셀로 역확산되는 것을 방지합니다(그림 2B). 다이나믹 믹서 전에 연결 튜브의 길이는 10cm에서 1m까지 다양하며 혼합 지연 시간에 영향을 미치지 않습니다. 그러나 동적 혼합기와 시료 셀 사이의 튜브 연결은 혼합 지연 시간과 필요한 시료 주입량에 영향을 미칩니다. 내경이 0.04인치(1mm)이고 길이가 100mm인 프리컷 스테인리스강 튜빙은 다이내믹 믹서, 믹서 선택 밸브(MSV1 및 MSV2), ISV 및 OSV를 연결하는 데 사용됩니다. 내경 1mm, 길이 115mm의 불소화 튜브를 사용하여 ISV 및 OSV(또는 동적 혼합기 배출구)를 시료 셀에 연결합니다. 혼합 지연 시간에 영향을 미치는 총 공극 부피에는 혼합기 공극 부피(0.15mL), 혼합기 출구와 시료 셀 주입구 사이의 튜브(0.09mL) 및 시료 셀 부피(0.16mL)가 포함됩니다. 이 예에서 총 공극 부피는 0.4mL입니다. 밸브의 내부 공극 부피는 튜브, 믹서 및 시료 셀 공극 부피에 비해 무시할 수 있습니다. 예를 들어, 사용된 저압 선택 밸브(내경 직경 0.75mm)는 약 4μL의 공극 부피를 포함하는 반면, 고압 선택 밸브 및 스위치 밸브(내경 직경 0.25mm)는 약 0.5μL의 공극 부피를 포함합니다.
TR-SANS 측정이 완료된 후, 시료는 용매와 함께 셀 밖으로 밀려나고, 헹굼 용매는 잔류 시료를 제거하고 시료 셀을 세척하기 위해 셀을 통해 반복적으로 펌핑됩니다(그림 2C). 헹굼 주사기는 펌프 선택기 값을 통해 더 큰 용매 저장소(예: 물 및 에탄올)에 연결되어 측정 실행 사이에 샘플 셀을 세척하는 데 적절한 용매 부피를 사용할 수 있도록 합니다. 용매 공급원, 시료 공급원 및 가연성 액체가 들어 있는 혼합 시료 용기는 가능한 모든 점화원을 제거하기 위해 전기 장비가 없는 별도의 인클로저에 배치됩니다. 또한 증기 잠금 병 뚜껑은 가연성 증기 및 용매 증발을 최소화하는 데 사용됩니다. 마지막으로, 샘플 셀은 질소 가스 스트림으로 건조되어 잔류 헹굼 용매를 제거합니다(그림 2D). 믹서 선택 밸브로의 유입 질소 가스 압력은 질소 가스 실린더에 있는 수동 압력 조절기를 사용하여 약 2bar(0.2MPa, 게이지 압력)로 조절됩니다. 샘플 셀이 충분히 세척되고 건조되면 새로 혼합된 샘플이 다음 측정 주기를 위해 샘플 셀에 주입됩니다( 그림 2A의 흐름도에 설명된 혼합 및 주입 반복).
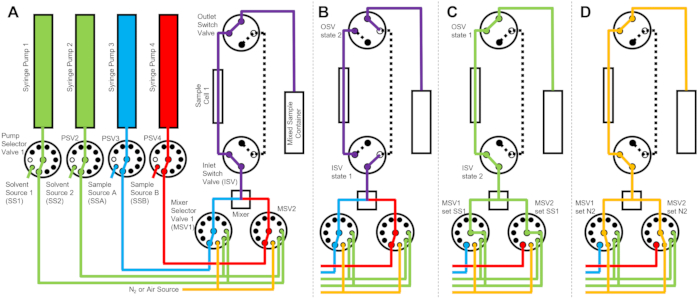
그림 2: 세척을 위해 샘플 셀 1개, 샘플 혼합 2개, 헹굼 용매 2개를 사용한 예시 흐름도. (A) 샘플 A(파란색)와 샘플 B(빨간색)를 혼합한 다음 혼합된 샘플을 샘플 셀에 흘립니다. (B) 데이터 수집 중에 ISV 및 OSV 스위치 밸브가 닫혀 샘플 셀을 분리하고 데이터 수집 중에 샘플의 역확산을 방지하는 정지 흐름 장치 상태. (C) 데이터 수집 후 샘플 셀을 SS1(녹색)의 헹굼 용매로 헹구는 세척 단계. (D) 시료셀을 질소가스(주황색)로 건조시키는 건조단계. 약어: PSV = 펌프 선택 밸브; MSV = 믹서 선택 밸브; OSV = 출구 스위치 밸브; ISV = 입구 스위치 밸브; SS1 = 용매 공급원 1; SSA = 샘플 소스 A; N2 = 질소 가스 공급원. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 3은 혼합 설정이 동일한 스위치 밸브에 연결된 두 개의 개별 샘플 셀로 구성된 약간 다른 버전의 흐름도를 보여줍니다(그림 3A). TR-SANS 데이터가 샘플 셀 1에서 수집되는 동안 샘플 셀 2는 헹구어지고(그림 3B) 건조됩니다(그림 3C). 샘플 셀 1에 대한 데이터 수집이 완료되면 입구 스위치 밸브가 새로 혼합된 샘플을 데이터 수집을 위해 샘플 셀 2로 보냅니다(그림 3D). TR-SANS 데이터가 샘플 셀 2에서 수집되는 동안 샘플 셀 1은 헹구고 건조됩니다(그림 3E). 두 샘플 셀 간의 이러한 교대 병렬 프로세스는 후속 샘플 주입 사이의 시간을 최소화하고 중성자 빔 시간의 사용을 최대화합니다.
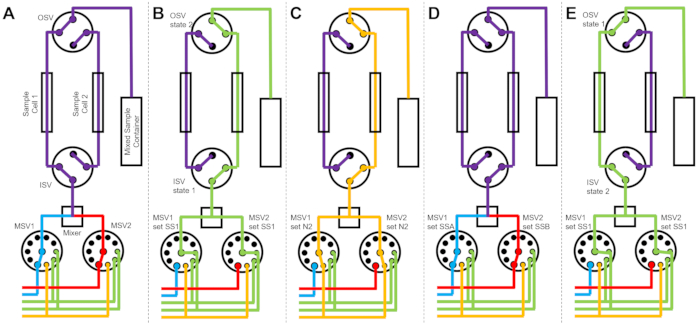
그림 3: 세척을 위해 2개의 시료 셀, 2개의 시료 혼합 및 2개의 헹굼 용매를 사용한 예시 흐름도. (A) 샘플 A(파란색)와 샘플 B(빨간색)를 혼합한 다음 혼합된 샘플을 샘플 셀 1에 흘려보냅니다. (B) 샘플 셀 2가 SS1(녹색)의 용매로 헹구는 동안 샘플 셀 1에서 데이터를 수집하는 동안 흐름이 중지된 장치 상태. (C) 샘플 셀 2가 질소 가스(주황색)로 건조되는 동안 샘플 셀 1에서 데이터를 수집하는 동안 흐름이 중지된 장치 상태. (D) 샘플 셀 1의 데이터 수집이 완료되면 새 샘플(보라색)이 즉시 혼합되어 샘플 셀 2로 유입됩니다. (E) 샘플 셀 1이 SS1(녹색)의 용매로 헹구는 동안 샘플 셀 2에서 데이터를 수집하는 동안 흐름이 중지된 장치 상태. 하나의 샘플 셀을 측정하는 동안 다른 샘플 셀은 세척 및 건조됩니다. 정지된 유량 측정 프로세스는 두 개의 시료 셀을 번갈아 가며 진행되어 후속 시료 혼합 주입 사이의 시간을 최소화합니다. 약어: PSV = 펌프 선택 밸브; MSV = 믹서 선택 밸브; OSV = 출구 스위치 밸브; ISV = 입구 스위치 밸브; SS1 = 용매 공급원 1; SSA = 샘플 소스 A; N2 = 질소 가스 공급원. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
펌프와 튜빙 라인을 연결하고, 시스템을 프라이밍하고, 샘플 셀을 헹구고 건조하고, 혼합된 샘플을 주입하기 위한 단계별 프로토콜이 아래에 설명되어 있습니다. 단일 셀 구성은 단순성을 위해 시연되었지만(그림 2), 유연한 모듈식 설정, 프로토콜 및 스크립트를 쉽게 수정하여 더 많은 시린지 펌프, 밸브, 믹서 또는 샘플 셀 구성(예: 그림 3에 표시된 2개 샘플 셀 구성)을 구현할 수 있습니다. 혼합 및 세척 주입 주기 전반에 걸쳐 수집된 대표적인 원시 중성자 계수율 데이터는 그림 4에 나와 있으며, 3가지 다른 온도에서 측정된 지질 교환 역학과 교환된 지질 분율에 해당하는 추출된 정규화된 산란 강도는 각각 그림 5 및 그림 6에 나와 있습니다.
Protocol
Representative Results
Discussion
현재 절차에서는 혼합 장치 및 정지 흐름 TR-SANS 측정을 수행하는 단계에 대해 설명합니다. 이 장치 및 프로토콜은 관심 시간 척도가 ≈1초에서 5분인 저점도 액체 샘플에 최적화되어 있습니다. 5분 이상의 시간 척도의 경우, 특히 고점도 샘플, 젤 또는 페이스트의 경우 샘플을 수동으로 혼합하고 표준 산란 셀에 로드하는 것이 더 쉽고 바람직할 수 있습니다. 1초 미만의 시간 척도에 액세스하려면 지…
Declarações
The authors have nothing to disclose.
Acknowledgements
NG3 VSANS에 대한 액세스는 계약 번호 DMR-2010792에 따라 미국 국립표준기술연구소(National Institute of Standards and Technology)와 국립과학재단(National Science Foundation) 간의 파트너십인 고분해능 중성자 산란 센터(Center for High-Resolution Neutron Scattering)에서 제공했습니다. M.H.L.N은 Mitacs Globalink(캐나다)가 제공한 자금을 인정합니다. 상업용 제품 또는 상호의 식별은 이해를 돕기 위한 것이며 미국 국립표준기술연구소(NIST)의 보증 또는 추천을 의미하지 않습니다.
Materials
| Dynamic mixer | Analytical Scientific Instruments | 462-0150A | Magnetically coupled rotor, binary dynamic mixer assembly (ternary type available), 0.15 mL dead volume (larger dead volume available) |
| Fluoropolymer tubing | IDEX Health & Science | 1507L | PFA Tubing Natural 1/16 inch OD x 0.040 inch ID x 50 ft |
| Fluoropolymer 1/4-28 flangeless fittings | IDEX Health & Science | XP-245 | PFA flangeless fitting with ferrules, 1/4-28 threading, 1/16 inch OD tubing |
| Glass syringes | Hamilton Company | 81660 | Hamilton 1000 series syringes, 10 mL (81660), model 1010 C syr, 1/4"-28 thread termination, other volumes available |
| High-pressure flow selector valves | Vici Valco | C85X-1570EUTB | Vici 10 position selector valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure switch valves | Vici Valco | C82X-1574EUHB | Vici 4 port switch valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure syringes | Cetoni | A2019000358 | 3 mL stainless steel syringe, 510 bar max, 21 mL/min flow rate max |
| Low-pressure flow selector valves | Vici Valco | C25-3180EUHB | Vici 10 position selector valves, max 250 psi liquid, 0.75 mm bore, 1/16 inch OD tubing, 1/4-28 threaded ports, USB universal actuator |
| neMESYS high-pressure syringe pumps | Cetoni | A3921000103 | Max force 2600 N |
| neMESYS mid-pressure syringe pumps | Cetoni | A3921000131 | Max force 1000 N |
| Power supply | Cetoni | A3921000127 | Base 600, supplies power for up to 4 high pressure pumps |
| Quartz flow-through sample cell | Starna Scientific | 3-2.30-Q-1/TC | Quartz micro flow cells, 2 mm path length (1 mm available), 2 mm by 2 mm by 30 mm internal dimension |
| Quartz windows | Technical Glass Products | NA | GE 124 Clear fused quartz ground and polished plates, 11.75 inch by 23.75 inch by 0.375 inch thick |
| Stainless steel 10-32 coned compression fittings | IDEX Health & Science | U-321X, U-320X | 316 stainless steel ferrule (U-321X) and nut (U-320X) -Valco type, 10-32 coned, for 1/16 inch OD stainless steel tubing |
| Stainless steel tubing | IDEX Health & Science | U-102 | Stainless Steel Tubing 1/16 inch OD x 0.020 inch ID, 10 cm, various precut lengths available |
| Syringe pump control software | Cetoni | T6000000004 | QmixElements software for nemesys pumps, QmixSDK software development kit |
| Thermoelectric air conditioner | EIC Solutions | AAC-140C-4XT-HC | Thermoelectric air conditioner mounted on insulated enclosure to control the pump, valve, mixer, and sample temperature |
| T-slot railing | McMaster-Carr | 47065T103 | Aluminum t-slotted railing (1.5 inch by 1.5 inch) cut to various lengths |
| Vapor locking bottle caps | Cole-Parmer | EW-12018-02 | Four 304 SS port inserts, 1/4"-28 threads, GL45 bottle cap size, PTFE body, SS threads, PP collar |
Referências
- Melnichenko, Y. B., Wignall, G. D. Small-angle neutron scattering in materials science: Recent practical applications. Journal of Applied Physics. 102 (2), 021101 (2007).
- Grillo, I., Borsali, R., Pecora, R. Small-angle neutron scattering and applications in soft condensed matter. Soft Matter Characterization. , (2008).
- Hollamby, M. J. Practical applications of small-angle neutron scattering. Physical Chemistry Chemical Physics. 15 (26), 10566-10579 (2013).
- Pipich, V., Fu, Z. KWS-3: Very small angle diffractor with focusing mirror. Journal of large-scale research. 1, 31 (2015).
- Barker, J. G., Kline, S., et al. . 2019 NCNR Annual Report, Special Publication (NIST SP). , (2019).
- Gilbert, P. H., et al. Preservative induced polysorbate 80 micelle aggregation. Journal of Pharmaceutical Sciences. 10 (6), 2395-2404 (2021).
- Terashima, T., et al. In situ and time-resolved small-angle neutron scattering observation of star polymer formation via arm-linking reaction in ruthenium-catalyzed living radical polymerization. Macromolecules. 43 (19), 8218-8232 (2010).
- Hashimoto, K., Fujii, K., Nishi, K., Shibayama, M. Ion gel network formation in an ionic liquid studied by time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 122 (40), 9419-9424 (2018).
- Conn, C. E., et al. Membrane protein structures in lipid bilayers; small-Angle neutron scattering with contrast-matched bicontinuous cubic phases. Frontiers in Chemistry. 8, 619470 (2021).
- van’t Hag, L., et al. Protein-eye view of the in meso crystallization mechanism. Langmuir. 35 (25), 8344-8356 (2019).
- Mahieu, E., et al. Observing protein degradation by the PAN-20S proteasome by time-resolved neutron scattering. Biophysical Journal. 119 (2), 375-388 (2020).
- Ibrahim, Z., et al. Time-resolved neutron scattering provides new insight into protein substrate processing by a AAA+ unfoldase. Scientific Reports. 7 (1), 40948 (2017).
- Hollamby, M. J., et al. Growth of mesoporous silica nanoparticles monitored by time-resolved small-angle neutron scattering. Langmuir. 28 (9), 4425-4433 (2012).
- Blin, J. L., Impéror-Clerc, M. Mechanism of self-assembly in the synthesis of silica mesoporous materials: in situ studies by X-ray and neutron scattering. Chemical Society Reviews. 42 (9), 4071-4082 (2013).
- Impéror-Clerc, M., Grillo, I., Khodakov, A. Y., Durand, D., Zholobenko, V. L. New insights into the initial steps of the formation of SBA-15 materials: an in situ small angle neutron scattering investigation. Chemical Communications. 8, 834-836 (2007).
- Narayanan, T., Rüter, A., Olsson, U. SAXS/WAXS investigation of amyloid-β(16-22) peptide nanotubes. Frontiers in Bioengineering and Biotechnology. 9, 654349 (2021).
- Angelov, B., et al. DNA/Fusogenic lipid nanocarrier assembly: millisecond structural dynamics. The Journal of Physical Chemistry Letters. 4 (11), 1959-1964 (2013).
- Amann, M., et al. Kinetic pathways for polyelectrolyte coacervate micelle formation revealed by time-resolved synchrotron SAXS. Macromolecules. 52 (21), 8227 (2019).
- Varga, Z., Wacha, A., Bóta, A. Osmotic shrinkage of sterically stabilized liposomes as revealed by time-resolved small-angle X-ray scattering. Journal of Applied Crystallography. 47 (1), 35-40 (2014).
- Panine, P., Finet, S., Weiss, T. M., Narayanan, T. Probing fast kinetics in complex fluids by combined rapid mixing and small-angle X-ray scattering. Advances in Colloid and Interface Science. 127 (1), 9-18 (2006).
- Grillo, I. Applications of stopped-flow in SAXS and SANS. Current Opinion in Colloid & Interface Science. 14 (6), 402-408 (2009).
- Gomez-Hens, A., Perez-Bendito, D. The stopped-flow technique in analytical chemistry. Analytica Chimica Acta. 242, 147-177 (1991).
- Patel, J. T., Belsham, H. R., Rathbone, A. J., Friel, C. T. Use of stopped-flow fluorescence and labeled nucleotides to analyze the ATP turnover cycle of kinesins. Journal of Visualized Experiments: JoVE. (92), e52142 (2014).
- Biro, F. N., Zhai, J., Doucette, C. W., Hingorani, M. M. Application of stopped-flow kinetics methods to investigate the mechanism of action of a DNA repair protein. Journal of Visualized Experiments: JoVE. (37), e1874 (2010).
- Raney, K. D., Sowers, L. C., Millar, D. P., Benkovic, S. J. A fluorescence-based assay for monitoring helicase activity. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6644-6648 (1994).
- Roder, H., Maki, K., Cheng, H. Early events in protein folding explored by rapid mixing methods. Chemical reviews. 106 (5), 1836-1861 (2006).
- Milon, A., et al. Osmotic swelling of unilamellar vesicles by the stopped-flow light scattering method. Influence of vesicle size, solute, temperature, cholesterol and three α,ω-dihydroxycarotenoids. Biochimica et Biophysica Acta (BBA) – Biomembranes. 859 (1), 1-9 (1986).
- Gast, K., Nöppert, A., Müller-Frohne, M., Zirwer, D., Damaschun, G. Stopped-flow dynamic light scattering as a method to monitor compaction during protein folding. European Biophysics Journal. 25 (3), 211-219 (1997).
- Antoun, A., Pavlov, M. Y., Tenson, T., Ehrenberg, M. M. Ribosome formation from subunits studied by stopped-flow and Rayleigh light scattering. Biological Procedures Online. 6, 35-54 (2004).
- Zhu, Z., Armes, S. P., Liu, S. pH-Induced micellization kinetics of ABC triblock copolymers measured by stopped-flow light scattering. Macromolecules. 38 (23), 9803-9812 (2005).
- Ye, J., et al. Comparative study of temperature-induced association of cyclic and linear poly(N-isopropylacrylamide) chains in dilute solutions by laser light scattering and stopped-flow temperature jump. Macromolecules. 41 (12), 4416-4422 (2008).
- Liu, X., et al. Early stage kinetics of polyelectrolyte complex coacervation monitored through stopped-flow light scattering. Soft Matter. 12 (44), 9030-9038 (2016).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26 (4), 907-911 (2019).
- Garg, S., Porcar, L., Woodka, A. C., Butler, P. D., Perez-Salas, U. Noninvasive neutron scattering measurements reveal slower cholesterol transport in model lipid membranes. Biophysical Journal. 101 (2), 370-377 (2011).
- Marquardt, D., et al. 1H NMR shows slow phospholipid flip-flop in gel and fluid bilayers. Langmuir. 33 (15), 3731-3741 (2017).
- Egelhaaf, S. U., Olsson, U., Schurtenberger, P. Time-resolved SANS for surfactant phase transitions. Physica B: Condensed Matter. 276-278, 326-329 (2000).
- Tabor, R. F., Eastoe, J., Grillo, I. Time-resolved small-angle neutron scattering as a lamellar phase evolves into a microemulsion. Soft Matter. 5 (10), 2125-2129 (2009).
- Gradzielski, M., Bergmeier, M., Hoffmann, H., Müller, M., Grillo, I. Vesicle gel formed by a self-organization process. The Journal of Physical Chemistry B. 104 (49), 11594-11597 (2000).
- Lee, Y. -. T., Li, D. S., Pozzo, L. D. Kinetic analysis of ultrasound-induced oil exchange in oil-in-water emulsions through contrast variation time-resolved small-sngle neutron scattering. Langmuir. 35 (47), 15204-15213 (2019).
- Lee, Y. -. T., Pozzo, L. D. Contrast-variation time-resolved small-angle neutron scattering analysis of oil-exchange kinetics between oil-in-water emulsions stabilized by anionic surfactants. Langmuir. 35 (47), 15192-15203 (2019).
- Roger, K., Olsson, U., Schweins, R., Cabane, B. Emulsion ripening through molecular exchange at droplet contacts. Angewandte Chemie International Edition. 54 (5), 1452-1455 (2015).
- Nakano, M., Fukuda, M., Kudo, T., Endo, H., Handa, T. Determination of Interbilayer and Transbilayer Lipid Transfers by Time-Resolved Small-Angle Neutron Scattering. Physical Review Letters. 98 (23), 238101 (2007).
- Nakano, M., et al. Flip-flop of phospholipids in vesicles: kinetic analysis with time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 113 (19), 6745-6748 (2009).
- Nguyen, M. H. L., et al. Methanol accelerates DMPC flip-flop and transfer: A SANS study on lipid dynamics. Biophysical Journal. 116 (5), 755-759 (2019).
- Nguyen, M. H. L., et al. Peptide-induced Lipid flip-flop in asymmetric liposomes measured by small angle neutron scattering. Langmuir. 35 (36), 11735-11744 (2019).
- Nguyen, M. H. L., et al. Time-resolved SANS reveals pore-forming peptides cause rapid lipid reorganization. New Journal of Chemistry. 45 (1), 447-456 (2021).
- Xia, Y., et al. Effects of nanoparticle morphology and acyl chain length on spontaneous lipid transfer rates. Langmuir. 31 (47), 12920-12928 (2015).
- Xia, Y., et al. Morphology-induced defects enhance lipid transfer rates. Langmuir. 32 (38), 9757-9764 (2016).
- Maric, S., et al. Time-resolved small-angle neutron scattering as a probe for the dynamics of lipid exchange between human lipoproteins and naturally derived membranes. Scientific Reports. 9 (1), 7591 (2019).
- Nielsen, J. E., Bjørnestad, V. A., Pipich, V., Jenssen, H., Lund, R. Beyond structural models for the mode of action: How natural antimicrobial peptides affect lipid transport. Journal of Colloid and Interface Science. 582, 793-802 (2021).
- Willner, L., Poppe, A., Allgaier, J., Mokenbusch, M., Richter, D. TIme-resolved SANS for the determintioan of unimer exchange kinetics in block copolymer micelles. Europhysics Letters. 55 (5), 667 (2001).
- Lund, R., Willner, L., Stellbrink, J., Lindner, P., Richter, D. Logarithmic chain-exchange kinetics of diblock copolymer micelles. Physical Review Letters. 96 (6), 068302 (2006).
- Lund, R., Willner, L., Richter, D., Dormidontova, E. E. Equilibrium chain exchange kinetics of diblock copolymer micelles: Tuning and logarithmic relaxation. Macromolecules. 39 (13), 4566-4575 (2006).
- Lund, R., Willner, L., Richter, D., Abe, A., Lee, K. S., Leibler, L., Kobayashi, S. Kinetics of block copolymer micelles studied by small-angle scattering methods. in Controlled Polymerization and Polymeric Structures. Advances in Polymer Science. , 51 (2013).
- Choi, S. -. H., Lodge, T. P., Bates, F. S. Mechanism of molecular exchange in diblock copolymer micelles: hypersensitivity to core chain length. Physical Review Letters. 104 (4), 047802 (2010).
- Choi, S. -. H., Bates, F. S., Lodge, T. P. Molecular exchange in ordered diblock copolymer micelles. Macromolecules. 44 (9), 3594-3604 (2011).
- Lu, J., Bates, F. S., Lodge, T. P. Chain exchange in binary copolymer micelles at equilibrium: confirmation of the independent chain hypothesis. ACS Macro Letters. 2 (5), 451-455 (2013).
- Lu, J., Bates, F. S., Lodge, T. P. Remarkable effect of molecular architecture on chain exchange in triblock copolymer micelles. Macromolecules. 48 (8), 2667-2676 (2015).
- Kelley, E. G., et al. Size evolution of highly amphiphilic macromolecular solution assemblies via a distinct bimodal pathway. Nature Communications. 5 (1), 3599 (2014).
- Murphy, R. P., Kelley, E. G., Rogers, S. A., Sullivan, M. O., Epps, T. H. Unlocking chain exchange in highly amphiphilic block polymer micellar systems: influence of agitation. ACS Macro Letters. 3 (11), 1106-1111 (2014).
- Schantz, A. B., et al. PEE-PEO block copolymer exchange rate between mixed micelles is detergent and temperature activated. Macromolecules. 50 (6), 2484-2494 (2017).
- Lantz, K. A., et al. Cavitation enables switchable and rapid block polymer exchange under high-χN conditions. Macromolecules. 51 (17), 6967-6975 (2018).
- Murphy, R. P., et al. Capillary RheoSANS: measuring the rheology and nanostructure of complex fluids at high shear rates. Soft Matter. 16 (27), 6285-6293 (2020).
- Stopped Flow Sans. usnistgov Available from: https://github.com/usnistgov/stopped-flow-sans (2021)
- Kline, S. Reduction and analysis of SANS and USANS data using IGOR Pro. Journal of Applied Crystallography. 39 (6), 895-900 (2006).
- Doktorova, M., et al. Preparation of asymmetric phospholipid vesicles for use as cell membrane models. Nature Protocols. 13 (9), 2086-2101 (2018).
- Huang, Z., London, E. Effect of cyclodextrin and membrane lipid structure upon cyclodextrin-lipid interaction. Langmuir. 29 (47), 14631-14638 (2013).
- Sugiura, T., Ikeda, K., Nakano, M. Kinetic analysis of the methyl-β-cyclodextrin-mediated intervesicular transfer of pyrene-labeled phospholipids. Langmuir. 32 (51), 13697-13705 (2016).
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Dicko, C., et al. NUrF-Optimization of in situ UV-vis and fluorescence and autonomous characterization techniques with small-angle neutron scattering instrumentation. Review of Scientific Instruments. 91 (7), 075111 (2020).

