Respirometrie met hoge resolutie om bio-energetica in cellen en weefsels te beoordelen met behulp van respirometers op basis van kamer en platen
Summary
Het beoordelen van oxidatieve fosforylering met behulp van respirometers met hoge resolutie is een integraal onderdeel geworden van de functionele analyse van mitochondriën en cellulair energiemetabolisme. Hier presenteren we protocollen voor de analyse van cellulair energiemetabolisme met behulp van kamer- en microplaatgebaseerde respirometers met hoge resolutie en bespreken we de belangrijkste voordelen van elk apparaat.
Abstract
Hoge resolutie respirometrie (HRR) maakt het mogelijk om oxidatieve fosforylering in realtime te monitoren voor analyse van individuele cellulaire energietoestanden en beoordeling van ademhalingscomplexen met behulp van gediversifieerde substrate-uncoupler-inhibitor titratie (SUIT) protocollen. Hier wordt het gebruik van twee respirometrie-apparaten met hoge resolutie gedemonstreerd en wordt een basisverzameling protocollen gepresenteerd die van toepassing zijn op de analyse van gekweekte cellen, skelet- en hartspiervezels en zachte weefsels zoals de hersenen en de lever. Protocollen voor gekweekte cellen en weefsels zijn voorzien voor een kamergebaseerde respirometer en gekweekte cellen voor een op microplaten gebaseerde respirometer, beide met standaard ademhalingsprotocollen. Voor vergelijkende doeleinden worden CRISPR-gemanipuleerde HEK293-cellen met een tekort aan mitochondriale translatie die meerdere deficiënties van het ademhalingssysteem veroorzaken, met beide apparaten gebruikt om cellulaire defecten in de ademhaling aan te tonen. Beide respirometers maken een uitgebreide meting van cellulaire ademhaling mogelijk met hun respectieve technische verdiensten en geschiktheid, afhankelijk van de onderzoeksvraag en het model dat wordt bestudeerd.
Introduction
Mitochondriën vervullen de belangrijkste energievoorziening en zijn een gecompartimenteerd organel dat bijdraagt aan essentiële cellulaire bio-energetische en metabole processen zoals anabolisme van nucleotiden, lipiden en aminozuren, ijzer-zwavelclusterbiogenese en zijn betrokken bij signalering zoals gecontroleerde celdood 1,2,3 . Mitochondriale bio-energetica door oxidatieve fosforylering draagt bij aan bijna alle cellulaire processen in de cel, en bijgevolg worden mitochondriale disfuncties van primaire of secundaire oorsprong geassocieerd met een breed spectrum van ziekteomstandigheden 4,5. Mitochondriale disfunctie omvat niet alleen veranderingen in structuur of mitochondriale dichtheid, maar ook in de kwaliteit en regulatie van het ademhalingssysteem6. Dit kwalitatieve element omvat substraatcontrole, koppelingskarakteristieken, posttranslationele modificaties, cristaedynamica en respiratoire supercomplexen 7,8. Daarom is een nauwkeurige analyse van mitochondriale bio-energetica voor experimentele en diagnostische benaderingen om het energiemetabolisme van de cel te beoordelen belangrijk voor gezondheid en ziekte.
Mitochondriale oxidatieve fosforylering (OXPHOS) is een opeenvolging van reacties binnen het ademhalingssysteem of elektronenoverdrachtsysteem (ETS) voor de opwekking van cellulaire energie via adenosinetrifosfaat (ATP)9. De multi-enzymatische stap om energie uit elektronenstroom door complexen I en II naar complex IV te benutten, genereert een elektrochemische protongradiënt over het binnenste mitochondriale membraan, vervolgens gebruikt voor fosforylering van adenosinedifosfaat (ADP) naar ATP via complex V (F1FO ATP-synthase) (figuur 1A).
Ten eerste worden twee-elektronendragers gegenereerd tijdens de tricarbonzuurcyclus (TCA), glycolyse en pyruvaatoxidatie: nicotinamide adenine dinucleotide (NADH) en dihydroflavine adenine dinucleotide (FADH2). NADH wordt geoxideerd bij complex I (NADH-dehydrogenase), waarbij twee elektronen worden overgebracht naar co-enzym Q (chinon wordt gereduceerd tot quinol), terwijl protonen in de intermembraanruimte (IMS) worden gepompt. Ten tweede oxideert complex II (Succinaatdehydrogenase) FADH2 en voedt de elektronen naar co-enzym Q zonder protonen te pompen. Ten derde worden bij complex III (Cytochroom c oxidoreductase) elektronen uit co-enzym Q overgebracht naar cytochroom c, terwijl protonen in het IMS worden gepompt. Ten vierde brengt cytochroom c de elektronen over naar complex IV (Cytochroom c-oxidase), het laatste complex om protonen te pompen, en waar zuurstof functioneert als een elektronenacceptor om protonen te assimileren en uiteindelijk water te vormen. Het is deze zuurstof die mitochondriën verbruiken die kan worden gemeten door een oxygraaf. Ten slotte worden de protonen gegenereerd uit complex I, complex III en complex IV gebruikt om complex V te roteren, waardoor ATP 9 wordtgegenereerd.
Belangrijk is dat elektronenoverdracht niet alleen op een lineaire manier plaatsvindt, anders aangeduid als de elektronentransportketen. In plaats daarvan kunnen elektronen via meerdere ademhalingswegen naar de co-enzym Q-pool worden overgebracht en convergente elektronenstroom vergemakkelijken. NADH-substraten en succinaat kunnen bijvoorbeeld binnenkomen via respectievelijk complex I en complex II. Elektronen uit vetzuuroxidatie kunnen worden gedoneerd via het elektronoverdrachtsflavoproteïnecomplex. Een uitgebreide analyse van OXPHOS vereist inderdaad een holistische benadering met geschikte brandstofsubstraten (figuur 1A).
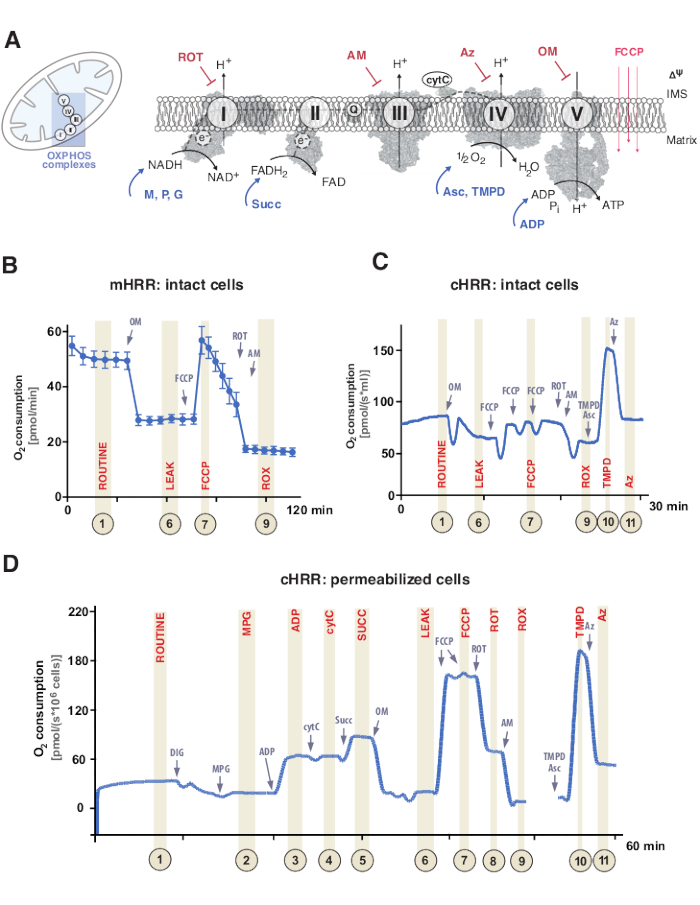
Figuur 1: Mitochondriale oxidatieve fosforylering en specifieke substraat- en inhibitorprotocollen. (A) Mitochondrion en schema van het elektronenoverdrachtssysteem (CI-CIV) en mitochondriaal F1F0 ATP-synthase (CV). Alle structuren zijn afkomstig van PDB. De cijfers tonen alleen substraten en remmers die in dit onderzoek worden beschreven). (B) Monsterspoor van zuurstofflux in intacte HEK293-cellen met behulp van het standaardprotocol in een mHRR-apparaat. (C) Monsterspoor van zuurstofflux in intacte HEK293-cellen met behulp van een standaardprotocol in een cHRR-apparaat. (D) Monsterspoor van zuurstofflux in gepermeabiliseerde menselijke fibroblasten van een gezonde donor met het respectieve SUIT-protocol. Afkortingen: 1 = Routinematige ademhaling van intacte cellen; 2 = toestand 2; 3 = toestand 3(I); 4 = Toestand 3(I) met cytC; 5 = toestand 3 (I+II); 6 = Lek(OM); 7 = ETS-capaciteit; 8 = S(ROT); 9 = ROX; 10 = TMPD; 11 = Az. ROT = Rotenon, AM = Antimycine, ATP = Adenosinetrifosfaat, Az = Azide, OM = Oligomycine, FCCP = Carbonylcyanide p-trifluoro-methoxyfenyl-hydrazone; Asc = Ascorbaat, TMPD = N,N,N′,N′-tetramethyl-p-fenyleendiamine, Succ = Succinaat, M = Malaat, P = Pyruvaat, ADP = Adenosinedifosfaat, NAD = Nicotinamide adenine dinucleotide, IMS = Intermembrane ruimte, FAD = Flavin adenine dinucleotide. Klik hier om een grotere versie van deze figuur te bekijken.
Analyse van mitochondriale OXPHOS-capaciteit met behulp van HRR is een instrumentele biochemische methode van diagnostische waarde geworden, niet alleen voor primaire mitochondriale defecten10,11, maar ook uitbreidend naar alle andere gebieden van de biologie, zoals kanker en veroudering12. HRR maakt de bepaling van cellulaire ademhaling mogelijk door de analyse van mitochondriale OXPHOS-capaciteit, die direct individuele of gecombineerde mitochondriale respiratoire complexe deficiëntie weerspiegelt, en indirect geassocieerd is met cellulaire disfunctie en veranderd energiemetabolisme9. Methodologisch worden ademhalingsmetingen uitgevoerd met behulp van cellen, weefsel of geïsoleerde mitochondriën 11,13,14, met bevroren materiaal dat slechts gedeeltelijk geschikt is 15,16. Bevroren weefsel blijkt een intact ETS te hebben met behoud van supercomplexe stabiliteit15. In tegenstelling tot traditionele TCA-tussenproducten worden de respectieve substraten dus rechtstreeks in het ETS ingevoerd. De koppeling tussen de ETS- en ATP-synthese gaat echter verloren omdat de membraanintegriteit wordt aangetast door bevriezingsschade (ijskristalvorming).
Ademhalingsexperimenten vinden normaal gesproken plaats bij een fysiologische temperatuur van 37 °C voor endothermen in niet-permeabiliseerde of permeabiliseerde cellen of weefsel. Terwijl de eerste de cytosolische metabole context beschouwt, levert de laatste de energetische bijdrage van individuele OXPHOS-complexen en de ATPase door de toevoeging van specifieke substraten (en remmers). De sequentie en variatie van substraten en remmers hebben geleid tot de ontwikkeling van een breed scala aan SUIT-protocollen17 en assays18 om verschillende wetenschappelijke vragen over de OXPHOS-functie aan te pakken (beoordeeld onder12). Het basisprotocol van cellulaire ademhaling beoordeelt vier verschillende toestanden: i) routinematige ademhaling – de ademhaling in een respectievelijk ademhalingsmedium zonder toevoeging van substraten of remmers die maar endogene substraten consumeren. Deze toestand kan algemene OXPHOS of secundair geïnduceerde ademhalingsdefecten onthullen die bijvoorbeeld worden veroorzaakt door veranderde metabolietprofielen. Vervolgens onthult de toevoeging van de ATPase-remmer oligomycine de permeabiliteit van het binnenste mitochondriale membraan voor protonen, gedefinieerd als ii) lekademhaling. Daaropvolgende titratie van een protonofoor zoals de ontkoppelaar carbonylcyanide p-trifluor-methoxyfenyl-hydrazone (FCCP) maakt het mogelijk om de toestand te bepalen waarin de ETS-capaciteit maximaal is in een open-transmembraan protoncircuitmodus, gedefinieerd als iii) ontkoppelde ademhaling. Belangrijk is dat een ontkoppelde toestand ook kan optreden door experimentele interventies door overmatige mechanische schade aan de mitochondriale membranen. Omgekeerd verwijst de niet-gekoppelde toestand naar respiratoire ontkoppeling door een intrinsiek mechanisme dat fysiologisch wordt gecontroleerd. Ten slotte bepaalt volledige remming van het ETS door toevoeging van de complexe III-remmer antimycine en complexe I-remmer rotenon het resterende zuurstofverbruik (ROX) van niet-mitochondriale zuurstofverbruikende processen (figuur 1A-C).
Mitochondriale bio-energetica bestaat uit vijf verschillende ademhalingstoestanden19,20. Toestand 1 ademhaling is zonder extra substraten of ADP, behalve wat endogeen beschikbaar is. Na de toevoeging van ADP, maar nog steeds geen substraten, wordt toestand 2 ademhaling bereikt. Wanneer substraten worden toegevoegd, waardoor elektronenoverdracht en ATP-synthese mogelijk zijn, wordt toestand 3-ademhaling bereikt. In deze toestand kan OXPHOS-capaciteit worden gedefinieerd bij verzadigde concentraties van ADP, anorganisch fosfaat, zuurstof, NADH- en succinaatgebonden substraten. Toestand 4 ademhaling of LEAK ademhaling kan worden gedefinieerd als een toestand zonder ADP of chemisch geremde ATP-synthasen met voldoende substraten. Ten slotte, wanneer alle zuurstof is uitgeput (anoxisch) in een gesloten kamer, wordt toestand 5 ademhaling waargenomen.
Er bestaan verschillende methoden om cellulaireenergietoestanden 14 te beoordelen met twee apparaten die de huidige real-time beoordeling van OXPHOS domineren door analyse van het zuurstofverbruik, gemeten als de functie van de afname van zuurstof in de loop van de tijd in een gesloten kamersysteem met verschillende toepasbaarheid afhankelijk van het experimentele model en de onderzoeksvraag: de Oroboros 2k hoge resolutie respirometer en de Seahorse XF extracellulaire flux analyzer. Beide apparaten registreren het zuurstofverbruik als een afname van picomol (pmol) van zuurstof (O2) per seconde als een absolute waarde in de kamer of microplaatput. Het specifieke zuurstofverbruik per massa wordt verkregen door het respectieve zuurstofverbruik te normaliseren in een specifiek bufferrecept per aantal cellen (miljoenen), weefselgewicht (mg) of eiwithoeveelheid.
De O2k (Oroboros Instruments) is een gesloten tweekamersysteem uitgerust met een polarografische zuurstofsensor (afgekort als kamergebaseerde hoge resolutie respirometer: cHRR). Elke experimentele kamer bevat 2 ml vloeistof die homogeen wordt gehouden door magnetische roerders. De polarografische zuurstofsensor maakt gebruik van een amperometrische benadering om de zuurstof te meten: het bevat een gouden kathode, een zilver / zilverchloride-anode en tussendoor een KCI-oplossing die een elektrochemische cel creëert waarop een spanning (0,8 V) wordt toegepast. Zuurstof uit het testmedium diffundeert door een gefluoreerd ethyleenpropyleenmembraan van 25 μm (O 2-permeabel) en ondergaat reductie aan de kathode, waardoor waterstofperoxide wordt geproduceerd. Aan de anode wordt zilver geoxideerd door waterstofperoxide, waardoor een elektrische stroom wordt gegenereerd. Deze elektrische stroom (ampère) is lineair gerelateerd aan de partiële zuurstofdruk. De partiële druk van zuurstof en de zuurstofoplosbaarheidsfactor van het testmedium worden gebruikt om de zuurstofconcentratie te berekenen. Aangezien de partiële zuurstofdruk afhankelijk is van de experimentele temperatuur en polarografische metingen temperatuurgevoelig zijn, moeten temperatuurschommelingen nauwkeurig (±0,002 °C) worden geregeld door een Peltier-verwarmingsblok. De temperatuur kan worden geregeld binnen een bereik van 4 °C en 47 °C.
De Seahorse XF extracellulaire flux analyzer (Agilent) is een op platen gebaseerd systeem met 24- of 96-well microplaatformaat waarin drie fluorescentie-elektroden het zuurstofverbruik in de loop van de tijd in elke put meten (afgekort als microplaatgebaseerde hoge resolutie respirometer: mHRR). Er zijn maximaal vier poorten in de testcartridge beschikbaar voor geautomatiseerde injectie tijdens de test. Een test bevat meerdere cycli, elk met drie fasen: 1) mengen, 2) wachten en 3) meten. Tijdens de meetfase worden sensorsondes in de microplaat neergelaten, waardoor een tijdelijk gesloten kamer ontstaat met een volume van 7-10 μL om het uitgestraalde licht te meten. Dit licht wordt uitgezonden door polymeer-ingebedde fluoroforen op de punt van de sensorsondes, die O2 detecteren op basis van fosforescentie-doven. De intensiteit van het fluorescentiesignaal is evenredig met O2 en wordt beïnvloed door de temperatuur van de sensor en het testmedium. Daarom vereist nauwkeurige zuurstofschatting een relatieve benadering met een achtergrondput zonder monster. Het herstellen van de zuurstofconcentratie vindt plaats tijdens de mengfase wanneer de sensor op en neer beweegt om het volume boven de tijdelijke kamer te mengen. Elke cyclus berekent één zuurstofverbruik. De temperatuur kan worden geregeld binnen een bereik van 16 °C en 42 °C.
HRR is de gouden standaard om cellulaire bio-energetica te beoordelen bij primaire en mitochondriën-geassocieerde ziekten en algemeen cellulair metabolisme. In deze studie worden basisprotocollen voor HRR gegeven om de OXPHOS-functie in cellen en weefsels te beoordelen.
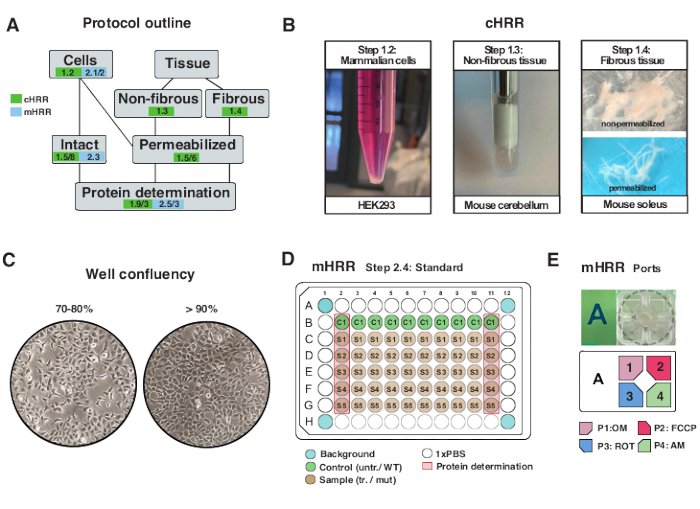
Figuur 2: Workflow voor cel- en weefselpreparaten voor cHRR en celvoorbereiding voor mHRR-respirometrie. (A) Overzicht van verstrekte protocollen. (B) Zoogdiercellen (stap 1.2): HEK293-pellet gelijk aan 3 x 106 cellen (linkerpaneel). Niet-vezelig weefsel (stap 1.3): Bereiding van murine cerebellum lysaat in 2 ml teflon potter (middenpaneel). Saponine-geïnduceerde skeletspierpermeabilisatie (stap 1.4) rechterpaneel) voor cHRR-respirometrie. (C) Standaard lay-out voor het zaaien van microplaten (stap 2.4) en de samenvloeiingscontrole voor de analyse van eukaryote cellen (HEK293) voor mHRR-respirometrie. (D, E) Schema van injectiepoortbelasting voor mHRR-respirometrie (stap 2.4). Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Traditioneel is mitochondriale bio-energetica bestudeerd met Clark-type zuurstofelektroden. Een gebrek aan resolutie en doorvoer rechtvaardigde echter technologische vooruitgang. Tot op heden zijn de O2k (aangeduid als cHRR) en Seahorse XF96 Flux Analyzer (aangeduid als mHRR) op grote schaal toegepast op het gebied van cellulaire bio-energetica. Hier presenteren we een begrijpelijke verzameling protocollen voor de analyse van cellulair energiemetabolisme via beoordeling van mitochondriale ademhaling met behulp van cHRR o…
Declarações
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door financiering van de Academy of Finland (C.B.J),de Magnus Ehrnroot Foundation (C.B.J.) en een doctoraatsbeurs van de Integrated Life Sciences Graduate School (R.A.).
Materials
| 2 mL Potter-Elvehjem Glass/PTFE Tissue Grinder/Homogenizer | Omni International | 07-358029 | |
| 95% O2, 5% CO2 medical gas mixture | Potter for tissue grinding | ||
| ADP | Sigma | A 4386 | |
| Antimycin A | Sigma | A 8674 | Chemical |
| Ascorbate | Merck | PHR1279-1G | Chemical, dissolve in ethanol |
| BSA (fatty accid free) | Sigma | A 6003 | Chemical |
| CaCO3 | Sigma | C 4830 | Chemical |
| Cytochrome c | Sigma | C 7752 | Chemical |
| Digitonin | Sigma | D 5628 | Chemical |
| Dithiothreitol | Sigma | D 0632 | Chemical, dissolve in DMSO |
| D-Sucrose | Roth | 4621.1 | Chemical |
| Dulbecco’s modified Eagle’s medium (High glucose) | Fisher Scientific | 41965-039 | Chemical |
| Dulbecco’s modified Eagle’s medium (No Glucose) | Fisher Scientific | A14430-01 | |
| EGTA | Sigma | E 4378 | |
| Etomoxir | Sigma | E1905 | Chemical |
| Falcon 15 ml Conical Centrifuge Tubes | Fisher Scientific | AM12500 | Chemical |
| Falcon 50 ml Conical Centrifuge Tubes | Fisher Scientific | AM12501 | |
| FCCP | Sigma | C 2920 | |
| Glucose | Sigma | G7021 | Chemical, dissolve in ethanol |
| Glutamate | Sigma | G 1626 | Chemical |
| GlutaMax (100x) (200 nM L-alanyl-L-glutamine dipeptide) | Fisher Scientific | 35050061 | Chemical |
| HEK293 cells | ATTC | CRL-1573 | |
| Hemocytometer | Fisher Scientific | 0267151B | Instrument for cell counting |
| Hepes | Sigma | H 7523 | Chemical |
| Imidazole | Fluka | 56750 | Chemical |
| KCl | Merck | 1.04936 | Chemical |
| L-carnitine | Sigma | C0283 | Chemical |
| Malate | Sigma | M 1000 | Chemical |
| MES hydrate | Sigma | M8250 | Chemical |
| MgCl2 | Sigma | M 9272 | Chemical |
| Na2ATP | Sigma | A 2383 | Chemical |
| Na2Phosphocreatine | Sigma | P 7936 | Chemical |
| Na-pyruvate (100 mM) (100x) | Fisher Scientific | 11360070 | |
| NEAA (Non-essential amino acids) 100x | Fisher Scientific | 11140035 | |
| Normal FBS (10x) | Fisher Scientific | 10500064 | |
| O2k-Core: Oxygraph-2k | Oroboros Instruments | 10000-02 | High-resolution respirometry instrument |
| O2k-Titration Set | Oroboros Instruments | 20820-03 | Hamilton syringes for chemical injections |
| Oligomycin | Sigma | O 4876 | Chemical, dissolve in ethanol |
| Palmitoylcarnitine | Sigma | P 4509 | Chemical |
| Penicillin-Streptomycin | Fisher Scientific | 15140122 | |
| Pierce BCA Protein Assay Kit | Fisher Scientific | 23227 | |
| Pyruvate | Sigma | P 2256 | Chemical |
| RIPA-Buffer | Fisher Scientific | 89900 | Chemical |
| Rotenone | Sigma | R 8875 | Chemical, dissolve in ethanol |
| Saponin | Sigma | S7900 | Chemical |
Seahorse XF DMEM assay medium pack, pH 7.4 |
Agilent, Santa Clara, CA |
103680-100 | |
| Seahorse XFe96 Extracellular Flux Analyzer | Agilent, Santa Clara, CA |
High-throughput respirometry instrument | |
| Seahorse XFe96 FluxPak | Agilent, Santa Clara, CA |
Includes assay plates, cartridges, loading guides for transferring compounds to the assay cartridge, and calibrant solution. |
|
| Small scissors | Fisher Scientific | 08-951-20 | |
| Sodium azide | Sigma | S2002 | Chemical |
| Succinate | Sigma | S 2378 | Chemical |
| Taurine | Sigma | T 8691 | Chemical |
| TMPD | Sigma | T 3134 | Chemical |
| Trypan Blue solution | Merck | 72-57-1 | Chemical |
| Trypsin 0.25% EDTA | Fisher Scientific | 25200056 | |
| Two thin-edged forceps | Fisher Scientific | 12-000-122 | |
| Uridine stock (500x) | Sigma | U3750 | Chemical |
Referências
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: More than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Mehta, M. M., Weinberg, S. E., Chandel, N. S. Mitochondrial control of immunity. Beyond ATP. Nature Reviews Immunology. 17 (10), 608-620 (2017).
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle. New perspectives of mitochondrial physiology. International Journal of Biochemistry and Cell Biology. 41 (10), 1837-1845 (2009).
- Gorman, G. S., et al. Mitochondrial diseases. Nature Reviews Disease Primers. 2, 1-23 (2016).
- Boushel, R., Gnaiger, E., Schjerling, P., Skovbro, M., Kraunsøe, R., Dela, F. Patients with type 2 diabetes have normal mitochondrial function in skeletal muscle. Diabetologia. 50 (4), 790-796 (2007).
- Cogliati, S., et al. Mitochondrial cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency. Cell. 155 (1), 160-171 (2013).
- Kühlbrandt, W. Structure and function of mitochondrial membrane protein complexes. BMC Biology. 13, 1-11 (2015).
- Gnaiger, E. Mitochondrial pathways and Respiratory control. An introduction to OXPHOS analysis. Bioenergetics communications. 5th ed. , (2020).
- Jackson, C. B., et al. Mutations in SDHD lead to autosomal recessive encephalomyopathy and isolated mitochondrial complex II deficiency. Journal of Medical Genetics. 51 (3), 170-175 (2014).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods in Molecular Biology. 810, 25-58 (2012).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- Doerrier, C., Garcia-Souza, L. F., Krumschnabel, G., Wohlfarter, Y., Mészáros, A. T., Gnaiger, E. High-resolution fluorespirometry and oxphos protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods in Molecular Biology. 1782, 31-70 (2018).
- Zhang, J., et al. Measuring energy metabolism in cultured cells, including human pluripotent stem cells and differentiated cells. Nature Protocols. 7 (6), 1068-1085 (2012).
- García-Roche, M., Casal, A., Carriquiry, M., Radi, R., Quijano, C., Cassina, A. Respiratory analysis of coupled mitochondria in cryopreserved liver biopsies. Redox Biology. 17, 207-212 (2018).
- Acin-Perez, R., et al. A novel approach to measure mitochondrial respiration in frozen biological samples. The EMBO Journal. 39 (13), 1-18 (2020).
- Cell metabolism assay kits. Seahorse assay kits and media Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-lits-reagents-cell-assay-media (2021)
- Chance, B., Williams, G. R. A method for the localization of sites for oxidative phosphorylation. Nature. 176 (4475), 250-254 (1955).
- Gnaiger, E., et al. Mitochondrial respiratory states and rates. MitoFit Preprint Arch. , (2019).
- Gnaiger, E. O2k-procedures: SOP O2k quality control 1: Polarographic oxygen sensors and accuracy of calibration Section Page. Oroboros. 03 (18), 1-21 (2020).
- Robinson, B. H., Petrova-Benedict, R., Buncic, J. R., Wallace, D. C. Nonviability of cells with oxidative defects in galactose medium: A screening test for affected patient fibroblasts. Biochemical Medicine and Metabolic Biology. 48 (2), 122-126 (1992).
- King, M. P., Attardi, G. Human cells lacking mtDNA: Repopulation with exogenous mitochondria by complementation. Science. 246 (4929), 500-503 (1989).
- Makrecka-Kuka, M., Krumschnabel, G., Gnaiger, E. High-resolution respirometry for simultaneous measurement of oxygen and hydrogen peroxide fluxes in permeabilized cells, tissue homogenate and isolated mitochondria. Biomolecules. 5 (3), 1319-1338 (2015).
- Fasching, M., Gnaiger, E. O2k quality control 2: Instrumental oxygen background correction and accuracy of oxygen flux. Mitochondrial Physiology Network. 14 (06), 1-14 (2016).
- Gnaiger, E., Lassnig, B., Kuznetsov, A., Rieger, G., Margreiter, R. Excess capacity of cytochrome c oxidase. Journal of Experimental Biology. 1139, 1129-1139 (1998).
- Gnaiger, E., et al. Mitochondria in the Cold. Life in the Cold. , 431-442 (2000).
- Fontana-Ayoub, M., Fasching, E., Gnaiger, Selected media and chemicals for respirometry with mitochondrial preparations. Mitochondrial Physiology Network. 02 (17), 1-9 (2014).
- Gerencser, A. A., et al. Quantitative microplate-based respirometry with correction for oxygen diffusion. Analytical Chemistry. 81 (16), 6868-6878 (2009).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods in Enzymology. 542, 163-181 (2014).
- Nászai, A., Terhes, E., Kaszaki, J., Boros, M., Juhász, L. Ca(2+)N it be measured? Detection of extramitochondrial calcium movement with high-resolution fluorespirometry. Scientific Reports. 9 (1), 1-13 (2019).
- Pajak, B., et al. 2-Deoxy-d-Glucose and its analogs: From diagnostic to therapeutic agents. International Journal of Molecular Sciences. 21 (1), 234 (2019).
- Mercier-Letondal, P., Marton, C., Godet, Y., Galaine, J. Validation of a method evaluating T cell metabolic potential in compliance with ICH Q2 (R1). Journal of Translational Medicine. 19 (1), 1-15 (2021).
- Sauerbeck, A., et al. Analysis of regional brain mitochondrial bioenergetics and susceptibility to mitochondrial inhibition utilizing a microplate based system. Journal of Neuroscience Methods. 198 (1), 36-43 (2011).
- Jackman, M. R., Willis, W. T. Characteristics of mitochondria isolated from type I and type IIb skeletal muscle. American Journal of Physiology – Cell Physiology. 270 (2), 673-678 (1996).
- Ponsot, E., et al. Mitochondrial tissue specificity of substrates utilization in rat cardiac and skeletal muscles. Journal of Cellular Physiology. 203 (3), 479-486 (2005).
- Schönfeld, P., Reiser, G. Why does brain metabolism not favor burning of fatty acids to provide energy-Reflections on disadvantages of the use of free fatty acids as fuel for brain. Journal of Cerebral Blood Flow and Metabolism. 33 (10), 1493-1499 (2013).
- Calderon-Dominguez, M., Mir, J. F., Fucho, R., Weber, M., Serra, D., Herrero, L. Fatty acid metabolism and the basis of brown adipose tissue function. Adipocyte. 5 (2), 98-118 (2016).
- Divakaruni, A. S., Rogers, G. W., Murphy, A. N. Measuring mitochondrial function in permeabilized cells using the seahorse XF analyzer or a clark-type oxygen electrode. Current Protocols in Toxicology. 2014, 1-16 (2014).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using Seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PLoS ONE. 6 (7), 21746 (2011).
- Jordá, A., Zaragozá, R., Portolés, M., Báguena-Cervellera, R., Renau-Piqueras, J. Long-term high-protein diet induces biochemical and ultrastructural changes in rat liver mitochondria. Archives of Biochemistry and Biophysics. 265 (2), 241-248 (1988).
- Jackson, C. B., Gallati, S., Schaller, A. QPCR-based mitochondrial DNA quantification: Influence of template DNA fragmentation on accuracy. Biochemical and Biophysical Research Communications. 423 (3), 441-447 (2012).
- Hirsch, H. M. Tissue autoxidation inhibitors: II. The presence of inhibitor in intact cells; Assay of liver and hepatoma effect on radio-oxidations. Pesquisa do Câncer. 16 (11), 1076-1082 (1956).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard Isolation methods. PLoS ONE. 6 (3), 18317 (2011).
- Tanumihardja, E., Slaats, R. H., Van Der Meer, A. D., Passier, R., Olthuis, W., Van Den Berg, A. Measuring both pH and O2 with a single On-Chip sensor in cultures of human pluripotent stem cell-derived cardiomyocytes to track induced changes in cellular metabolism. ACS Sensors. 6 (1), 267-274 (2021).
- Harms, F., Stolker, R. J., Mik, E. Cutaneous respirometry as novel technique to monitor mitochondrial function: A feasibility study in healthy volunteers. PLoS ONE. 11 (7), 159544 (2016).
- Levitsky, Y., et al. Micro-respirometry of whole cells and isolated mitochondria. RSC Advances. 9 (57), 33257-33267 (2019).

