יצירת חומרים מהונדסים ונוקאאוטים במינים סטרונגילואידים על ידי מיקרו-אינטגרציה
Summary
ערכת הכלים הגנומית הפונקציונלית עבור הנמטודות הטפיליות סטרונגילואידים סטרקורליס וסטריונגילודים ראטי כוללת טרנסגנזה, מוטגנזה בתיווך CRISPR/Cas9 ו-RNAi. פרוטוקול זה ידגים כיצד להשתמש במיקרו-איניג’קציה תוך-גונדלית כדי להכניס טרנסג’נים ורכיבי קריספר לתוך S. stercoralis ו – S. ratti.
Abstract
הסוג סטרונגילואידים מורכב ממספר מינים של נמטודות חודרות עור עם טווחי פונדקאים שונים, כולל סטרונגילואידים סטרקורליס ו-סטרונגילואידים ראטי. S. stercoralis הוא נמטודה אנושית-טפילית וחודרת עור המדביקה כ-610 מיליון בני אדם, בעוד שטפיל החולדה S. ratti קשור קשר הדוק ל-S. stercoralis ומשמש לעתים קרובות כמודל מעבדה עבור S. stercoralis. גם S. stercoralis וגם S. ratti ניתנים להתאמה בקלות ליצירת טרנסגניות ונוקאאוטים באמצעות טכניקת העברת חומצות גרעין אקסוגניות של מיקרו-איניג’קציה תוך-גונדלית, וככאלה, הופיעו כמערכות מודל להלמינתנים טפיליים אחרים שעדיין אינם מקובלים על טכניקה זו.
בוגרים טפיליים של סטרונגילואידים מאכלסים את המעי הדק של הפונדקאי שלהם ומשחררים צאצאים לסביבה דרך הצואה. ברגע שהם נמצאים בסביבה, הזחלים מתפתחים לבוגרים חופשיים, שחיים בצואה ומייצרים צאצאים שחייבים למצוא פונדקאי חדש ולטלוש אליו. דור סביבתי זה הוא ייחודי למין סטרונגילואידים ודומה מספיק במורפולוגיה למודל של נמטודה חופשית Caenorhabditis elegans שניתן להתאים טכניקות שפותחו עבור C. elegans לשימוש עם נמטודות טפיליות אלה, כולל מיקרו-אינטגונדציה תוך-גונדלית. באמצעות מיקרו-איניג’ינג תוך-גונדלי, ניתן להכניס מגוון רחב של טרנסג’נדרים ל-Strongyloides. רכיבי CRISPR/Cas9 יכולים גם להיות מיקרו-איניג’קטים כדי ליצור זחלי סטרונגילואידים מוטנטיים. כאן מתוארת הטכניקה של מיקרו-איניג’קציה תוך-גונדלית לתוך סטרונגילואידים, כולל הכנת מבוגרים החיים בחופשיות, הליך ההזרקה ובחירת הצאצאים המהונדסים. תמונות של זחלי סטרונגילואידים מהונדסים שנוצרו באמצעות מוטגנזה של CRISPR/Cas9 כלולות. מטרת מאמר זה היא לאפשר לחוקרים אחרים להשתמש במיקרו-איניג’קציה כדי ליצור סטרונגילואידים מהונדסים ומוטנטיים.
Introduction
סטרקוראליס סטרקורליס סטרונגילואידס כבר מזמן התעלמו ממנו כפתוגן אנושי חשוב בהשוואה לתולעי הקרס המוכרות יותר ולתולעת העגולה Ascaris lumbricoides1. מחקרים קודמים על נטל התולעים לעתים קרובות העריכו באופן חמור את השכיחות של S. stercoralis בשל הרגישות הנמוכה של שיטות אבחון נפוצות עבור S. stercoralis2. בשנים האחרונות, מחקרים אפידמיולוגיים המבוססים על כלי אבחון משופרים העריכו כי השכיחות האמיתית של זיהומי S. stercoralis גבוהה בהרבה ממה שדווח בעבר, כ -610 מיליון אנשים ברחבי העולם2.
גם ל-S. stercoralis וגם למינים אחרים של סטרונגילואידים, כולל טפיל החולדה הקשור באופן הדוק ולמודל המעבדה הנפוץ S. ratti, יש מחזור חיים יוצא דופן שיש לו יתרון למחקרים גנומיים ניסיוניים מכיוון שהוא מורכב מדורות טפיליים וחופשיים (סביבתיים)3 (איור 1). באופן ספציפי, גם S. stercoralis וגם S. ratti יכולים לעבור דרך דור אחד של חיים חופשיים. הדור החי החופשי מורכב מזחלים פוסט-טפיליים המתפתחים לזכרים ונקבות בוגרים בעלי חיים חופשיים; כל צאצאיהם של הבוגרים החיים בחופשיות מתפתחים לזחלים מדביקים, אשר חייבים להדביק פונדקאי כדי להמשיך את מחזור החיים. יתר על כן, ניתן לתמרן באופן ניסיוני את הדור הסביבתי או החופשי הזה במעבדה. מאחר שמבוגרים בעלי חיים חופשיים של סטרונגילואידים ובוגרים של C. elegans חולקים מורפולוגיה דומה, ניתן להתאים טכניקות כגון מיקרו-אינטגונדציה תוך-גונדלית שפותחו במקור עבור C. elegans לשימוש עם סטרונגילואידים בוגרים חיים חופשיים 4,5. בעוד שדנ”א מוחדר בדרך כלל לנקבות בוגרות בעלות חיים חופשיים, גם זכרים וגם נקבות של סטרונגילואידים יכולים להיות מיקרו-איניג’קט6. לפיכך, כלים גנומיים פונקציונליים זמינים כדי לחקור היבטים רבים של הביולוגיה של סטרונגילואידים. נמטודות טפיליות אחרות חסרות דור חופשי, וכתוצאה מכך, הן אינן מקובלות באותה מידה על טכניקות גנומיות פונקציונליות3.
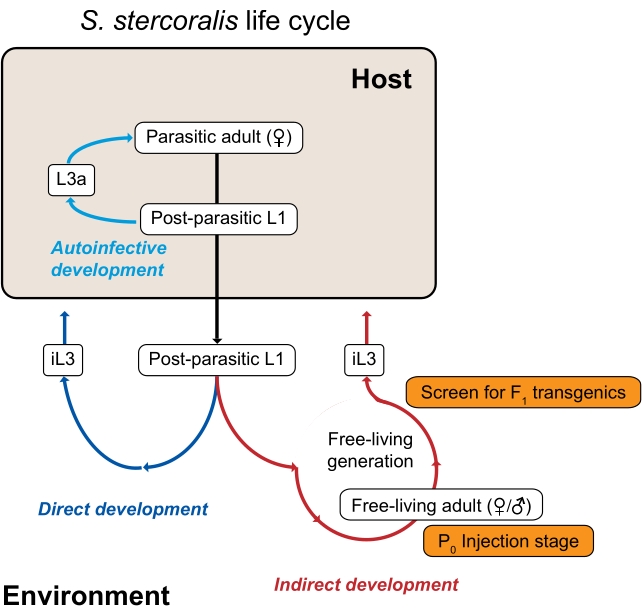
איור 1: מחזור החיים של סטרקורליס סטרונגילואידים. הנקבות הטפיליות של S. stercoralis מאכלסות את המעי הדק של מארחי היונקים שלהן (בני אדם, פרימטים שאינם בני אדם, כלבים). הנקבות הטפיליות מתרבות על ידי פרתנוגנזה ומטילות ביצים בתוך המעי הדק. הביצים בוקעות בעודן בתוך הפונדקאי לתוך זחלים פוסט-טפיליים, אשר מועברים לסביבה עם צואה. אם הזחלים הפוסט-טפיליים הם זכרים, הם מתפתחים לזכרים בוגרים שחיים בחופשיות. אם הזחלים הפוסט-טפיליים הם נקבות, הם יכולים להתפתח לנקבות בוגרות בעלות חיים חופשיים (התפתחות עקיפה) או לזחלים זיהומיים בשלב השלישי (iL3s; התפתחות ישירה). הזכרים והנקבות החיים בחופשיות מתרבים מינית כדי ליצור צאצאים המוגבלים להפוך ל-iL3s. בתנאים מסוימים, S. stercoralis יכול גם לעבור הדבקה אוטומטית, שבה חלק מהזחלים הפוסט-טפיליים נשארים בתוך המעי המארח במקום לעבור לסביבה בצואה. זחלים אלה יכולים להתפתח לזחלים אוטו-אינפקטיביים (L3a) בתוך הפונדקאי, לחדור דרך דופן המעי, לנדוד דרך הגוף, ובסופו של דבר לחזור למעי כדי להפוך למבוגרים רבייתיים. מחזור החיים של S. ratti דומה, למעט העובדה ש– S. ratti מדביק חולדות ואין לו מחזור אוטו-אינפקטיבי. הדור הסביבתי הוא המפתח לשימוש במיני סטרונגילואידים למחקרים גנטיים. הנקבות הבוגרות החיות באופן חופשי (P0) יכולות להיות מיקרו-איניג’קט; צאצאיהם, שכולם יהפכו ל-iL3s, הם המהונדסים הפוטנציאליים של F1. נתון זה שונה מקסטלטו ואחרים. 3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
S. stercoralis חולק היבטים רבים של הביולוגיה שלו עם נמטודות אנושיות-טפיליות אחרות במערכת העיכול, כולל פלישת המארחים ומודולציה של מערכת החיסון המארח. לדוגמה, תולעי קרס אנושיות-טפיליות בסוג Necator ו – Ancylostoma גם נדבקות על ידי חדירת העור, מנווטות באופן דומה בגוף, ובסופו של דבר שוכנות כבוגרים טפיליים במעי הדק7. לפיכך, נמטודות רבות במערכת העיכול ככל הנראה משתמשות בהתנהגויות חושיות נפוצות ובטכניקות התחמקות חיסוניות. כתוצאה מכך, הידע שנאסף מ-Strongyloides ישלים את הממצאים בנמטודות אחרות, שפחות ניתנות לטיפול גנטי, ויוביל להבנה מלאה יותר של הטפילים המורכבים והחשובים האלה.
פרוטוקול מיקרו-איניג’קציה זה מתווה את השיטה להחדרת דנ”א לנקבות בוגרות בעלות חיים חופשיים של סטרונגילואידים כדי ליצור צאצאים מהונדסים ומוטנטיים. מתוארות דרישות תחזוקת המתח, כולל התזמון ההתפתחותי של תולעים בוגרות למיקרו-אינטגרציות ואיסוף צאצאים מהונדסים. פרוטוקולים והדגמה של טכניקת המיקרו-איניג’קציה המלאה, יחד עם פרוטוקולים לגידול וסינון צאצאים מהונדסים, כלולים, יחד עם רשימה של כל הציוד הדרוש וחומרים מתכלים.
Protocol
Representative Results
Discussion
פרוטוקול מיקרו-איניג’קציה זה מפרט את השיטות להחדרת מבנים לטרנסגנזה ומוטגנזה בתיווך CRISPR/Cas9 לתוך S. stercoralis ו-S. ratti. הן עבור S. stercoralis והן עבור S. ratti, ההישרדות לאחר ההזרקה ושיעור הטרנסגנזה או המוטגנזה כפופים למספר משתנים הניתנים לכוונון עדין.
השיקול הקריטי הראש…
Declarações
The authors have nothing to disclose.
Acknowledgements
pPV540 ו- pPV402 היו מתנות חביבות מד”ר ג’יימס לוק מאוניברסיטת פנסילבניה. אנו מודים לאסטרה בראיינט על הערות מועילות על כתב היד. עבודה זו מומנה על ידי חוקרי קרן בורוז-וולקום בפרס הפתוגנזה של מחלות, פרס חוקר הפקולטה של המכון הרפואי ע”ש הווארד יוז, והמכונים הלאומיים לבריאות R01 DC017959 (E.A.H.).
Materials
| (−)-Nicotine, ≥99% (GC), liquid | Sigma-Aldrich | N3876-5ML | nicotine for paralyzing worms |
| 3" iron C-clamp, 3" x 2" (capacity x depth) | VWR | 470121-790 | C-clamp to secure setup to bench top |
| Agarose LE | Phenix | RBA-500 | agarose for slides |
| Bone char, 4 lb pail, 10 x 28 mesh | Ebonex | n/a | charcoal for fecal-charcoal cultures |
| Bone char, granules, 10 x 28 mesh | Reade | bonechar10x28 | charcoal for fecal-cultures (alternative to the above) |
| Coarse micromanipulator | Narishige | MMN-1 | coarse micromanipulator |
| Corning Costar Spin-X centrifuge tube filters | Fisher | 07-200-385 | microfilter column |
| Cover glass, 48 x 60 mm, No. 1 thickness | Brain Research Lab | 4860-1 | coverslips (48 x 60 mm) |
| Deep Petri dishes, heavy version with 6 vents, 100 mm diameter | VWR | 82050-918 | 10 cm Petri dishes (for fecal-charcoal cultures) |
| Eisco retort base w/ rod | Fisher | 12-000-101 | stand for Baermann apparatus |
| Eppendorf FemtoJet microinjector microloader tips | VWR | 89009-310 | for filling microinjection needles |
| Fisherbrand absorbent underpads | Fisher | 14-206-62 | bench paper (for prepping) |
| Fisherbrand Cast-Iron Rings | Fisher | 14-050CQ | Baermann o-ring |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for mixing) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for catch bucket/water bucket) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (x2) (to make holder) |
| Gorilla epoxie in syringe | McMaster-Carr | 7541A51 | glue (to attach tubing) |
| Halocarbon oil 700 | Sigma-Aldrich | H8898-50ML | halocarbon oil |
| High-temperature silicone rubber tubing for food and beverage, 1/2" ID, 5/8" OD | McMaster-Carr | 3038K24 | tubing (for funnel) |
| KIMAX funnels, long stem, 60° Angle, Kimble Chase | VWR | 89001-414 | Baermann funnel |
| Kimberly-Clark Professional Kimtech Science benchtop protectors | Fisher | 15-235-101 | bench paper (for prepping) |
| Leica stereomicroscope with fluorescence | Leica | M165 FC | GFP stereomicroscope for identifying and sorting transgenic worms |
| microINJECTOR brass straight arm needle-holder | Tritech | MINJ-4 | microinjection needle holder |
| microINJECTOR system | Tritech | MINJ-1 | microinjection system |
| Mongolian Gerbils | Charles River Laboratories | 213-Mongolian Gerbil | gerbils for maintenance of S. stercoralis, male 4-6 weeks |
| Nasco Whirl-Pak easy-to-close bags, 18 oz | VWR | 11216-776 | Whirl-Pak sample bags |
| Nylon tulle (mesh) | Jo-Ann Fabrics | zprd_14061949a | nylon mesh for Baermann holder |
| Platinum wire, 36 Gauge, per inch | Thomas Scientific | 1233S72 | platinum/iridium wire for worm picks |
| Puritan tongue depressors, 152 mm (L) x 17.5 mm (W) | VWR | 62505-007 | wood sticks (for mixing samples) |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | QIAGEN miniprep kit |
| Rats-Long Evans | Envigo | 140 HsdBlu:LE Long Evans | rats for maintenance of S. ratti, female 4-6 weeks |
| Rats-Sprague Dawley | Envigo | 002 Hsd:Sprague Dawley SD | rats for maintenance of S. ratti, female 4-6 weeks |
| Really Useful Boxes translucent storage boxes with lids, 1.6 L capacity, 7-5/8" x 5-5/16" x 4-5/16" | Office Depot | 452369 | plastic boxes for humidified chamber |
| Shepherd techboard, 8 x 16.5 inches | Newco | 999589 | techboard |
| Stainless steel raised wire floor | Ancare | R20SSRWF | wire cage bottoms |
| StalkMarket compostable cutlery spoons, 6", white, pack of 1,000 | Office Depot | 9587303 | spoons |
| Stender dish, stacking type, 37 x 25 mm | Carolina (Science) | 741012 | watch glasses (small, round) |
| Stereomicroscope | Motic | K-400 LED | dissecting prep scope |
| Storage tote, color clear/white, outside height 4-7/8 in, outside length 13-5/8 in, Sterilite | Grainger | 53GN16 | plastic boxes for humidified chamber |
| Sutter P-30 micropipette puller | Sutter | P-30/P | needle puller with platinum/iridium filament |
| Syracuse watch glasses | Fisher | S34826 | watch glasses (large, round) |
| Thermo Scientific Castaloy fixed-angle clamps | Fisher | 05-769-2Q | funnel clamps (2x) |
| Three-axis hanging joystick oil hydrolic micromanipulator | Narishige | MM0-4 | fine micromanipulator |
| United Mohr pinchcock clamps | Fisher | S99422 | Pinch clamps (2x) |
| Vented, sharp-edge Petri dishes (60 mm diameter) | Tritech Research | T3308P | 6 cm Petri dishes (for small-scale fecal-charcoal cultures) |
| VWR light-duty tissue wipers | VWR | 82003-820 | lining for Baermann holder |
| watch glass, square, 1-5/8 in | Carolina (Science) | 742300 | watch glasses (small, square) |
| Whatman qualitative grade plain circles, grade 1, 5.5 cm diameter | Fisher | 09-805B | filter paper (for 6 cm Petri dishes) |
| Whatman qualitative grade plain circles, grade 1, 9 cm diameter | Fisher | 09-805D | filter paper (for 10 cm Petri dishes) |
| World Precision Instrument borosilicate glass capillary, 1.2 mm x 4 in | Fisher | 50-821-813 | glass capillaries for microinjection needles |
| X-Acto Knives, No. 1 Knife With No. 11 Blade | Office Depot | 238816 | X-Acto knives without blades to hold worm picks |
| Zeiss AxioObserver A1 | Zeiss | n/a | inverted microscope |
Referências
- Krolewiecki, A. J., et al. A public health response against Strongyloides stercoralis: time to look at soil-transmitted helminthiasis in full. PLoS Neglected Tropical Diseases. 7 (5), 2165 (2013).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Castelletto, M. L., Gang, S. S., Hallem, E. A. Recent advances in functional genomics for parasitic nematodes of mammals. Journal of Experimental Biology. 223, 206482 (2020).
- Evans, T. C., et al. Transformation and microinjection. WormBook. , (2006).
- Lok, J. B., Unnasch, T. R., et al. Transgenesis in animal parasitic nematodes: Strongyloides spp. and Brugia spp. WormBook. , (2013).
- Shao, H. G., Li, X. S., Lok, J. B. Heritable genetic transformation of Strongyloides stercoralis by microinjection of plasmid DNA constructs into the male germline. International Journal for Parasitology. 47 (9), 511-515 (2017).
- Schafer, T. W., Skopic, A. Parasites of the small intestine. Current Gastroenterology Reports. 8 (4), 312-320 (2006).
- Stiernagle, T. Maintenance of C. elegans. The C. elegans Research Community, WormBook. , (2006).
- Gang, S. S., et al. Targeted mutagenesis in a human-parasitic nematode. PLoS Pathogens. 13 (10), 1006675 (2017).
- Lok, J. B. Strongyloides stercoralis: a model for translational research on parasitic nematode biology. The C. elegans Research Community, WormBook. , (2007).
- Hawdon, J. M., Schad, G. A. Long-term storage of hookworm infective larvae in buffered saline solution maintains larval responsiveness to host signals. Proceedings of the Helminthological Society of Washington (USA). 58 (1), 140-142 (1991).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
- Junio, A. B., et al. Strongyloides stercoralis: cell- and tissue-specific transgene expression and co-transformation with vector constructs incorporating a common multifunctional 3′ UTR. Experimental Parasitology. 118 (2), 253-265 (2008).
- Gang, S. S., et al. Chemosensory mechanisms of host seeking and infectivity in skin-penetrating nematodes. Proceedings of the National Academy of Sciences of the United States of America. 117 (30), 17913-17923 (2020).
- Bryant, A. S., et al. A critical role for thermosensation in host seeking by skin-penetrating nematodes. Current Biology. 28 (14), 2338-2347 (2018).
- Lok, J. B. Nucleic acid transfection and transgenesis in parasitic nematodes. Parasitology. 139 (5), 574-588 (2012).
- Shao, H., et al. Transposon-mediated chromosomal integration of transgenes in the parasitic nematode Strongyloides ratti and establishment of stable transgenic lines. PLoS Pathogens. 8 (8), 1002871 (2012).
- Lok, J. piggyBac: a vehicle for integrative DNA transformation of parasitic nematodes. Mobile Genetic Elements. 3 (2), 24417 (2013).
- Li, X., et al. Successful transgenesis of the parasitic nematode Strongyloides stercoralis requires endogenous non-coding control elements. International Journal for Parasitology. 36 (6), 671-679 (2006).
- Bryant, A. S., Hallem, E. A. The Wild Worm Codon Adapter: a web tool for automated codon adaptation of transgenes for expression in non-Caenorhabditis nematodes. G3. 3 (7), (2021).
- Crane, M., et al. In vivo measurements reveal a single 5′-intron is sufficient to increase protein expression level in Caenorhabditis elegans. Scientific Reports. 9 (1), 9192 (2019).
- Han, Z., et al. Improving transgenesis efficiency and CRISPR-associated tools through codon optimization and native intron addition in Pristionchus nematodes. Genética. 216 (4), 947-956 (2020).
- Adams, S., Pathak, P., Shao, H., Lok, J. B., Pires-daSilva, A. Liposome-based transfection enhances RNAi and CRISPR-mediated mutagenesis in non-model nematode systems. Scientific Reports. 9 (1), 483 (2019).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Experimental Parasitology. 168, 25-30 (2016).
- Harvey, S. C., Gemmill, A. W., Read, A. F., Viney, M. E. The control of morph development in the parasitic nematode Strongyloides ratti. Proceedings of the Royal Society B: Biological Sciences. 267 (1457), 2057-2063 (2000).
- Kim, A., Pyykko, I. Size matters: versatile use of PiggyBac transposons as a genetic manipulation tool. Molecular and Cellular Biochemistry. 354 (1-2), 301-309 (2011).
- Lok, J. B., Shao, H., Massey, H. C., Li, X. Transgenesis in Strongyloides and related parasitic nematodes: historical perspectives, current functional genomic applications and progress towards gene disruption and editing. Parasitology. 144 (3), 327-342 (2017).
- Farboud, B., Meyer, B. J. Dramatic enhancement of genome editing by CRISPR/Cas9 through improved guide RNA design. Genética. 199 (4), 959-971 (2015).
- Cheong, M. C., et al. Identification of a nuclear receptor/coactivator developmental signaling pathway in the nematode parasite Strongyloides stercoralis. Proceedings of the National Academy of Sciences of the United States of America. 118 (8), 2021864118 (2021).
- Nolan, T. J., Megyeri, Z., Bhopale, V. M., Schad, G. A. Strongyloides stercoralis: the first rodent model for uncomplicated and hyperinfective strongyloidiasis, the Mongolian gerbil (Meriones unguiculatus). Journal of Infectious Diseases. 168 (6), 1479-1484 (1993).
- Li, X., et al. Transgenesis in the parasitic nematode Strongyloides ratti. Molecular and Biochemical Parasitology. 179 (2), 114-119 (2011).
- Viney, M. E. Exploiting the life cycle of Strongyloides ratti. Parasitology Today. 15 (6), 231-235 (1999).
- Stoltzfus, J. D., Massey, H. C., Nolan, T. J., Griffith, S. D., Lok, J. B. Strongyloides stercoralis age-1: a potential regulator of infective larval development in a parasitic nematode. PLoS ONE. 7 (6), 38587 (2012).
- Castelletto, M. L., Massey, H. C., Lok, J. B. Morphogenesis of Strongyloides stercoralis infective larvae requires the DAF-16 ortholog FKTF-1. PLoS Pathogens. 5 (4), 1000370 (2009).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLoS Pathogens. 17 (7), 1009709 (2021).

