Erzeugung von Transgenics und Knockouts in Strongyloides-Spezies durch Mikroinjektion
Summary
Das funktionelle genomische Toolkit für die parasitären Nematoden Strongyloides stercoralis und Strongyloides ratti umfasst Transgenese, CRISPR/Cas9-vermittelte Mutagenese und RNAi. Dieses Protokoll wird zeigen, wie intragonadale Mikroinjektion verwendet werden kann, um Transgene und CRISPR-Komponenten in S. stercoralis und S. ratti einzuführen.
Abstract
Die Gattung Strongyloides besteht aus mehreren Arten von hautdurchdringenden Nematoden mit unterschiedlichen Wirtsbereichen, darunter Strongyloides stercoralis und Strongyloides ratti. S. stercoralis ist ein menschlich-parasitärer, hautdurchdringender Nematod, der etwa 610 Millionen Menschen infiziert, während der Rattenparasit S. ratti eng mit S. stercoralis verwandt ist und oft als Labormodell für S. stercoralis verwendet wird. Sowohl S. stercoralis als auch S. ratti sind leicht für die Erzeugung von Transgenen und Knockouts durch die exogene Nukleinsäure-Abgabetechnik der intragonadalen Mikroinjektion zugänglich und haben sich als solche als Modellsysteme für andere parasitäre Helminthen herausgestellt, die dieser Technik noch nicht zugänglich sind.
Parasitäre Strongyloides-Erwachsene bewohnen den Dünndarm ihres Wirtes und setzen Nachkommen über den Kot in die Umwelt frei. Einmal in der Umwelt, entwickeln sich die Larven zu frei lebenden Erwachsenen, die im Kot leben und Nachkommen produzieren, die einen neuen Wirt finden und eindringen müssen. Diese Umweltgeneration ist einzigartig für die Strongyloides-Arten und ähnelt in der Morphologie so sehr der modellhaft freilebenden Nematode Caenorhabditis elegans, dass Techniken, die für C. elegans entwickelt wurden, für die Verwendung mit diesen parasitären Nematoden, einschließlich intragonadaler Mikroinjektion, angepasst werden können. Mit Hilfe der intragonadalen Mikroinjektion kann eine Vielzahl von Transgenen in Strongyloides eingeführt werden. CRISPR/Cas9-Komponenten können auch mikroinjiziert werden, um mutierte Strongyloides-Larven zu erzeugen. Hier wird die Technik der intragonadalen Mikroinjektion in Strongyloide , einschließlich der Vorbereitung freilebender Erwachsener, des Injektionsverfahrens und der Selektion transgener Nachkommen, beschrieben. Bilder von transgenen Strongyloides-Larven , die mit CRISPR/Cas9-Mutagenese erstellt wurden, sind enthalten. Ziel dieser Arbeit ist es, anderen Forschern die Möglichkeit zu geben, mit Hilfe der Mikroinjektion transgene und mutierte Strongyloide herzustellen.
Introduction
Strongyloides stercoralis wurde lange Zeit als wichtiger menschlicher Krankheitserreger im Vergleich zu den weiter verbreiteten Hakenwürmern und dem Spulwurm Ascaris lumbricoides1 übersehen. Frühere Studien zur Wurmbelastung unterschätzten die Prävalenz von S. stercoralis aufgrund der geringen Sensitivität gängiger Diagnosemethoden für S. stercoralisoft stark 2. In den letzten Jahren haben epidemiologische Studien, die auf verbesserten diagnostischen Instrumenten basieren, geschätzt, dass die tatsächliche Prävalenz von S. stercoralis-Infektionen viel höher ist als zuvor berichtet, etwa 610 Millionen Menschen weltweit2.
Sowohl S. stercoralis als auch andere Strongyloides-Arten, einschließlich des eng verwandten Rattenparasiten und des gemeinsamen Labormodells S. ratti, haben einen ungewöhnlichen Lebenszyklus, der für experimentelle genomische Studien von Vorteil ist, da er sowohl aus parasitären als auch aus freilebenden (Umwelt-) Generationen 3 besteht (Abbildung 1). Insbesondere können sowohl S. stercoralis als auch S. ratti durch eine einzige frei lebende Generation durchlaufen. Die freilebende Generation besteht aus postparasitären Larven, die sich zu frei lebenden erwachsenen Männchen und Weibchen entwickeln; Alle Nachkommen der frei lebenden Erwachsenen entwickeln sich zu infektiösen Larven, die einen Wirt infizieren müssen, um den Lebenszyklus fortzusetzen. Darüber hinaus kann diese ökologische oder frei lebende Generation im Labor experimentell manipuliert werden. Da freilebende Strongyloides-Erwachsene und C. elegans-Erwachsene eine ähnliche Morphologie aufweisen, können Techniken wie die intragonadale Mikroinjektion, die ursprünglich für C. elegans entwickelt wurden, für die Verwendung mit freilebenden erwachsenen Strongyloides 4,5 angepasst werden. Während DNA im Allgemeinen in frei lebende erwachsene Weibchen eingeführt wird, können sowohl Männer als auch Frauen von Strongyloides mikroinjiziert werden6. Somit stehen funktionelle genomische Werkzeuge zur Verfügung, um viele Aspekte der Biologie von Strongyloides zu untersuchen. Anderen parasitären Nematoden fehlt eine frei lebende Generation und sie sind daher nicht so leicht für funktionelle genomische Technikengeeignet 3.
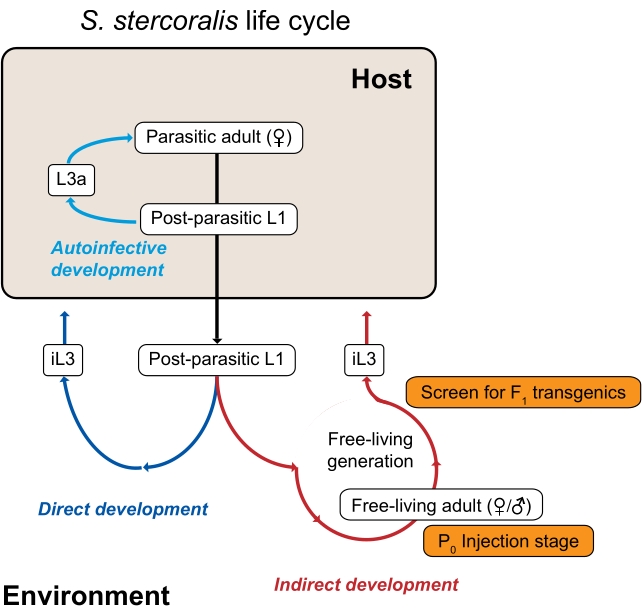
Abbildung 1: Der Lebenszyklus von Strongyloides stercoralis. Die parasitären Weibchen von S. stercoralis bewohnen den Dünndarm ihrer Säugetierwirte (Menschen, nichtmenschliche Primaten, Hunde). Die parasitären Weibchen vermehren sich durch Parthenogenese und legen Eier in den Dünndarm. Die Eier schlüpfen, während sie sich noch im Inneren des Wirts befinden, zu postparasitären Larven, die dann mit Kot in die Umwelt gelangen. Wenn die postparasitären Larven männlich sind, entwickeln sie sich zu frei lebenden erwachsenen Männchen. Wenn die postparasitären Larven weiblich sind, können sie sich entweder zu frei lebenden erwachsenen Weibchen (indirekte Entwicklung) oder zu infektiösen Larven im dritten Stadium (iL3s; direkte Entwicklung) entwickeln. Die frei lebenden Männchen und Weibchen vermehren sich sexuell, um Nachkommen zu schaffen, die gezwungen sind, iL3s zu werden. Unter bestimmten Bedingungen kann S. stercoralis auch einer Autoinfektion unterzogen werden, bei der einige der postparasitären Larven im Darm des Wirts verbleiben, anstatt im Kot in die Umwelt überzugehen. Diese Larven können sich im Inneren des Wirts zu autoinfektiösen Larven (L3a) entwickeln, durch die Darmwand eindringen, durch den Körper wandern und schließlich in den Darm zurückkehren, um reproduktive Erwachsene zu werden. Der Lebenszyklus von S. ratti ist ähnlich, außer dass S. ratti Ratten infiziert und keinen autoinfektiösen Zyklus hat. Die Umweltgenerierung ist der Schlüssel zur Verwendung von Strongyloides-Arten für genetische Studien. Die frei lebenden erwachsenen Weibchen (P0) können mikroinjiziert werden; ihre Nachkommen, die alle zu iL3s werden, sind die potenziellen F 1-Transgenen. Diese Figur wurde von Castelletto et al. modifiziert. 3. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
S. stercoralis teilt viele Aspekte seiner Biologie mit anderen gastrointestinalen menschlich-parasitären Nematoden, einschließlich Wirtsinvasion und Wirtsimmunmodulation. Zum Beispiel infizieren sich auch humanparasitäre Hakenwürmer der Gattungen Necator und Ancylostoma durch Hautpenetration, navigieren ähnlich durch den Körper und leben schließlich als parasitäre Erwachsene imDünndarm 7. Daher verwenden viele gastrointestinale Nematoden wahrscheinlich gängige sensorische Verhaltensweisen und Immunevasionstechniken. Infolgedessen wird das aus Strongyloides gewonnene Wissen die Ergebnisse anderer weniger genetisch beherrschbarer Nematoden ergänzen und zu einem vollständigeren Verständnis dieser komplexen und wichtigen Parasiten führen.
Dieses Mikroinjektionsprotokoll beschreibt die Methode zur Einführung von DNA in Strongyloides freilebende erwachsene Frauen, um transgene und mutierte Nachkommen herzustellen. Die Anforderungen an die Aufrechterhaltung des Stammes, einschließlich des Entwicklungszeitpunkts von erwachsenen Würmern für Mikroinjektionen und der Sammlung transgener Nachkommen, werden beschrieben. Protokolle und eine Demonstration der vollständigen Mikroinjektionstechnik sowie Protokolle für die Kultivierung und das Screening transgener Nachkommen sind enthalten, zusammen mit einer Liste aller notwendigen Geräte und Verbrauchsmaterialien.
Protocol
Representative Results
Discussion
Dieses Mikroinjektionsprotokoll beschreibt die Methoden zur Einführung von Konstrukten für Transgenese und CRISPR/Cas9-vermittelte Mutagenese in S. stercoralis und S . ratti. Sowohl für S. stercoralis als auch für S. ratti unterliegen das Überleben nach der Injektion und die Transgenese- oder Mutageneserate mehreren Variablen, die fein abgestimmt werden können.
Die erste kritische Überlegung für eine erfolgreiche Transgenese ist, wie Plasmidtransgen…
Declarações
The authors have nothing to disclose.
Acknowledgements
pPV540 und pPV402 waren freundliche Geschenke von Dr. James Lok von der University of Pennsylvania. Wir danken Astra Bryant für die hilfreichen Kommentare zum Manuskript. Diese Arbeit wurde von einem Burroughs-Wellcome Fund Investigators in the Pathogenesis of Disease Award, einem Howard Hughes Medical Institute Faculty Scholar Award und National Institutes of Health R01 DC017959 (E.A.H.) finanziert.
Materials
| (−)-Nicotine, ≥99% (GC), liquid | Sigma-Aldrich | N3876-5ML | nicotine for paralyzing worms |
| 3" iron C-clamp, 3" x 2" (capacity x depth) | VWR | 470121-790 | C-clamp to secure setup to bench top |
| Agarose LE | Phenix | RBA-500 | agarose for slides |
| Bone char, 4 lb pail, 10 x 28 mesh | Ebonex | n/a | charcoal for fecal-charcoal cultures |
| Bone char, granules, 10 x 28 mesh | Reade | bonechar10x28 | charcoal for fecal-cultures (alternative to the above) |
| Coarse micromanipulator | Narishige | MMN-1 | coarse micromanipulator |
| Corning Costar Spin-X centrifuge tube filters | Fisher | 07-200-385 | microfilter column |
| Cover glass, 48 x 60 mm, No. 1 thickness | Brain Research Lab | 4860-1 | coverslips (48 x 60 mm) |
| Deep Petri dishes, heavy version with 6 vents, 100 mm diameter | VWR | 82050-918 | 10 cm Petri dishes (for fecal-charcoal cultures) |
| Eisco retort base w/ rod | Fisher | 12-000-101 | stand for Baermann apparatus |
| Eppendorf FemtoJet microinjector microloader tips | VWR | 89009-310 | for filling microinjection needles |
| Fisherbrand absorbent underpads | Fisher | 14-206-62 | bench paper (for prepping) |
| Fisherbrand Cast-Iron Rings | Fisher | 14-050CQ | Baermann o-ring |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for mixing) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for catch bucket/water bucket) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (x2) (to make holder) |
| Gorilla epoxie in syringe | McMaster-Carr | 7541A51 | glue (to attach tubing) |
| Halocarbon oil 700 | Sigma-Aldrich | H8898-50ML | halocarbon oil |
| High-temperature silicone rubber tubing for food and beverage, 1/2" ID, 5/8" OD | McMaster-Carr | 3038K24 | tubing (for funnel) |
| KIMAX funnels, long stem, 60° Angle, Kimble Chase | VWR | 89001-414 | Baermann funnel |
| Kimberly-Clark Professional Kimtech Science benchtop protectors | Fisher | 15-235-101 | bench paper (for prepping) |
| Leica stereomicroscope with fluorescence | Leica | M165 FC | GFP stereomicroscope for identifying and sorting transgenic worms |
| microINJECTOR brass straight arm needle-holder | Tritech | MINJ-4 | microinjection needle holder |
| microINJECTOR system | Tritech | MINJ-1 | microinjection system |
| Mongolian Gerbils | Charles River Laboratories | 213-Mongolian Gerbil | gerbils for maintenance of S. stercoralis, male 4-6 weeks |
| Nasco Whirl-Pak easy-to-close bags, 18 oz | VWR | 11216-776 | Whirl-Pak sample bags |
| Nylon tulle (mesh) | Jo-Ann Fabrics | zprd_14061949a | nylon mesh for Baermann holder |
| Platinum wire, 36 Gauge, per inch | Thomas Scientific | 1233S72 | platinum/iridium wire for worm picks |
| Puritan tongue depressors, 152 mm (L) x 17.5 mm (W) | VWR | 62505-007 | wood sticks (for mixing samples) |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | QIAGEN miniprep kit |
| Rats-Long Evans | Envigo | 140 HsdBlu:LE Long Evans | rats for maintenance of S. ratti, female 4-6 weeks |
| Rats-Sprague Dawley | Envigo | 002 Hsd:Sprague Dawley SD | rats for maintenance of S. ratti, female 4-6 weeks |
| Really Useful Boxes translucent storage boxes with lids, 1.6 L capacity, 7-5/8" x 5-5/16" x 4-5/16" | Office Depot | 452369 | plastic boxes for humidified chamber |
| Shepherd techboard, 8 x 16.5 inches | Newco | 999589 | techboard |
| Stainless steel raised wire floor | Ancare | R20SSRWF | wire cage bottoms |
| StalkMarket compostable cutlery spoons, 6", white, pack of 1,000 | Office Depot | 9587303 | spoons |
| Stender dish, stacking type, 37 x 25 mm | Carolina (Science) | 741012 | watch glasses (small, round) |
| Stereomicroscope | Motic | K-400 LED | dissecting prep scope |
| Storage tote, color clear/white, outside height 4-7/8 in, outside length 13-5/8 in, Sterilite | Grainger | 53GN16 | plastic boxes for humidified chamber |
| Sutter P-30 micropipette puller | Sutter | P-30/P | needle puller with platinum/iridium filament |
| Syracuse watch glasses | Fisher | S34826 | watch glasses (large, round) |
| Thermo Scientific Castaloy fixed-angle clamps | Fisher | 05-769-2Q | funnel clamps (2x) |
| Three-axis hanging joystick oil hydrolic micromanipulator | Narishige | MM0-4 | fine micromanipulator |
| United Mohr pinchcock clamps | Fisher | S99422 | Pinch clamps (2x) |
| Vented, sharp-edge Petri dishes (60 mm diameter) | Tritech Research | T3308P | 6 cm Petri dishes (for small-scale fecal-charcoal cultures) |
| VWR light-duty tissue wipers | VWR | 82003-820 | lining for Baermann holder |
| watch glass, square, 1-5/8 in | Carolina (Science) | 742300 | watch glasses (small, square) |
| Whatman qualitative grade plain circles, grade 1, 5.5 cm diameter | Fisher | 09-805B | filter paper (for 6 cm Petri dishes) |
| Whatman qualitative grade plain circles, grade 1, 9 cm diameter | Fisher | 09-805D | filter paper (for 10 cm Petri dishes) |
| World Precision Instrument borosilicate glass capillary, 1.2 mm x 4 in | Fisher | 50-821-813 | glass capillaries for microinjection needles |
| X-Acto Knives, No. 1 Knife With No. 11 Blade | Office Depot | 238816 | X-Acto knives without blades to hold worm picks |
| Zeiss AxioObserver A1 | Zeiss | n/a | inverted microscope |
Referências
- Krolewiecki, A. J., et al. A public health response against Strongyloides stercoralis: time to look at soil-transmitted helminthiasis in full. PLoS Neglected Tropical Diseases. 7 (5), 2165 (2013).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Castelletto, M. L., Gang, S. S., Hallem, E. A. Recent advances in functional genomics for parasitic nematodes of mammals. Journal of Experimental Biology. 223, 206482 (2020).
- Evans, T. C., et al. Transformation and microinjection. WormBook. , (2006).
- Lok, J. B., Unnasch, T. R., et al. Transgenesis in animal parasitic nematodes: Strongyloides spp. and Brugia spp. WormBook. , (2013).
- Shao, H. G., Li, X. S., Lok, J. B. Heritable genetic transformation of Strongyloides stercoralis by microinjection of plasmid DNA constructs into the male germline. International Journal for Parasitology. 47 (9), 511-515 (2017).
- Schafer, T. W., Skopic, A. Parasites of the small intestine. Current Gastroenterology Reports. 8 (4), 312-320 (2006).
- Stiernagle, T. Maintenance of C. elegans. The C. elegans Research Community, WormBook. , (2006).
- Gang, S. S., et al. Targeted mutagenesis in a human-parasitic nematode. PLoS Pathogens. 13 (10), 1006675 (2017).
- Lok, J. B. Strongyloides stercoralis: a model for translational research on parasitic nematode biology. The C. elegans Research Community, WormBook. , (2007).
- Hawdon, J. M., Schad, G. A. Long-term storage of hookworm infective larvae in buffered saline solution maintains larval responsiveness to host signals. Proceedings of the Helminthological Society of Washington (USA). 58 (1), 140-142 (1991).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
- Junio, A. B., et al. Strongyloides stercoralis: cell- and tissue-specific transgene expression and co-transformation with vector constructs incorporating a common multifunctional 3′ UTR. Experimental Parasitology. 118 (2), 253-265 (2008).
- Gang, S. S., et al. Chemosensory mechanisms of host seeking and infectivity in skin-penetrating nematodes. Proceedings of the National Academy of Sciences of the United States of America. 117 (30), 17913-17923 (2020).
- Bryant, A. S., et al. A critical role for thermosensation in host seeking by skin-penetrating nematodes. Current Biology. 28 (14), 2338-2347 (2018).
- Lok, J. B. Nucleic acid transfection and transgenesis in parasitic nematodes. Parasitology. 139 (5), 574-588 (2012).
- Shao, H., et al. Transposon-mediated chromosomal integration of transgenes in the parasitic nematode Strongyloides ratti and establishment of stable transgenic lines. PLoS Pathogens. 8 (8), 1002871 (2012).
- Lok, J. piggyBac: a vehicle for integrative DNA transformation of parasitic nematodes. Mobile Genetic Elements. 3 (2), 24417 (2013).
- Li, X., et al. Successful transgenesis of the parasitic nematode Strongyloides stercoralis requires endogenous non-coding control elements. International Journal for Parasitology. 36 (6), 671-679 (2006).
- Bryant, A. S., Hallem, E. A. The Wild Worm Codon Adapter: a web tool for automated codon adaptation of transgenes for expression in non-Caenorhabditis nematodes. G3. 3 (7), (2021).
- Crane, M., et al. In vivo measurements reveal a single 5′-intron is sufficient to increase protein expression level in Caenorhabditis elegans. Scientific Reports. 9 (1), 9192 (2019).
- Han, Z., et al. Improving transgenesis efficiency and CRISPR-associated tools through codon optimization and native intron addition in Pristionchus nematodes. Genética. 216 (4), 947-956 (2020).
- Adams, S., Pathak, P., Shao, H., Lok, J. B., Pires-daSilva, A. Liposome-based transfection enhances RNAi and CRISPR-mediated mutagenesis in non-model nematode systems. Scientific Reports. 9 (1), 483 (2019).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Experimental Parasitology. 168, 25-30 (2016).
- Harvey, S. C., Gemmill, A. W., Read, A. F., Viney, M. E. The control of morph development in the parasitic nematode Strongyloides ratti. Proceedings of the Royal Society B: Biological Sciences. 267 (1457), 2057-2063 (2000).
- Kim, A., Pyykko, I. Size matters: versatile use of PiggyBac transposons as a genetic manipulation tool. Molecular and Cellular Biochemistry. 354 (1-2), 301-309 (2011).
- Lok, J. B., Shao, H., Massey, H. C., Li, X. Transgenesis in Strongyloides and related parasitic nematodes: historical perspectives, current functional genomic applications and progress towards gene disruption and editing. Parasitology. 144 (3), 327-342 (2017).
- Farboud, B., Meyer, B. J. Dramatic enhancement of genome editing by CRISPR/Cas9 through improved guide RNA design. Genética. 199 (4), 959-971 (2015).
- Cheong, M. C., et al. Identification of a nuclear receptor/coactivator developmental signaling pathway in the nematode parasite Strongyloides stercoralis. Proceedings of the National Academy of Sciences of the United States of America. 118 (8), 2021864118 (2021).
- Nolan, T. J., Megyeri, Z., Bhopale, V. M., Schad, G. A. Strongyloides stercoralis: the first rodent model for uncomplicated and hyperinfective strongyloidiasis, the Mongolian gerbil (Meriones unguiculatus). Journal of Infectious Diseases. 168 (6), 1479-1484 (1993).
- Li, X., et al. Transgenesis in the parasitic nematode Strongyloides ratti. Molecular and Biochemical Parasitology. 179 (2), 114-119 (2011).
- Viney, M. E. Exploiting the life cycle of Strongyloides ratti. Parasitology Today. 15 (6), 231-235 (1999).
- Stoltzfus, J. D., Massey, H. C., Nolan, T. J., Griffith, S. D., Lok, J. B. Strongyloides stercoralis age-1: a potential regulator of infective larval development in a parasitic nematode. PLoS ONE. 7 (6), 38587 (2012).
- Castelletto, M. L., Massey, H. C., Lok, J. B. Morphogenesis of Strongyloides stercoralis infective larvae requires the DAF-16 ortholog FKTF-1. PLoS Pathogens. 5 (4), 1000370 (2009).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLoS Pathogens. 17 (7), 1009709 (2021).

