Forbedret oliegenvinding ved hjælp af en kombination af biooverfladeaktive stoffer
Summary
Vi illustrerer de metoder, der er involveret i screening og identifikation af det biooverfladeaktive stof, der producerer mikrober. Metoder til kromatografisk karakterisering og kemisk identifikation af de biooverfladeaktive stoffer, bestemmelse af biooverfladeaktivets industrielle anvendelighed til forbedring af restoliegenvinding præsenteres også.
Abstract
Biooverfladeaktive stoffer er overfladeaktive forbindelser, der er i stand til at reducere overfladespændingen mellem to faser af forskellige polariteter. Biooverfladeaktive stoffer har vist sig som lovende alternativer til kemiske overfladeaktive stoffer på grund af mindre toksicitet, høj bionedbrydelighed, miljøkompatibilitet og tolerance over for ekstreme miljøforhold. Her illustrerer vi de metoder, der anvendes til screening af mikrober, der er i stand til at producere biooverfladeaktive stoffer. Det biooverfladeaktive stof, der producerer mikrober, blev identificeret ved hjælp af dråbekollaps, oliespredning og emulsionsindeksassays. Produktionen af biooverfladeaktive biooverflader blev valideret ved at bestemme reduktionen i overfladespændingen af medierne på grund af væksten af de mikrobielle medlemmer. Vi beskriver også de metoder, der er involveret i karakterisering og identifikation af biooverfladeaktive stoffer. Tyndtlagskromatografi af det ekstraherede biooverfladeaktive stof efterfulgt af differentiel farvning af pladerne blev udført for at bestemme arten af det biooverfladeaktive stof. LCMS, 1H NMR og FT-IR blev brugt til kemisk at identificere det biooverfladeaktive stof. Vi illustrerer yderligere metoderne til at evaluere anvendelsen af kombinationen af producerede biooverfladeaktive stoffer til forbedring af restoliegenvinding i en simuleret sandpakningskolonne.
Introduction
Biooverfladeaktive stoffer er de amfipatiske overfladeaktive molekyler produceret af mikroorganismer, der har kapacitet til at reducere overfladen og grænsefladespændingen mellem to faser1. En typisk biooverfladebehandler indeholder en hydrofil del, der normalt består af en sukkerholdighed eller en peptidkæde eller hydrofil aminosyre og en hydrofob del, der består af en mættet eller umættet fedtsyrekæde2. På grund af deres amfipatiske natur samles biooverfladeaktive stoffer ved grænsefladen mellem de to faser og reducerer grænsefladespændingen ved grænsen, hvilket letter spredningen af den ene fase i den anden 1,3. Forskellige typer biooverfladeaktive stoffer, der hidtil er blevet rapporteret, omfatter glycolipider, hvor kulhydrater er forbundet med langkædede alifatiske eller hydroxy-alifatiske syrer via esterbindinger (f.eks. rhamnolipider, trehalolipider og sophorolipider), lipopeptider, hvor lipider er bundet til polypeptidkæder (f.eks. Overfladeaktivin og lichenysin) og polymere biooverfladeaktive stoffer, der normalt består af polysaccharidproteinkomplekser (f.eks. emulsan, liposan, alasan og lipomannan)4. Andre typer biooverfladeaktive stoffer produceret af mikroorganismerne omfatter fedtsyrer, phospholipider, neutrale lipider og partikler biooverfladeaktive stoffer5. Den mest undersøgte klasse af biooverfladeaktive stoffer er glycolipider, og blandt dem er de fleste af undersøgelserne blevet rapporteret om rhamnolipider6. Rhamnolipider indeholder et eller to molekyler rhamnose (som danner den hydrofile del) bundet til et eller to molekyler langkædede fedtsyre (normalt hydroxy-decansyre). Rhamnolipider er primære glycolipider, der først blev rapporteret fra Pseudomonas aeruginosa7.
Biooverfladeaktive stoffer har fået stigende fokus i forhold til deres kemiske modstykker på grund af forskellige unikke og karakteristiske egenskaber, som de tilbyder8. Disse omfatter højere specificitet, lavere toksicitet, større mangfoldighed, let forberedelse, højere bionedbrydelighed, bedre skumdannelse, miljøkompatibilitet og aktivitet under ekstreme forhold9. Strukturel mangfoldighed af biooverfladeaktive stoffer (figur S1) er en anden fordel, der giver dem en fordel i forhold til de kemiske modparter10. De er generelt mere effektive ved lavere koncentrationer, da deres kritiske micellekoncentration (CMC) normalt er flere gange lavere end kemiske overfladeaktive stoffer11. Det er rapporteret, at de er meget termostable (op til 100 °C) og kan tåle højere pH (op til 9) og høje saltkoncentrationer (op til 50 g/l)12 og giver dermed flere fordele i industrielle processer, som kræver udsættelse for ekstreme forhold13. Bionedbrydelighed og lavere toksicitet gør dem velegnede til miljømæssige anvendelser såsom bioremediering. På grund af de fordele, de tilbyder, har de fået øget opmærksomhed i forskellige brancher som fødevare-, landbrugs-, vaskemiddel-, kosmetik- og olieindustrien11. Biooverfladeaktive stoffer har også fået stor opmærksomhed inden for olierensning til fjernelse af olieforurenende stoffer og giftige forurenende stoffer14.
Her rapporterer vi produktion, karakterisering og anvendelse af biooverfladeaktive stoffer produceret af Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 og Paenibacillus sp. IITD108. De trin, der er involveret i screening, karakterisering og anvendelse af en kombination af biooverfladeaktive stoffer til forbedret olieudvinding, er skitseret i figur 1.
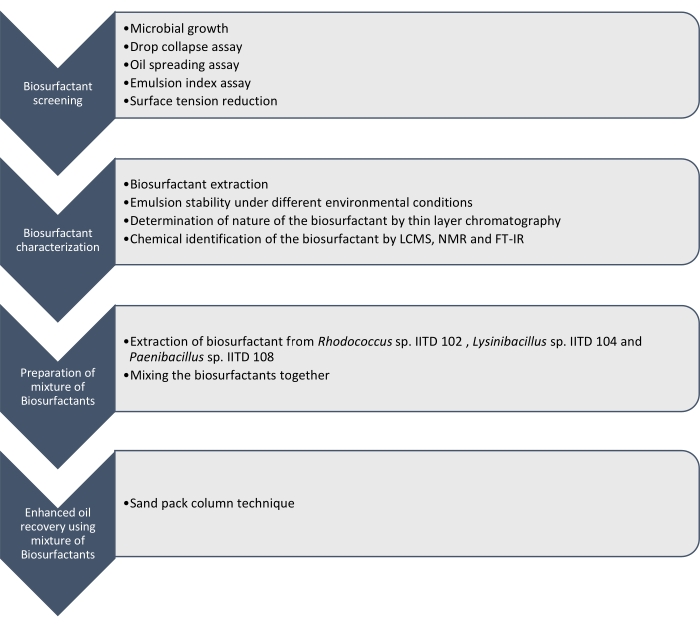
Figur 1: En metode til forbedret oliegenvinding ved hjælp af en kombination af biooverfladeaktive stoffer. Det trinvise arbejdsflow vises. Arbejdet blev udført i fire trin. Først blev de mikrobielle stammer dyrket og screenet til produktion af biooverfladeaktive stoffer ved forskellige assays, som omfattede dråbekollapsassay, oliespredningsassay, emulsionsindeksassay og overfladespændingsmåling. Derefter blev de biooverfladeaktive stoffer ekstraheret fra den cellefri bouillon, og deres natur blev identificeret ved hjælp af tyndtlagskromatografi, og de blev yderligere identificeret ved anvendelse af LCMS, NMR og FT-IR. I det næste trin blev de ekstraherede biooverfladeaktive stoffer blandet sammen, og potentialet i den resulterende blanding til forbedret oliegenvinding blev bestemt ved hjælp af sandpakningskolonneteknikken. Klik her for at se en større version af denne figur.
Screening af disse mikrobielle stammer til fremstilling af biooverfladeaktive stoffer blev udført ved dråbekollaps, oliespredning, emulsionsindeksassay og bestemmelse af reduktion i overfladespændingen af det cellefrie medium på grund af mikrobernes vækst. De biooverfladeaktive stoffer blev ekstraheret, karakteriseret og kemisk identificeret af LCMS, 1H NMR og FT-IR. Endelig blev en blanding af biooverfladeaktive stoffer produceret af disse mikrober fremstillet og blev brugt til at genvinde restolien i en simuleret sandpakningskolonne.
Denne undersøgelse illustrerer kun de metoder, der er involveret i screening, identifikation, strukturel karakterisering og anvendelse af den biooverfladeaktive kombination til forbedring af restoliegenvinding. Det giver ikke en detaljeret funktionel karakterisering af de biooverfladeaktive stoffer, der produceres af de mikrobielle stammer15,16. Forskellige eksperimenter såsom kritisk micellebestemmelse, termogravimetrisk analyse, overfladebefugtelighed og bionedbrydelighed udføres for detaljeret funktionel karakterisering af ethvert biooverfladeaktivt stof. Men da dette papir er et metodepapir, er fokus på screening, identifikation, strukturel karakterisering og anvendelse af den biooverfladeaktive kombination til forbedring af restolieindvinding; disse eksperimenter er ikke medtaget i denne undersøgelse.
Protocol
Representative Results
Discussion
Biooverfladeaktive stoffer er en af de mest alsidige grupper af biologisk aktive komponenter, der bliver attraktive alternativer til kemiske overfladeaktive stoffer. De har en bred vifte af anvendelser i mange brancher såsom vaskemidler, maling, kosmetik, fødevarer, lægemidler, landbrug, olie og vandbehandling på grund af deres bedre befugtningsevne, lavere CMC, diversificerede struktur og miljøvenlighed18. Dette har ført til en øget interesse for at opdage flere mikrobielle stammer, der er…
Declarações
The authors have nothing to disclose.
Acknowledgements
Forfatterne vil gerne takke Institut for Bioteknologi, Indiens regering, for økonomisk støtte.
Materials
| 1 ml pipette | Eppendorf, Germany | G54412G | |
| 1H NMR | Bruker Avance AV-III type spectrometer,USA | ||
| 20 ul pipette | Thermo scientific, USA | H69820 | |
| Autoclave | JAISBO, India | Ser no 5923 | Jain Scientific |
| Blue flame burner | Rocker scientific, Taiwan | dragon 200 | |
| Butanol | GLR inovations, India | GLR09.022930 | |
| C18 column | Agilent Technologies, USA | 770995-902 | |
| Centrifuge | Eppendorf, Germany | 5810R | |
| Chloroform | Merck, India | 1.94506.2521 | |
| Chloroform-d | SRL, India | 57034 | |
| Falcon tubes | Tarsons, India | 546041 | Radiation sterilized polypropylene |
| FT-IR | Thermo Fisher Scientific, USA | Nicolet iS50 | |
| Fume hood | Khera, India | 47408 | Customied |
| glacial acetic acid | Merck, India | 1.93002 | |
| Glass beads | Merck, India | 104014 | |
| Glass slides | Polar industrial Corporation, USA | Blue Star | 75 mm * 25 mm |
| Glass wool | Merk, India | 104086 | |
| Hydrochloric acid | Merck, India | 1003170510 | |
| Incubator | Thermo Scientific, USA | MaxQ600 | Shaking incubator |
| Incubator | Khera, India | Sunbim | |
| Iodine resublimed | Merck, India | 231-442-4 | resublimed Granules |
| K12 –Kruss tensiometer | Kruss Scientific, Germany | K100 | |
| Laminar air flow cabnet | Thermo Scientific, China | 1300 Series A2 | |
| LCMS | Agilent Technologies, USA | 1260 Infinity II | |
| Luria Broth | HIMEDIA, India | M575-500G | Powder |
| Methanol | Merck, India | 107018 | |
| Ninhydrin | Titan Biotech Limited, India | 1608 | |
| p- anisaldehyde | Sigma, USA | 204-602-6 | |
| Petri plate | Tarsons, India | 460090-90 MM | Radiation sterilized polypropylene |
| Saponin | Merck, India | 232-462-6 | |
| Sodium chloride | Merck, India | 231-598-3 | |
| Test tubes | Borosil, India | 9800U06 | Glass tubes |
| TLC plates | Merck, India | 1055540007 | |
| Vortex | GeNei, India | 2006114318 | |
| Water Bath | Julabo, India | SW21C |
Referências
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews. 61 (1), 47-64 (1997).
- Banat, I. M. Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review. Bioresource Technology. 51 (1), 1-12 (1995).
- Singh, A., Van Hamme, J. D., Ward, O. P. Surfactants in microbiology and biotechnology: Part 2. Application aspects. Biotechnology Advances. 25 (1), 99-121 (2007).
- Shah, N., Nikam, R., Gaikwad, S., Sapre, V., Kaur, J. Biosurfactant: types, detection methods, importance and applications. Indian Journal of Microbiology Research. 3 (1), 5-10 (2016).
- McClements, D. J., Gumus, C. E. Natural emulsifiers-Biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance. Advances in Colloid and Interface Science. 234, 3-26 (2016).
- Nguyen, T. T., Youssef, N. H., McInerney, M. J., Sabatini, D. A. Rhamnolipid biosurfactant mixtures for environmental remediation. Water Research. 42 (6-7), 1735-1743 (2008).
- Maier, R. M., Soberon-Chavez, G. Pseudomonas aeruginosa rhamnolipids: biosynthesis and potential applications. Applied Microbiology and Biotechnology. 54 (5), 625-633 (2000).
- Banat, I. M., Makkar, R. S., Cameotra, S. S. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology. 53 (5), 495-508 (2000).
- Mulugeta, K., Kamaraj, M., Tafesse, M., Aravind, J. A review on production, properties, and applications of microbial surfactants as a promising biomolecule for environmental applications. Strategies and Tools for Pollutant Mitigation: Avenues to a Cleaner Environment. , 3-28 (2021).
- Sharma, J., Sundar, D., Srivastava, P. Biosurfactants: Potential agents for controlling cellular communication, motility, and antagonism. Frontiers in Molecular Biosciences. 8, 727070 (2021).
- Vijayakumar, S., Saravanan, V. Biosurfactants-types, sources and applications. Research Journal of Microbiology. 10 (5), 181-192 (2015).
- Curiel-Maciel, N. F., et al. Characterization of enterobacter cloacae BAGM01 producing a thermostable and alkaline-tolerant rhamnolipid biosurfactant from the Gulf of Mexico. Marine Biotechnology. 23 (1), 106-126 (2021).
- Nikolova, C., Gutierrez, T. Biosurfactants and their applications in the oil and gas industry: current state of knowledge and future perspectives. Frontiers in Bioengineering and Biotechnology. 9, (2021).
- Rastogi, S., Tiwari, S., Ratna, S., Kumar, R. Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its synergistic application in biosorption of Pb2. Bioresource Technology Reports. 15, 100706 (2021).
- Zargar, A. N., Lymperatou, A., Skiadas, I., Kumar, M., Srivastava, P. Structural and functional characterization of a novel biosurfactant from Bacillus sp. IITD106. Journal of Hazardous Materials. 423, 127201 (2022).
- Adnan, M., et al. Functional and structural characterization of pediococcus pentosaceus-derived biosurfactant and its biomedical potential against bacterial adhesion, quorum sensing, and biofilm formation. Antibiotics. 10 (11), 1371 (2021).
- Du Nouy, P. L. A new apparatus for measuring surface tension. The Journal of General Physiology. 1 (5), 521-524 (1919).
- Akbari, S., Abdurahman, N. H., Yunus, R. M., Fayaz, F., Alara, O. R. Biosurfactants-a new frontier for social and environmental safety: a mini review. Biotechnology Research and Innovation. 2 (1), 81-90 (2018).
- Bicca, F. C., Fleck, L. C., Ayub, M. A. Z. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Revista de Microbiologia. 30 (3), 231-236 (1999).
- Kuyukina, M. S., et al. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction. Journal of Microbiological Methods. 46 (2), 149-156 (2001).
- Philp, J., et al. Alkanotrophic Rhodococcus ruber as a biosurfactant producer. Applied Microbiology and Biotechnology. 59 (2), 318-324 (2002).
- Mutalik, S. R., Vaidya, B. K., Joshi, R. M., Desai, K. M., Nene, S. N. Use of response surface optimization for the production of biosurfactant from Rhodococcus spp. MTCC 2574. Bioresource Technology. 99 (16), 7875-7880 (2008).
- Shavandi, M., Mohebali, G., Haddadi, A., Shakarami, H., Nuhi, A. Emulsification potential of a newly isolated biosurfactant-producing bacterium, Rhodococcus sp. strain TA6. Colloids and Surfaces B, Biointerfaces. 82 (2), 477-482 (2011).
- White, D., Hird, L., Ali, S. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026. Journal of Applied Microbiology. 115 (3), 744-755 (2013).
- Najafi, A., et al. Interactive optimization of biosurfactant production by Paenibacillus alvei ARN63 isolated from an Iranian oil well. Colloids and Surfaces. B, Biointerfaces. 82 (1), 33-39 (2011).
- Bezza, F. A., Chirwa, E. M. N. Pyrene biodegradation enhancement potential of lipopeptide biosurfactant produced by Paenibacillus dendritiformis CN5 strain. Journal of Hazardous Materials. 321, 218-227 (2017).
- Jimoh, A. A., Lin, J. Biotechnological applications of Paenibacillus sp. D9 lipopeptide biosurfactant produced in low-cost substrates. Applied Biochemistry and Biotechnology. 191 (3), 921-941 (2020).
- Liang, T. -. W., et al. Exopolysaccharides and antimicrobial biosurfactants produced by Paenibacillus macerans TKU029. Applied Biochemistry and Biotechnology. 172 (2), 933-950 (2014).
- Mesbaiah, F. Z., et al. Preliminary characterization of biosurfactant produced by a PAH-degrading Paenibacillus sp. under thermophilic conditions. Environmental Science and Pollution Research. 23 (14), 14221-14230 (2016).
- Quinn, G. A., Maloy, A. P., McClean, S., Carney, B., Slater, J. W. Lipopeptide biosurfactants from Paenibacillus polymyxa inhibit single and mixed species biofilms. Biofouling. 28 (10), 1151-1166 (2012).
- Gudiña, E. J., et al. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil. Microbial Cell Factories. 14 (1), 1-11 (2015).
- Pradhan, A. K., Pradhan, N., Sukla, L. B., Panda, P. K., Mishra, B. K. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9. Bioprocess and Biosystems Engineering. 37 (2), 139-149 (2014).
- Manchola, L., Dussán, J. Lysinibacillus sphaericus and Geobacillus sp biodegradation of petroleum hydrocarbons and biosurfactant production. Remediation Journal. 25 (1), 85-100 (2014).
- Bhardwaj, G., Cameotra, S. S., Chopra, H. K. Biosurfactant from Lysinibacillus chungkukjangi from rice bran oil sludge and potential applications. Journal of Surfactants and Detergents. 19 (5), 957-965 (2016).
- Gaur, V. K., et al. Rhamnolipid from a Lysinibacillus sphaericus strain IITR51 and its potential application for dissolution of hydrophobic pesticides. Bioresource Technology. 272, 19-25 (2019).
- Habib, S., et al. Production of lipopeptide biosurfactant by a hydrocarbon-degrading Antarctic Rhodococcus. International Journal of Molecular Sciences. 21 (17), 6138 (2020).
- Shao, P., Ma, H., Zhu, J., Qiu, Q. Impact of ionic strength on physicochemical stability of o/w emulsions stabilized by Ulva fasciata polysaccharide. Food Hydrocolloids. 69, 202-209 (2017).
- . Overview of DLVO theory Available from: https://archive-ouverte.unige.ch/unige:148595 (2014)
- Kazemzadeh, Y., Ismail, I., Rezvani, H., Sharifi, M., Riazi, M. Experimental investigation of stability of water in oil emulsions at reservoir conditions: Effect of ion type, ion concentration, and system pressure. Fuel. 243, 15-27 (2019).
- Chong, H., Li, Q. Microbial production of rhamnolipids: opportunities, challenges and strategies. Microbial Cell Factories. 16 (1), 1-12 (2017).
- Zeng, G., et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix. Biodegradation. 18 (3), 303-310 (2007).
- Liu, G., et al. Advances in applications of rhamnolipids biosurfactant in environmental remediation: a review. Biotechnology and Bioengineering. 115 (4), 796-814 (2018).
- John, W. C., Ogbonna, I. O., Gberikon, G. M., Iheukwumere, C. C. Evaluation of biosurfactant production potential of Lysinibacillus fusiformis MK559526 isolated from automobile-mechanic-workshop soil. Brazilian Journal of Microbiology. 52 (2), 663-674 (2021).
- Naing, K. W., et al. Isolation and characterization of an antimicrobial lipopeptide produced by Paenibacillus ehimensis MA2012. Journal of Basic Microbiology. 55 (7), 857-868 (2015).
- Wittgens, A., et al. Novel insights into biosynthesis and uptake of rhamnolipids and their precursors. Applied Microbiology and Biotechnology. 101 (7), 2865-2878 (2017).
- Rahman, K., Rahman, T. J., McClean, S., Marchant, R., Banat, I. M. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials. Biotechnology Progress. 18 (6), 1277-1281 (2002).
- Bahia, F. M., et al. Rhamnolipids production from sucrose by engineered Saccharomyces cerevisiae. Scientific Reports. 8 (1), 1-10 (2018).
- Kim, C. H., et al. Desorption and solubilization of anthracene by a rhamnolipid biosurfactant from Rhodococcus fascians. Water Environment Research. 91 (8), 739-747 (2019).
- Nalini, S., Parthasarathi, R. Optimization of rhamnolipid biosurfactant production from Serratia rubidaea SNAU02 under solid-state fermentation and its biocontrol efficacy against Fusarium wilt of eggplant. Annals of Agrarian Science. 16 (2), 108-115 (2018).
- Wang, Q., et al. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnology and Bioengineering. 98 (4), 842-853 (2007).
- Câmara, J., Sousa, M., Neto, E. B., Oliveira, M. Application of rhamnolipid biosurfactant produced by Pseudomonas aeruginosa in microbial-enhanced oil recovery (MEOR). Journal of Petroleum Exploration and Production Technology. 9 (3), 2333-2341 (2019).
- Amani, H., Mehrnia, M. R., Sarrafzadeh, M. H., Haghighi, M., Soudi, M. R. Scale up and application of biosurfactant from Bacillus subtilis in enhanced oil recovery. Applied Biochemistry and Biotechnology. 162 (2), 510-523 (2010).
- Gudiña, E. J., et al. Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation. Bioresource Technology. 177, 87-93 (2015).
- Sun, G., Hu, J., Wang, Z., Li, X., Wang, W. Dynamic investigation of microbial activity in microbial enhanced oil recovery (MEOR). Petroleum Science and Technology. 36 (16), 1265-1271 (2018).
- Jha, S. S., Joshi, S. J., SJ, G. Lipopeptide production by Bacillus subtilis R1 and its possible applications. Brazilian Journal of Microbiology. 47 (4), 955-964 (2016).
- Darvishi, P., Ayatollahi, S., Mowla, D., Niazi, A. Biosurfactant production under extreme environmental conditions by an efficient microbial consortium, ERCPPI-2. Colloids and Surfaces. B, Biointerfaces. 84 (2), 292-300 (2011).
- Al-Wahaibi, Y., et al. Biosurfactant production by Bacillus subtilis B30 and its application in enhancing oil recovery. Colloids and Surfaces. B, Biointerfaces. 114, 324-333 (2014).
- Moutinho, L. F., Moura, F. R., Silvestre, R. C., Romão-Dumaresq, A. S. Microbial biosurfactants: A broad analysis of properties, applications, biosynthesis, and techno-economical assessment of rhamnolipid production. Biotechnology Progress. 37 (2), 3093 (2021).
- Youssef, N., Simpson, D. R., McInerney, M. J., Duncan, K. E. In-situ lipopeptide biosurfactant production by Bacillus strains correlates with improved oil recovery in two oil wells approaching their economic limit of production. International Biodeterioration & Biodegradation. 81, 127-132 (2013).
- Ruckenstein, E., Nagarajan, R. Critical micelle concentration and the transition point for micellar size distribution. The Journal of Physical Chemistry. 85 (20), 3010-3014 (1981).
- de Araujo, L. L., et al. Microbial enhanced oil recovery using a biosurfactant produced by Bacillus safensis isolated from mangrove microbiota-Part I biosurfactant characterization and oil displacement test. Journal of Petroleum Science and Engineering. 180, 950-957 (2019).
- Banat, I. M., De Rienzo, M. A. D., Quinn, G. A. Microbial biofilms: biosurfactants as antibiofilm agents. Applied Microbiology and Biotechnology. 98 (24), 9915-9929 (2014).
- Klosowska-Chomiczewska, I., Medrzycka, K., Karpenko, E. Biosurfactants-biodegradability, toxicity, efficiency in comparison with synthetic surfactants. Research and Application of New Technologies in Wastewater Treatment and Municipal Solid Waste Disposal in Ukraine, Sweden, and Poland. 17, 141-149 (2013).
- Fernandes, P. A. V., et al. Antimicrobial activity of surfactants produced by Bacillus subtilis R14 against multidrug-resistant bacteria. Brazilian Journal of Microbiology. 38 (4), 704-709 (2007).
- Santos, D. K. F., Rufino, R. D., Luna, J. M., Santos, V. A., Sarubbo, L. A. Biosurfactants: multifunctional biomolecules of the 21st century. International Journal of Molecular Sciences. 17 (3), 401 (2016).

