Recuperación mejorada de petróleo utilizando una combinación de biosurfactantes
Summary
Ilustramos los métodos involucrados en el cribado y la identificación de los microbios productores de biosurfactantes. También se presentan métodos para la caracterización cromatográfica y la identificación química de los biosurfactantes, determinando la aplicabilidad industrial del biosurfactante en la mejora de la recuperación de aceite residual.
Abstract
Los biosurfactantes son compuestos tensoactivos capaces de reducir la tensión superficial entre dos fases de diferentes polaridades. Los biosurfactantes han surgido como alternativas prometedoras a los tensioactivos químicos debido a la menor toxicidad, la alta biodegradabilidad, la compatibilidad ambiental y la tolerancia a condiciones ambientales extremas. Aquí, ilustramos los métodos utilizados para la detección de microbios capaces de producir biosurfactantes. Los microbios productores de biosurfactantes se identificaron mediante el colapso de gotas, la propagación del aceite y los ensayos de índice de emulsión. La producción de biosurfactantes se validó determinando la reducción de la tensión superficial del medio debido al crecimiento de los miembros microbianos. También describimos los métodos involucrados en la caracterización e identificación de biosurfactantes. Se realizó cromatografía en capa delgada del biosurfactante extraído seguido de tinción diferencial de las placas para determinar la naturaleza del biosurfactante. LCMS, 1H NMR y FT-IR se utilizaron para identificar químicamente el biosurfactante. Ilustramos además los métodos para evaluar la aplicación de la combinación de biosurfactantes producidos para mejorar la recuperación de aceite residual en una columna de paquete de arena simulada.
Introduction
Los biosurfactantes son las moléculas anfipáticas tensoactivas producidas por microorganismos que tienen la capacidad de reducir la superficie y la tensión interfacial entre dos fases1. Un biosurfactante típico contiene una parte hidrofílica que generalmente se compone de una fracción de azúcar o una cadena peptídica o aminoácido hidrófilo y una parte hidrofóbica que se compone de una cadena de ácidos grasos saturados o insaturados2. Debido a su naturaleza anfipática, los biosurfactantes se ensamblan en la interfaz entre las dos fases y reducen la tensión interfacial en el límite, lo que facilita la dispersión de una fase en la otra 1,3. Varios tipos de biosurfactantes que se han reportado hasta ahora incluyen glicolípidos en los que los carbohidratos están vinculados a ácidos alifáticos o hidroxi-alifáticos de cadena larga a través de enlaces éster (por ejemplo, ramnolípidos, trehalolipípidos y soforolipídicos), lipopéptidos en los que los lípidos se unen a cadenas polipeptídicas (por ejemplo, surfactina y liquenina) y biosurfactantes poliméricos que generalmente se componen de complejos polisacáridos-proteínas (por ejemplo, emulsano, liposan, alasan y lipomanano)4. Otros tipos de biosurfactantes producidos por los microorganismos incluyen ácidos grasos, fosfolípidos, lípidos neutros y biosurfactantes de partículas5. La clase de biosurfactantes más estudiada son los glicolípidos y entre ellos la mayoría de los estudios se han reportado sobre ramnolípidos6. Los ramnolípidos contienen una o dos moléculas de ramnosa (que forman la parte hidrofílica) unidas a una o dos moléculas de ácido graso de cadena larga (generalmente ácido hidroxi-decanoico). Los ramnolípidos son glicolípidos primarios reportados primero a partir de Pseudomonas aeruginosa7.
Los biosurfactantes han ido ganando cada vez más atención en comparación con sus contrapartes químicas debido a varias propiedades únicas y distintivas que ofrecen8. Estos incluyen mayor especificidad, menor toxicidad, mayor diversidad, facilidad de preparación, mayor biodegradabilidad, mejor formación de espuma, compatibilidad ambiental y actividad en condiciones extremas9. La diversidad estructural de los biosurfactantes (Figura S1) es otra ventaja que les da una ventaja sobre las contrapartes químicas10. Generalmente son más efectivos y eficientes a concentraciones más bajas, ya que su concentración crítica de micelas (CMC) suele ser varias veces menor que los tensioactivos químicos11. Se ha informado que son altamente termoestables (hasta 100 °C) y pueden tolerar un pH más alto (hasta 9) y altas concentraciones de sal (hasta 50 g/L)12 , por lo que ofrecen varias ventajas en los procesos industriales, que requieren exposición a condiciones extremas13. La biodegradabilidad y la menor toxicidad los hacen adecuados para aplicaciones ambientales como la biorremediación. Debido a las ventajas que ofrecen, han estado recibiendo una mayor atención en diversas industrias como la industria alimentaria, agrícola, detergente, cosmética y petrolera11. Los biosurfactantes también han ganado mucha atención en la remediación de petróleo para la eliminación de contaminantes del petróleo y contaminantes tóxicos14.
Aquí informamos la producción, caracterización y aplicación de biosurfactantes producidos por Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 y Paenibacillus sp. IITD108. Los pasos involucrados en la detección, caracterización y aplicación de una combinación de biosurfactantes para mejorar la recuperación de petróleo se describen en la Figura 1.
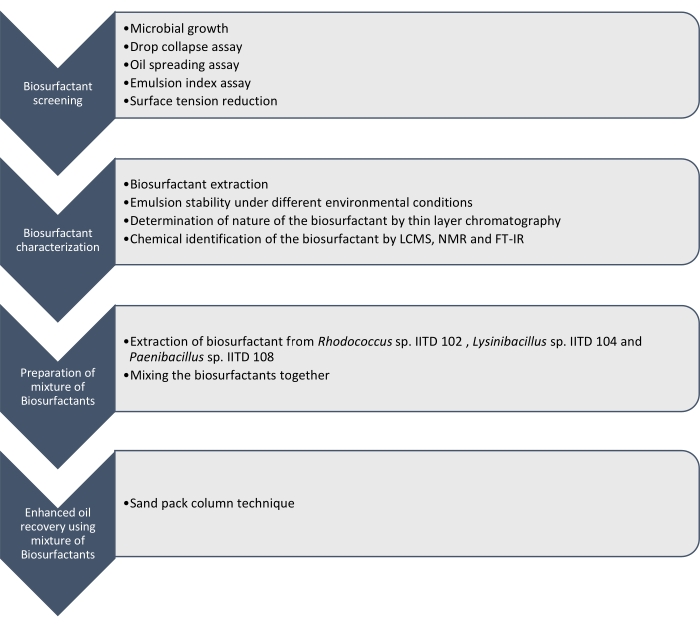
Figura 1: Un método para mejorar la recuperación de petróleo utilizando una combinación de biosurfactantes. Se muestra el flujo de trabajo paso a paso. El trabajo se llevó a cabo en cuatro pasos. Primero, las cepas microbianas fueron cultivadas y examinadas para la producción de biosurfactante mediante varios ensayos, que incluyeron el ensayo de colapso de gotas, el ensayo de propagación de aceite, el ensayo de índice de emulsión y la medición de la tensión superficial. Luego, los biosurfactantes se extrajeron del caldo libre de células y su naturaleza se identificó mediante cromatografía de capa delgada y se identificaron aún más utilizando LCMS, NMR y FT-IR. En el siguiente paso, los biosurfactantes extraídos se mezclaron y se determinó el potencial de la mezcla resultante para mejorar la recuperación de petróleo utilizando la técnica de columna de paquete de arena. Haga clic aquí para ver una versión más grande de esta figura.
El cribado de estas cepas microbianas para producir biosurfactantes se realizó mediante colapso por gota, propagación de aceite, ensayo de índice de emulsión y determinación de la reducción de la tensión superficial del medio libre de células debido al crecimiento de los microbios. Los biosurfactantes fueron extraídos, caracterizados e identificados químicamente por LCMS, RMN 1H y FT-IR. Finalmente, se preparó una mezcla de biosurfactantes producidos por estos microbios y se utilizó para recuperar el aceite residual en una columna de paquete de arena simulada.
El presente estudio solo ilustra los métodos involucrados en la detección, identificación, caracterización estructural y aplicación de la combinación de biosurfactantes para mejorar la recuperación de petróleo residual. No proporciona una caracterización funcional detallada de los biosurfactantes producidos por las cepas microbianas15,16. Se realizan varios experimentos, como la determinación crítica de micelas, el análisis termogravimétrico, la humectabilidad de la superficie y la biodegradabilidad para la caracterización funcional detallada de cualquier biosurfactante. Pero dado que este documento es un documento de métodos, el enfoque está en la detección, identificación, caracterización estructural y aplicación de la combinación de biosurfactantes para mejorar la recuperación de petróleo residual; estos experimentos no se han incluido en este estudio.
Protocol
Representative Results
Discussion
Los biosurfactantes son uno de los grupos más versátiles de componentes biológicamente activos que se están convirtiendo en alternativas atractivas a los tensioactivos químicos. Tienen una amplia gama de aplicaciones en numerosas industrias, como detergentes, pinturas, cosméticos, alimentos, productos farmacéuticos, agricultura, petróleo y tratamiento de agua debido a su mejor humectabilidad, menor CMC, estructura diversificada y respeto al medio ambiente18. Esto ha llevado a un mayor inte…
Declarações
The authors have nothing to disclose.
Acknowledgements
Los autores desean dar las gracias al Departamento de Biotecnología del Gobierno de la India por su apoyo financiero.
Materials
| 1 ml pipette | Eppendorf, Germany | G54412G | |
| 1H NMR | Bruker Avance AV-III type spectrometer,USA | ||
| 20 ul pipette | Thermo scientific, USA | H69820 | |
| Autoclave | JAISBO, India | Ser no 5923 | Jain Scientific |
| Blue flame burner | Rocker scientific, Taiwan | dragon 200 | |
| Butanol | GLR inovations, India | GLR09.022930 | |
| C18 column | Agilent Technologies, USA | 770995-902 | |
| Centrifuge | Eppendorf, Germany | 5810R | |
| Chloroform | Merck, India | 1.94506.2521 | |
| Chloroform-d | SRL, India | 57034 | |
| Falcon tubes | Tarsons, India | 546041 | Radiation sterilized polypropylene |
| FT-IR | Thermo Fisher Scientific, USA | Nicolet iS50 | |
| Fume hood | Khera, India | 47408 | Customied |
| glacial acetic acid | Merck, India | 1.93002 | |
| Glass beads | Merck, India | 104014 | |
| Glass slides | Polar industrial Corporation, USA | Blue Star | 75 mm * 25 mm |
| Glass wool | Merk, India | 104086 | |
| Hydrochloric acid | Merck, India | 1003170510 | |
| Incubator | Thermo Scientific, USA | MaxQ600 | Shaking incubator |
| Incubator | Khera, India | Sunbim | |
| Iodine resublimed | Merck, India | 231-442-4 | resublimed Granules |
| K12 –Kruss tensiometer | Kruss Scientific, Germany | K100 | |
| Laminar air flow cabnet | Thermo Scientific, China | 1300 Series A2 | |
| LCMS | Agilent Technologies, USA | 1260 Infinity II | |
| Luria Broth | HIMEDIA, India | M575-500G | Powder |
| Methanol | Merck, India | 107018 | |
| Ninhydrin | Titan Biotech Limited, India | 1608 | |
| p- anisaldehyde | Sigma, USA | 204-602-6 | |
| Petri plate | Tarsons, India | 460090-90 MM | Radiation sterilized polypropylene |
| Saponin | Merck, India | 232-462-6 | |
| Sodium chloride | Merck, India | 231-598-3 | |
| Test tubes | Borosil, India | 9800U06 | Glass tubes |
| TLC plates | Merck, India | 1055540007 | |
| Vortex | GeNei, India | 2006114318 | |
| Water Bath | Julabo, India | SW21C |
Referências
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews. 61 (1), 47-64 (1997).
- Banat, I. M. Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review. Bioresource Technology. 51 (1), 1-12 (1995).
- Singh, A., Van Hamme, J. D., Ward, O. P. Surfactants in microbiology and biotechnology: Part 2. Application aspects. Biotechnology Advances. 25 (1), 99-121 (2007).
- Shah, N., Nikam, R., Gaikwad, S., Sapre, V., Kaur, J. Biosurfactant: types, detection methods, importance and applications. Indian Journal of Microbiology Research. 3 (1), 5-10 (2016).
- McClements, D. J., Gumus, C. E. Natural emulsifiers-Biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance. Advances in Colloid and Interface Science. 234, 3-26 (2016).
- Nguyen, T. T., Youssef, N. H., McInerney, M. J., Sabatini, D. A. Rhamnolipid biosurfactant mixtures for environmental remediation. Water Research. 42 (6-7), 1735-1743 (2008).
- Maier, R. M., Soberon-Chavez, G. Pseudomonas aeruginosa rhamnolipids: biosynthesis and potential applications. Applied Microbiology and Biotechnology. 54 (5), 625-633 (2000).
- Banat, I. M., Makkar, R. S., Cameotra, S. S. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology. 53 (5), 495-508 (2000).
- Mulugeta, K., Kamaraj, M., Tafesse, M., Aravind, J. A review on production, properties, and applications of microbial surfactants as a promising biomolecule for environmental applications. Strategies and Tools for Pollutant Mitigation: Avenues to a Cleaner Environment. , 3-28 (2021).
- Sharma, J., Sundar, D., Srivastava, P. Biosurfactants: Potential agents for controlling cellular communication, motility, and antagonism. Frontiers in Molecular Biosciences. 8, 727070 (2021).
- Vijayakumar, S., Saravanan, V. Biosurfactants-types, sources and applications. Research Journal of Microbiology. 10 (5), 181-192 (2015).
- Curiel-Maciel, N. F., et al. Characterization of enterobacter cloacae BAGM01 producing a thermostable and alkaline-tolerant rhamnolipid biosurfactant from the Gulf of Mexico. Marine Biotechnology. 23 (1), 106-126 (2021).
- Nikolova, C., Gutierrez, T. Biosurfactants and their applications in the oil and gas industry: current state of knowledge and future perspectives. Frontiers in Bioengineering and Biotechnology. 9, (2021).
- Rastogi, S., Tiwari, S., Ratna, S., Kumar, R. Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its synergistic application in biosorption of Pb2. Bioresource Technology Reports. 15, 100706 (2021).
- Zargar, A. N., Lymperatou, A., Skiadas, I., Kumar, M., Srivastava, P. Structural and functional characterization of a novel biosurfactant from Bacillus sp. IITD106. Journal of Hazardous Materials. 423, 127201 (2022).
- Adnan, M., et al. Functional and structural characterization of pediococcus pentosaceus-derived biosurfactant and its biomedical potential against bacterial adhesion, quorum sensing, and biofilm formation. Antibiotics. 10 (11), 1371 (2021).
- Du Nouy, P. L. A new apparatus for measuring surface tension. The Journal of General Physiology. 1 (5), 521-524 (1919).
- Akbari, S., Abdurahman, N. H., Yunus, R. M., Fayaz, F., Alara, O. R. Biosurfactants-a new frontier for social and environmental safety: a mini review. Biotechnology Research and Innovation. 2 (1), 81-90 (2018).
- Bicca, F. C., Fleck, L. C., Ayub, M. A. Z. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Revista de Microbiologia. 30 (3), 231-236 (1999).
- Kuyukina, M. S., et al. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction. Journal of Microbiological Methods. 46 (2), 149-156 (2001).
- Philp, J., et al. Alkanotrophic Rhodococcus ruber as a biosurfactant producer. Applied Microbiology and Biotechnology. 59 (2), 318-324 (2002).
- Mutalik, S. R., Vaidya, B. K., Joshi, R. M., Desai, K. M., Nene, S. N. Use of response surface optimization for the production of biosurfactant from Rhodococcus spp. MTCC 2574. Bioresource Technology. 99 (16), 7875-7880 (2008).
- Shavandi, M., Mohebali, G., Haddadi, A., Shakarami, H., Nuhi, A. Emulsification potential of a newly isolated biosurfactant-producing bacterium, Rhodococcus sp. strain TA6. Colloids and Surfaces B, Biointerfaces. 82 (2), 477-482 (2011).
- White, D., Hird, L., Ali, S. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026. Journal of Applied Microbiology. 115 (3), 744-755 (2013).
- Najafi, A., et al. Interactive optimization of biosurfactant production by Paenibacillus alvei ARN63 isolated from an Iranian oil well. Colloids and Surfaces. B, Biointerfaces. 82 (1), 33-39 (2011).
- Bezza, F. A., Chirwa, E. M. N. Pyrene biodegradation enhancement potential of lipopeptide biosurfactant produced by Paenibacillus dendritiformis CN5 strain. Journal of Hazardous Materials. 321, 218-227 (2017).
- Jimoh, A. A., Lin, J. Biotechnological applications of Paenibacillus sp. D9 lipopeptide biosurfactant produced in low-cost substrates. Applied Biochemistry and Biotechnology. 191 (3), 921-941 (2020).
- Liang, T. -. W., et al. Exopolysaccharides and antimicrobial biosurfactants produced by Paenibacillus macerans TKU029. Applied Biochemistry and Biotechnology. 172 (2), 933-950 (2014).
- Mesbaiah, F. Z., et al. Preliminary characterization of biosurfactant produced by a PAH-degrading Paenibacillus sp. under thermophilic conditions. Environmental Science and Pollution Research. 23 (14), 14221-14230 (2016).
- Quinn, G. A., Maloy, A. P., McClean, S., Carney, B., Slater, J. W. Lipopeptide biosurfactants from Paenibacillus polymyxa inhibit single and mixed species biofilms. Biofouling. 28 (10), 1151-1166 (2012).
- Gudiña, E. J., et al. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil. Microbial Cell Factories. 14 (1), 1-11 (2015).
- Pradhan, A. K., Pradhan, N., Sukla, L. B., Panda, P. K., Mishra, B. K. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9. Bioprocess and Biosystems Engineering. 37 (2), 139-149 (2014).
- Manchola, L., Dussán, J. Lysinibacillus sphaericus and Geobacillus sp biodegradation of petroleum hydrocarbons and biosurfactant production. Remediation Journal. 25 (1), 85-100 (2014).
- Bhardwaj, G., Cameotra, S. S., Chopra, H. K. Biosurfactant from Lysinibacillus chungkukjangi from rice bran oil sludge and potential applications. Journal of Surfactants and Detergents. 19 (5), 957-965 (2016).
- Gaur, V. K., et al. Rhamnolipid from a Lysinibacillus sphaericus strain IITR51 and its potential application for dissolution of hydrophobic pesticides. Bioresource Technology. 272, 19-25 (2019).
- Habib, S., et al. Production of lipopeptide biosurfactant by a hydrocarbon-degrading Antarctic Rhodococcus. International Journal of Molecular Sciences. 21 (17), 6138 (2020).
- Shao, P., Ma, H., Zhu, J., Qiu, Q. Impact of ionic strength on physicochemical stability of o/w emulsions stabilized by Ulva fasciata polysaccharide. Food Hydrocolloids. 69, 202-209 (2017).
- . Overview of DLVO theory Available from: https://archive-ouverte.unige.ch/unige:148595 (2014)
- Kazemzadeh, Y., Ismail, I., Rezvani, H., Sharifi, M., Riazi, M. Experimental investigation of stability of water in oil emulsions at reservoir conditions: Effect of ion type, ion concentration, and system pressure. Fuel. 243, 15-27 (2019).
- Chong, H., Li, Q. Microbial production of rhamnolipids: opportunities, challenges and strategies. Microbial Cell Factories. 16 (1), 1-12 (2017).
- Zeng, G., et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix. Biodegradation. 18 (3), 303-310 (2007).
- Liu, G., et al. Advances in applications of rhamnolipids biosurfactant in environmental remediation: a review. Biotechnology and Bioengineering. 115 (4), 796-814 (2018).
- John, W. C., Ogbonna, I. O., Gberikon, G. M., Iheukwumere, C. C. Evaluation of biosurfactant production potential of Lysinibacillus fusiformis MK559526 isolated from automobile-mechanic-workshop soil. Brazilian Journal of Microbiology. 52 (2), 663-674 (2021).
- Naing, K. W., et al. Isolation and characterization of an antimicrobial lipopeptide produced by Paenibacillus ehimensis MA2012. Journal of Basic Microbiology. 55 (7), 857-868 (2015).
- Wittgens, A., et al. Novel insights into biosynthesis and uptake of rhamnolipids and their precursors. Applied Microbiology and Biotechnology. 101 (7), 2865-2878 (2017).
- Rahman, K., Rahman, T. J., McClean, S., Marchant, R., Banat, I. M. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials. Biotechnology Progress. 18 (6), 1277-1281 (2002).
- Bahia, F. M., et al. Rhamnolipids production from sucrose by engineered Saccharomyces cerevisiae. Scientific Reports. 8 (1), 1-10 (2018).
- Kim, C. H., et al. Desorption and solubilization of anthracene by a rhamnolipid biosurfactant from Rhodococcus fascians. Water Environment Research. 91 (8), 739-747 (2019).
- Nalini, S., Parthasarathi, R. Optimization of rhamnolipid biosurfactant production from Serratia rubidaea SNAU02 under solid-state fermentation and its biocontrol efficacy against Fusarium wilt of eggplant. Annals of Agrarian Science. 16 (2), 108-115 (2018).
- Wang, Q., et al. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnology and Bioengineering. 98 (4), 842-853 (2007).
- Câmara, J., Sousa, M., Neto, E. B., Oliveira, M. Application of rhamnolipid biosurfactant produced by Pseudomonas aeruginosa in microbial-enhanced oil recovery (MEOR). Journal of Petroleum Exploration and Production Technology. 9 (3), 2333-2341 (2019).
- Amani, H., Mehrnia, M. R., Sarrafzadeh, M. H., Haghighi, M., Soudi, M. R. Scale up and application of biosurfactant from Bacillus subtilis in enhanced oil recovery. Applied Biochemistry and Biotechnology. 162 (2), 510-523 (2010).
- Gudiña, E. J., et al. Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation. Bioresource Technology. 177, 87-93 (2015).
- Sun, G., Hu, J., Wang, Z., Li, X., Wang, W. Dynamic investigation of microbial activity in microbial enhanced oil recovery (MEOR). Petroleum Science and Technology. 36 (16), 1265-1271 (2018).
- Jha, S. S., Joshi, S. J., SJ, G. Lipopeptide production by Bacillus subtilis R1 and its possible applications. Brazilian Journal of Microbiology. 47 (4), 955-964 (2016).
- Darvishi, P., Ayatollahi, S., Mowla, D., Niazi, A. Biosurfactant production under extreme environmental conditions by an efficient microbial consortium, ERCPPI-2. Colloids and Surfaces. B, Biointerfaces. 84 (2), 292-300 (2011).
- Al-Wahaibi, Y., et al. Biosurfactant production by Bacillus subtilis B30 and its application in enhancing oil recovery. Colloids and Surfaces. B, Biointerfaces. 114, 324-333 (2014).
- Moutinho, L. F., Moura, F. R., Silvestre, R. C., Romão-Dumaresq, A. S. Microbial biosurfactants: A broad analysis of properties, applications, biosynthesis, and techno-economical assessment of rhamnolipid production. Biotechnology Progress. 37 (2), 3093 (2021).
- Youssef, N., Simpson, D. R., McInerney, M. J., Duncan, K. E. In-situ lipopeptide biosurfactant production by Bacillus strains correlates with improved oil recovery in two oil wells approaching their economic limit of production. International Biodeterioration & Biodegradation. 81, 127-132 (2013).
- Ruckenstein, E., Nagarajan, R. Critical micelle concentration and the transition point for micellar size distribution. The Journal of Physical Chemistry. 85 (20), 3010-3014 (1981).
- de Araujo, L. L., et al. Microbial enhanced oil recovery using a biosurfactant produced by Bacillus safensis isolated from mangrove microbiota-Part I biosurfactant characterization and oil displacement test. Journal of Petroleum Science and Engineering. 180, 950-957 (2019).
- Banat, I. M., De Rienzo, M. A. D., Quinn, G. A. Microbial biofilms: biosurfactants as antibiofilm agents. Applied Microbiology and Biotechnology. 98 (24), 9915-9929 (2014).
- Klosowska-Chomiczewska, I., Medrzycka, K., Karpenko, E. Biosurfactants-biodegradability, toxicity, efficiency in comparison with synthetic surfactants. Research and Application of New Technologies in Wastewater Treatment and Municipal Solid Waste Disposal in Ukraine, Sweden, and Poland. 17, 141-149 (2013).
- Fernandes, P. A. V., et al. Antimicrobial activity of surfactants produced by Bacillus subtilis R14 against multidrug-resistant bacteria. Brazilian Journal of Microbiology. 38 (4), 704-709 (2007).
- Santos, D. K. F., Rufino, R. D., Luna, J. M., Santos, V. A., Sarubbo, L. A. Biosurfactants: multifunctional biomolecules of the 21st century. International Journal of Molecular Sciences. 17 (3), 401 (2016).

