חקר האינטראקציה הביומולקולרית בין המלווה המולקולרי Hsp90 לבין חלבון הלקוח שלו Kinase Cdc37 באמצעות טכנולוגיית ביוסנסינג בעלת אפקט שדה
Summary
ביוסנסינג של אפקט שדה (FEB) היא טכניקה נטולת תוויות לאיתור אינטראקציות ביומולקולריות. הוא מודד את הזרם החשמלי דרך הביו-סנסור של הגרפן שאליו משותקות מטרות הקשירה. טכנולוגיית FEB שימשה להערכת אינטראקציות ביומולקולריות בין Hsp90 ל-Cdc37 וזוהתה אינטראקציה חזקה בין שני החלבונים.
Abstract
אינטראקציות ביומולקולריות ממלאות תפקידים רב-תכליתיים בתהליכים תאיים רבים על-ידי ויסות ותיאום של אירועים ביולוגיים רלוונטיים מבחינה תפקודית. ביו-מולקולות כגון חלבונים, פחמימות, ויטמינים, חומצות שומן, חומצות גרעין ואנזימים הם אבני בניין בסיסיות של יצורים חיים; הם מתכנסים לרשתות מורכבות במערכות ביולוגיות כדי לסנכרן מספר עצום של אירועי חיים. חלבונים בדרך כלל משתמשים ברשתות אינטראקציה מורכבות כדי לבצע את תפקידיהם; לפיכך חובה להעריך אינטראקציות כאלה כדי לפענח את חשיבותן בתאים הן ברמת התא והן ברמת האורגניזם. לקראת מטרה זו, אנו מציגים טכנולוגיה המתפתחת במהירות, ביוסנסינג בעל אפקט שדה (FEB), כדי לקבוע אינטראקציות ביומולקולריות ספציפיות. FEB היא טכניקת זיהוי ביומולקולרית, נטולת תוויות ואמינה לקביעת אינטראקציות ספציפיות ומשתמשת בביו-סנסורים מבוססי אלקטרוניקה באיכות גבוהה. טכנולוגיית FEB יכולה לנטר אינטראקציות בטווח הננו-מולארי בשל הננו-חומרים הניתנים להתאמה ביולוגית המשמשים על פני השטח של הביו-סנסור שלה. כהוכחת היתכנות, הוברה האינטראקציה בין חלבון-חלבון (PPI) בין חלבון הלם חום 90 (Hsp90) לבין מחזור חלוקת התא 37 (Cdc37). Hsp90 הוא מלווה מולקולרי תלוי ATP הממלא תפקיד חיוני בקיפול, יציבות, התבגרות ובקרת איכות של חלבונים רבים, ובכך מווסת פונקציות תאיות חיוניות מרובות. Cdc37 נחשב למלווה מולקולרי ספציפי לחלבון קינאז, מכיוון שהוא מזהה ומגייס באופן ספציפי קינאזות חלבונים ל-Hsp90 כדי לווסת את מסלולי התמרת האותות במורד הזרם. ככזה, Cdc37 נחשב למלווה משותף של Hsp90. מסלול המלווה-קינאז (קומפלקס Hsp90/Cdc37) מופעל יתר על המידה בממאירות מרובה המקדמת את צמיחת התאים; לכן, זהו יעד פוטנציאלי לטיפול בסרטן. המחקר הנוכחי מדגים את היעילות של טכנולוגיית FEB באמצעות מערכת המודל Hsp90/Cdc37. FEB זיהה PPI חזק בין שני החלבונים (ערכי KD של 0.014 μM, 0.053 μM ו-0.072 μM בשלושה ניסויים בלתי תלויים). לסיכום, FEB היא פלטפורמת זיהוי PPI ללא תווית וחסכונית, המציעה מדידות מהירות ומדויקות.
Introduction
אינטראקציות ביומולקולריות:
חלבונים הם חלקים חיוניים של אורגניזמים ומשתתפים במסלולים מולקולריים רבים כגון חילוף חומרים של תאים, מבנה התא, איתות תאים, תגובות חיסוניות, הידבקות תאים ועוד. בעוד שחלבונים מסוימים מבצעים את תפקידם באופן עצמאי, רוב החלבונים מקיימים אינטראקציה עם חלבונים אחרים באמצעות ממשק מקשר כדי לתאם פעילות ביולוגית תקינה1.
ניתן לסווג אינטראקציות ביומולקולריות בעיקר על סמך המאפיינים המבניים והתפקודיים המובהקים של חלבונים המעורבים2, למשל, בהתבסס על משטחי החלבון, היציבות המורכבת או ההתמדה של אינטראקציות3. זיהוי חלבונים חיוניים ותפקידם באינטראקציות ביומולקולריות הוא חיוני להבנת מנגנונים ביוכימיים ברמה המולקולרית4. נכון לעכשיו, ישנן גישות שונות לזיהוי אינטראקציות אלה5: in vitro6, בסיליקו7, בתאים חיים8, ex vivo9, ו in vivo10 כאשר לכל אחד מהם יש חוזקות וחולשות משלו.
מבחני in vivo מבוצעים תוך שימוש בחיה כולה ככלי ניסיוני11, ומבחניה- ex vivo מבוצעים על תמציות רקמה או על איברים שלמים (למשל, לב, מוח, כבד) בסביבה חיצונית מבוקרת על ידי מתן שינויים מינימליים בתנאים טבעיים. היישום הנפוץ ביותר של מחקרי in vivo ו – ex vivo הוא להעריך את הפרמקוקינטיקה, הפרמקודינמיקה והשפעות הרעילות של חומרים פרמקולוגיים פוטנציאליים לפני ניסויים בבני אדם על ידי הבטחת הבטיחות והיעילות הכוללות שלהם12.
ניתן לזהות אינטראקציות ביומולקולריות גם בתוך תאים חיים. הדמיית תאים חיים מאפשרת לנו לצפות באינטראקציות דינמיות בזמן שהם מבצעים את התגובות של מסלול ביוכימי מסוים13. יתר על כן, טכניקות זיהוי, כגון ביולומינסנציה או העברת אנרגיית תהודה פלואורסצנטית, יכולות לספק מידע על היכן ומתי אינטראקציות אלה מתרחשות בתוך תא14. אף על פי שזיהוי בתאים חיים מציע פרטים חיוניים, מתודולוגיות זיהוי אלה מסתמכות על אופטיקה ותוויות, שייתכן שאינן משקפות את הביולוגיה המקורית; הם גם פחות מבוקרים משיטות במבחנה ודורשים מומחיות מיוחדת כדי לבצע15.
השיטות החישוביות של in silico משמשות בעיקר לסינון בקנה מידה גדול של מולקולות מטרה לפני הניסויים במבחנה . שיטות חיזוי חישוביות, מסדי נתונים מבוססי מחשב, עגינה מולקולרית, יחסי מבנה-פעילות כמותיים וגישות סימולציה אחרות של דינמיקה מולקולרית הם בין המבוססים היטב בכלי סיליקו 16. בהשוואה לטכניקות ניסיוניות מייגעות, הכלים בסיליקו יכולים בקלות לבצע תחזיות עם רגישות גבוהה, אך עם דיוק מופחת בביצועי החיזוי17.
בדיקות במבחנה מבוצעות עם מיקרואורגניזמים או מולקולות ביולוגיות מחוץ להקשר הביולוגי הסטנדרטי שלהם. הצגת אינטראקציות ביומולקולריות באמצעות שיטות במבחנה היא קריטית להבנת תפקודי החלבון והביולוגיה שמאחורי הרשת המורכבת של תפקוד התאים. מתודולוגיית הבדיקה המועדפת נבחרת על פי התכונות הפנימיות של החלבון, הערכים הקינטיים והאופן והעוצמה של האינטראקציות18,19.
האינטראקציה Hsp90/Cdc37:
מסלול המלווה-קינאז, המחבר בין Hsp90 ל-Cdc37, הוא מטרה טיפולית מבטיחה בביולוגיה של הגידול20. Hsp90 ממלא תפקיד מרכזי בבקרת מחזור התא, בהרכבת חלבונים, בהישרדות התאים ובמסלולי איתות. חלבונים המסתמכים על Hsp90 לצורך תפקודם מועברים ל-Hsp90 לצורך קומפלקסציה באמצעות מלווה משותף, כגון Cdc37. קומפלקס Hsp90/Cdc37 שולט בקיפול של רוב החלבון קינאזות ומשמש כמרכז לשלל רשתות איתותתוך-תאיות 21. זוהי מטרה אנטי-סרטנית מבטיחה בשל הביטוי המוגבה שלה בממאירות שונות, כולל לוקמיה מיאלובלסטית חריפה, מיאלומה נפוצה וקרצינומה הפטוצלולרית22,23.
טכניקות נפוצות לזיהוי אינטראקציה ביומולקולרית במבחנה
Co-immunoprecipitation (co-IP) היא טכניקה המסתמכת על ספציפיות אנטיגן-נוגדנים כדי לזהות אינטראקציות רלוונטיות ביולוגית24. החיסרון העיקרי של שיטה זו הוא חוסר היכולת שלה לזהות אינטראקציות בעלות זיקה נמוכה וערכים קינטיים24. שיטות ביופיזיות כגון קלורימטריה איזותרמית של טיטרציה (ITC), תהודת פלסמון פני השטח (SPR), אינטרפרומטריה ביו-שכבתית (BLI) וטכנולוגיית FEB עדיפות לקביעת הערכים הקינטיים.
ITC היא שיטת זיהוי ביו-פיזיקלית המבוססת על קביעת אנרגיית קשירת יחד עם ניתוח תרמודינמיקה מלא לאפיון אינטראקציות ביומולקולריות25. היתרון העיקרי של ITC הוא שהוא אינו דורש כל תיוג או קיבוע של חלבון המטרה. הקשיים העיקריים שבהם נתקל ITC הם הריכוז הגבוה של חלבון המטרה הנדרש לניסוי אחד והקושי לנתח קומפלקסים לא קוולנטיים עקב אנתלפיות קישור קטנות26. גם SPR וגם BLI הן טכניקות ביופיזיות נטולות תוויות המסתמכות על אימוביליזציה של מולקולת המטרה על משטח החיישנים, ולאחר מכן זריקות של האנליט מעל המטרה המשותקת27,28. ב- SPR, שינויים במקדם השבירה במהלך אינטראקציות ביומולקולריות נמדדים27; ב-BLI, ההתאבכות באור המוחזר נרשמת בזמן אמת כשינוי באורך הגל כפונקציה של הזמן28. גם SPR וגם BLI חולקים יתרונות משותפים של הצעת יכולות ספציפיות, רגישות וזיהוי גבוהות29. בשתי השיטות, חלבון המטרה משותק על משטחי ביוסנסור, ולכן, ייתכן שיש אובדן מסוים של הקונפורמציה הטבעית של המטרה, מה שמקשה על הבחנה בין אינטראקציות ספציפיות לעומת לא ספציפיות30. BLI משתמשת בביו-סנסורים חד-פעמיים חד-פעמיים יקרים כדי לשתק את המטרה, ולכן היא טכניקה יקרה31. בהשוואה לכלי זיהוי ביומולקולריים מבוססים אלה, טכנולוגיית FEB מציעה פלטפורמה אמינה ונטולת תוויות על ידי שימוש בריכוזי ננומולארים נמוכים לזיהוי ביומולקולרי בזמן אמת עם אפיון קינטי. טכנולוגיית FEB גם מתגברת על האתגרים המבעבעים העומדים בפני ITC והיא חסכונית יותר בהשוואה ל- SPR או BLI.
ביוסנסורים מבוססי טרנזיסטור בעל אפקט שדה (FET) הוא תחום מתפתח לאיתור אינטראקציות ביומולקולריות על ידי הצעת יישומים ביו-רפואיים מגוונים. במערכת FET, מטרות משותקות לשבבי הביו-סנסור ואינטראקציות מזוהות על ידי שינויים בהולכה32. התכונה הייחודית שיש לקחת בחשבון בפיתוח ביוסנסור אלקטרוני יעיל היא התכונות הפיזיקוכימיות כגון האופי המוליך למחצה והיציבות הכימית של חומר הציפוי המשמש לייצור משטח החיישן33. חומרים קונבנציונליים כמו סיליקון המשמש ל-FET הגבילו את הרגישות של חיישנים משום שהם דורשים שכבות תחמוצת דחוקות בין תעלת הטרנזיסטור לבין סביבה מסוימת לתפקוד תקיןשל 34. יתר על כן, טרנזיסטורים של סיליקון רגישים לסביבות מלח גבוהות, ובכך מקשים על מדידת אינטראקציות ביולוגיות בסביבתם הטבעית. הביוסנסור מבוסס הגרפן מוצג כחלופה מכיוון שהוא מציע יציבות כימית מעולה ושדה חשמלי. מאחר שגרפן הוא שכבה אטומית יחידה של פחמן, הוא גם רגיש ביותר כמוליכה למחצה וגם תואם כימית לתמיסות ביולוגיות; שתי התכונות הללו רצויות כדי ליצור ביוסנסורים אלקטרוניים תואמים35. פוטנציאל ההעמסה האולטרה-גבוה המדהים של ביו-מולקולות המוצע על ידי ביוסנסורים מצופים גרפן מוביל לפיתוח טכנולוגיית FEB מבוססת-גרפן.
עקרון טכנולוגיית FEB: FEB היא טכניקת זיהוי ביומולקולרית נטולת תוויות המודדת את הזרם החשמלי דרך הביו-סנסור של הגרפן שאליו משותקות מטרות הקישור. אינטראקציות בין החלבון המשותק לבין האנליט גורמות לשינויים בזרם המנוטרים בזמן אמת, ומאפשרים מדידות קינטיות מדויקות36.
מכשור: מערכת FEB כוללת שבב חיישן טרנזיסטור בעל אפקט שדה גרפן (gFET) וקורא אלקטרוני שמפעיל מתח קבוע לאורך כל הניסוי (איור 1). האנליט מיושם בתמיסה על חלבון המטרה המשותק על פני השטח של הביו-סנסור. כאשר מתרחשת אינטראקציה, שינוי בזרם נמדד ומתועד בזמן אמת. ככל שריכוז האנליטים עולה, גם החלק של האנליט המאוגד יגדל, מה שיגרום לחילופים גבוהים יותר בזרם. באמצעות תוכנת הניתוח האוטומטית המסופקת עם המכשיר (טבלת החומרים), I-Response נמדדת ומתועדת במונחים של יחידות ביוסנסינג (BU)37. I-Response מוגדר כשינוי בזרם (I) באמצעות שבב הביו-סנסור הנמדד בזמן אמת על סמך האינטראקציה של המטרה המשותקת עם האנליט. תוכנת הניתוח האוטומטית FEB יכולה לנתח הן את ה-I-Response והן את ה-C-Response לאירועי אינטראקציה דינמיים, כאשר ה-C-Response מתעד את השינויים בקיבוליות (C). הווריאציות הן ב-I-Response והן ב-C-Response מתאימות ישירות לשבריר של האנליט המאוגד וניתן לנתח אותן עוד יותר כדי ליצור ערכי KD . העדפת ברירת המחדל של תוכנת הניתוח האוטומטית היא I-Response.
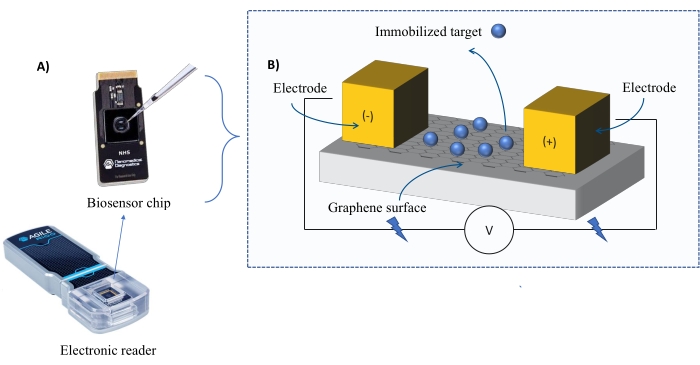
איור 1: סקירה כללית של מערך הניסוי. (B) סקירה כללית של רכיבי השבב. השבב מחובר לשתי אלקטרודות המספקות זרם למערכת. פני השטח של השבב מכוסים בגרפן, שכאשר הוא מופעל יכול לקשור את המטרה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
מתודולוגיה:
בתחילה, שבב הביוסנסור המופעל מוכנס למכשיר FEB (איור 1) ולאחר מכן ביצוע השלבים המתוארים להלן: (1) כיול: (1) כיול: הניסוי מתחיל בכיול המערכת באמצעות 1x מי מלח עם מאגר פוספט (PBS; pH = 7.4) כדי ליצור את תגובת שיווי המשקל הבסיסית. (2) שיוך: האנליט מוצג בשבב, וה-I-Response מנוטר עד להגשמת רוויית הקשירה. (3) דיסוציאציה: האנליט מנותק באמצעות 1x PBS. (4) התחדשות: שרידי האנליט מוסרים באמצעות 1x PBS. (5) כביסה: בסך הכל חמש שטיפות מבוצעות באמצעות 1x PBS להסרה יסודית של האנליטים הכבולים והלא מאוגדים מהשבב.
ניתוח:
ניתוח הנתונים מתבצע באמצעות התוכנה האוטומטית לחלוטין המסופקת עם המכשיר. תוכנת הניתוח האוטומטית יוצרת עלילת היל פיט עם ערך KD . עלילת ההתאמה של היל מתארת את הקשר של אנליט לחלבון המטרה כפונקציה של ריכוזי אנליטים. הריכוז שבו מושגת תגובה חצי מקסימלית הוא פרופורציונלי לערך KD . ערך KD נמוך מייצג זיקת קשירה גבוהה ולהיפך.
כדי לאמת את הנתונים המתקבלים מניסוי FEB, תגובות I מופקות מכל נקודת קריאה עבור כל ריכוז אנאליטים באמצעות תוכנת סקירת/ייצוא הנתונים וניתן לייצא אותן לתוכנות ניתוח סטטיסטיות אחרות (ראה טבלת חומרים) כפי שיוסבר להלן.
Protocol
Representative Results
Discussion
במחקר זה הוערכה ההיתכנות של שימוש בטכנולוגיית FEB (גישת אפיון קינטי בזמן אמת) כדי לקבוע את האינטראקציה הביומולקולרית בין Hsp90 ל-Cdc37. ניסוי החקר הראשוני (הניסוי הראשון) הציע כי בחירת ריכוזי האנליטים הנכונים היא חלק קריטי בניסוי וכי יש לתכנן את הניסוי על ידי הכללת נקודות ריכוז מעל ומתחת לערך K…
Declarações
The authors have nothing to disclose.
Acknowledgements
מחקר זה נתמך על ידי מענק מהקרן הדו-לאומית למדע (BSF) ל- S.K.S. ו- N.Q.
Materials
| Automated analysis software | Agile plus software, Cardea (Nanomed) | NA CAS number: NA |
Referred to in the text as the automated analysis software supplied with the instrument. Generates automated analysis. |
| COOH-BPU (Biosensing Processing Unit) | Agile plus software, Cardea (Nanomed) | NA CAS number: NA |
biosensor chip |
| Data review software | Datalign 1.0, Cardea (Nanomed) | NA CAS number: NA |
Referred to as the supplied data review software in the text. Supplied with the instrument and allows to review and export the information data points. |
| Dialysis bag | CelluSep, Membrane filtration products | T2-10-15 CAS number: NA |
T2 tubings (6,000-8,000 MWCO), (10 mm fw, 6.4mm Ø, 0.32ml/cm, 15m) |
| EDC (1-Ethyl-3-(3-dimethylamino propyl) carbodiimide) | Cardea (Nanomed) | EDC160322-02 CAS number: 25952-53-8 |
White powder |
| ITC (Isothermal titration calorimetry) system | Microcal-PEAQ-ITC (Malvern, United Kingdom) | NA CAS number: NA |
|
| MES (2-(N-morpholino) ethane sulfonic acid) buffer | Merck | M3671-50G CAS number: 4432-31-9 |
White powder |
| NHS (N-Hydroxysulfosuccinimide) chips | Cardea (Nanomed) | NA CAS number: NA |
Graphene-based chip |
| PBS (Phosphate-buffered saline) X 10 | Bio-Lab | 001623237500 CAS number: 7758-11-4 |
Liquid transparent solution |
| Pipete | Thermo Scientific | 11855231 CAS number: NA |
Finnpipette F3 5-50 µL, yellow |
| Quench 1 (3.9 mM amino-PEG5-alcohol in 1 X PBS) | Cardea (Nanomed) | 0105-001-002-001 CAS number: NA |
Liquid, transparent solution |
| Quench 2 (1 M ethanolamine (pH=8.5)) | Cardea (Nanomed) | 0105-001-003-001 CAS number: NA |
Liquid, transparent solution |
| Recombinant protein Cdc37 | Abcam | ab256157 CAS number: NA |
|
| Recombinant protein Hsp90 beta | Abcam | ab80033 CAS number: NA |
|
| Spreadsheet | Excel, Microsoft office | NA CAS number: NA |
|
| Statistical software | GraphPad, Prism | NA CAS number: NA |
Referred to as the other statistical software. Sigma plot, phyton or other statistical programes may also be used |
| Sulfo-NHS | Cardea (Nanomed) | NHS160321-07 CAS number: 106627-54-7 |
White powder |
| Tips | Alex red | LC 1093-800-000 CAS number: NA |
Tip 1-200 µl, in bulk, 1,000 pcs |
Referências
- Tuncbag, N., Gursoy, A., Guney, E., Nussinov, R., Keskin, O. Architectures and functional coverage of protein-protein interfaces. Journal of Molecular Biology. 381 (3), 785-802 (2008).
- Berggård, T., Linse, S., James, P. Methods for the detection and analysis of protein–protein interactions. Proteomics. 7 (16), 2833-2842 (2007).
- Magliery, T. J., et al. Detecting protein-protein interactions with a green fluorescent protein fragment reassembly trap: Scope and mechanism. Journal of the American Chemical Society. 127 (1), 146-157 (2005).
- Xing, S., Wallmeroth, N., Berendzen, K. W., Grefen, C. Techniques for the analysis of protein-protein interactions in vivo. Plant Physiology. 171 (2), 727-758 (2016).
- Nguyen, T. N., Goodrich, J. A. Protein-protein interaction assays: Eliminating false positive interactions. Nature Methods. 3 (2), 135-139 (2006).
- Fernández-Suárez, M., Chen, T. S., Ting, A. Y. Protein-protein interaction detection in vitro and in cells by proximity biotinylation. Journal of the American Chemical Society. 130 (29), 9251-9253 (2008).
- Jiang, M., Niu, C., Cao, J., Ni, D. -. A., Chu, Z. In silico-prediction of protein–protein interactions network about MAPKs and PP2Cs reveals a novel docking site variants in Brachypodium distachyon. Scientific Reports. 8 (1), 15083 (2018).
- Yazawa, M., Sadaghiani, A. M., Hsueh, B., Dolmetsch, R. E. Induction of protein-protein interactions in live cells using light. Nature Biotechnology. 27 (10), 941-945 (2009).
- Wang, W., Goodman, M. T. Antioxidant property of dietary phenolic agents in a human LDL-oxidation ex vivo model: Interaction of protein binding activity. Nutrition Research. 19 (2), 191-202 (1999).
- Xing, S., Wallmeroth, N., Berendzen, K. W., Grefen, C. Techniques for the analysis of protein-protein interactions in vivo. Plant Physiology. 171 (2), 727-758 (2016).
- Qvit, N., Disatnik, M. -. H., Sho, E., Mochly-Rosen, D. Selective phosphorylation inhibitor of delta protein kinase C–Pyruvate dehydrogenase kinase protein–protein interactions: Application for myocardial injury in vivo. Journal of the American Chemical Society. 138 (24), 7626-7635 (2016).
- Alam, M. N., Bristi, N. J., Rafiquzzaman, M. Review on in vivo and in vitro methods evaluation of antioxidant activity. Saudi Pharmaceutical Journal. 21 (2), 143-152 (2013).
- Paulmurugan, R., Gambhir, S. S. Novel fusion protein approach for efficient high-throughput screening of small molecule–mediating protein-protein interactions in cells and living animals. Pesquisa do Câncer. 65 (16), 7413-7420 (2005).
- Boute, N., Jockers, R., Issad, T. The use of resonance energy transfer in high-throughput screening: BRET versus FRET. Trends in Pharmacological Sciences. 23 (8), 351-354 (2002).
- Deriziotis, P., Graham, S. A., Estruch, S. B., Fisher, S. E. Investigating protein-protein interactions in live cells using bioluminescence resonance energy transfer. Journal of Visualized Experiments: JoVE. (87), e51438 (2014).
- Ekins, S., Mestres, J., Testa, B. In silico pharmacology for drug discovery: Methods for virtual ligand screening and profiling. British Journal of Pharmacology. 152 (1), 9-20 (2007).
- Valerio, L. G. Application of advanced in silico methods for predictive modeling and information integration. Expert Opinion on Drug Metabolism & Toxicology. 8 (4), 395-398 (2012).
- Piehler, J. New methodologies for measuring protein interactions in vivo and in vitro. Current Opinion in Structural Biology. 15 (1), 4-14 (2005).
- Ideker, T., Sharan, R. Protein networks in disease. Genome Research. 18 (4), 644-652 (2008).
- Lu, H., et al. Recent advances in the development of protein–protein interactions modulators: mechanisms and clinical trials. Signal Transduction and Targeted Therapy. 5 (1), 213 (2020).
- Jarosz, D. Hsp90: A global regulator of the genotype-to-phenotype map in cancers. Advances in Cancer Research. 129, 225-247 (2016).
- Johnson, V. A., Singh, E. K., Nazarova, L. A., Alexander, L. D., McAlpine, S. R. Macrocyclic inhibitors of Hsp90. Current Topics in Medicinal Chemistry. 10 (14), 1380-1402 (2010).
- Mahalingam, D., et al. Targeting HSP90 for cancer therapy. British Journal of Cancer. 100 (10), 1523-1529 (2009).
- Stewart, A., Fisher, R. A. Co-Immunoprecipitation: Isolation of protein signaling complexes from native tissues. Methods in Cell Biology. 112, 33-54 (2012).
- Pierce, M. M., Raman, C. S., Nall, B. T. Isothermal titration calorimetry of protein-protein interactions. Methods. 19 (2), 213-221 (1999).
- Paketurytė, V., et al. Inhibitor binding to carbonic anhydrases by isothermal titration calorimetry. Carbonic Anhydrase as Drug Target. , 79-95 (2019).
- Grote, J., Dankbar, N., Gedig, E., Koenig, S. Surface plasmon resonance/mass spectrometry interface. Analytical Chemistry. 77 (4), 1157-1162 (2005).
- Kumaraswamy, S., Tobias, R. Label-free kinetic analysis of an antibody–antigen interaction using biolayer interferometry. Methods in Molecular Biology. , 165-182 (2015).
- Wallner, J., Lhota, G., Jeschek, D., Mader, A., Vorauer-Uhl, K. Application of bio-layer interferometry for the analysis of protein/liposome interactions. Journal of Pharmaceutical and Biomedical Analysis. 72, 150-154 (2013).
- Singh, A. N., Ramadan, K., Singh, S. Experimental methods to study the kinetics of protein–protein interactions. Advances in Protein Molecular and Structural Biology Methods. , 115-124 (2022).
- Frenzel, D., Willbold, D. Kinetic titration series with biolayer interferometry. PLoS One. 9 (9), 106882 (2014).
- Vu, C. -. A., Chen, W. -. Y. Field-effect transistor biosensors for biomedical applications: Recent advances and future prospects. Sensors. 19 (19), 4214 (2019).
- Bergveld, P. A critical evaluation of direct electrical protein detection methods. Biosensors & Bioelectronics. 6 (1), 55-72 (1991).
- Lowe, B. M., Sun, K., Zeimpekis, I., Skylaris, C. K., Green, N. G. Field-effect sensors – from pH sensing to biosensing: sensitivity enhancement using streptavidin–biotin as a model system. The Analyst. 142 (22), 4173-4200 (2017).
- Goldsmith, B. R., et al. Digital biosensing by foundry-fabricated graphene sensors. Scientific Reports. 9 (1), 434 (2019).
- Afsahi, S., et al. Novel graphene-based biosensor for early detection of Zika virus infection. Biosensors and Bioelectronics. 100, 85-88 (2018).
- Afsahi, S. J., et al. Towards novel graphene-enabled diagnostic assays with improved signal-to-noise ratio. MRS Advances. 2 (60), 3733-3739 (2017).
- Roe, S. M., et al. The mechanism of Hsp90 regulation by the protein kinase-specific cochaperone p50cdc37. Cell. 116 (1), 87-98 (2004).
- Gaiser, A. M., Kretzschmar, A., Richter, K. Cdc37-Hsp90 complexes are responsive to nucleotide-induced conformational changes and binding of further cofactors. The Journal of Biological Chemistry. 285 (52), 40921-40932 (2010).
- Popescu, A. I., Găzdaru, D. M., Chilom, C. G., Bacalum, M. Biophysical interactions: Their paramount importance for life. Romanian Reports in Physics. 65 (3), 1063-1077 (2013).
- Surya, S., Abhilash, J., Geethanandan, K., Sadasivan, C., Haridas, M. A profile of protein-protein interaction: Crystal structure of a lectin-lectin complex. International Journal of Biological Macromolecules. 87, 529-536 (2016).
- Velazquez-Campoy, A., Freire, E. ITC in the post-genomic era…? Priceless. Biophysical Chemistry. 115 (23), 115-124 (2005).
- Concepcion, J., et al. Label-free detection of biomolecular interactions using bioLayer interferometry for kinetic characterization. Combinatorial Chemistry & High Throughput Screening. 12 (8), 791-800 (2009).
- Helmerhorst, E., Chandler, D. J., Nussio, M., Mamotte, C. D. Real-time and label-free bio-sensing of molecular interactions by surface plasmon resonance: A laboratory medicine perspective. The Clinical Biochemist. Reviews. 33 (4), 161-173 (2012).
- Jacob, N. T., et al. Synthetic molecules for disruption of the MYC protein-protein interface. Bioorganic & Medicinal Chemistry. 26 (14), 4234-4239 (2018).

