Explorando la interacción biomolecular entre la chaperona molecular Hsp90 y su proteína quinasa cliente Cdc37 utilizando tecnología de biodetección de efecto de campo
Summary
La biodetección de efectos de campo (FEB) es una técnica sin etiquetas para detectar interacciones biomoleculares. Mide la corriente eléctrica a través del biosensor de grafeno al que se inmovilizan los objetivos de unión. Se utilizó la tecnología FEB para evaluar las interacciones biomoleculares entre Hsp90 y Cdc37 y se detectó una fuerte interacción entre las dos proteínas.
Abstract
Las interacciones biomoleculares desempeñan un papel versátil en numerosos procesos celulares al regular y coordinar eventos biológicos funcionalmente relevantes. Las biomoléculas como proteínas, carbohidratos, vitaminas, ácidos grasos, ácidos nucleicos y enzimas son componentes fundamentales de los seres vivos; se ensamblan en redes complejas en biosistemas para sincronizar una miríada de eventos de la vida. Las proteínas suelen utilizar redes complejas de interactomas para llevar a cabo sus funciones; por lo tanto, es obligatorio evaluar tales interacciones para desentrañar su importancia en las células tanto a nivel celular como de organismo. Hacia este objetivo, introducimos una tecnología rápidamente emergente, la biodetección de efecto de campo (FEB), para determinar interacciones biomoleculares específicas. FEB es una técnica de detección biomolecular confiable y de sobremesa, sin etiquetas para determinar interacciones específicas y utiliza biosensores electrónicos de alta calidad. La tecnología FEB puede monitorear las interacciones en el rango nanomolar debido a los nanomateriales biocompatibles utilizados en su superficie de biosensor. Como prueba de concepto, se dilucidó la interacción proteína-proteína (PPI) entre la proteína de choque térmico 90 (Hsp90) y el ciclo de división celular 37 (Cdc37). Hsp90 es una chaperona molecular dependiente de ATP que desempeña un papel esencial en el plegamiento, la estabilidad, la maduración y el control de calidad de muchas proteínas, regulando así múltiples funciones celulares vitales. Cdc37 se considera una chaperona molecular específica de la proteína quinasa, ya que reconoce y recluta específicamente proteínas quinasas para Hsp90 para regular sus vías de transducción de señales aguas abajo. Como tal, Cdc37 se considera un co-chaperone de Hsp90. La vía chaperona-quinasa (complejo Hsp90/Cdc37) está hiperactivada en múltiples neoplasias malignas que promueven el crecimiento celular; por lo tanto, es un objetivo potencial para la terapia contra el cáncer. El presente estudio demuestra la eficiencia de la tecnología FEB utilizando el sistema modelo Hsp90/Cdc37. FEB detectó un fuerte PPI entre las dos proteínas (valores de KD de 0,014 μM, 0,053 μM y 0,072 μM en tres experimentos independientes). En resumen, FEB es una plataforma de detección de PPI sin etiquetas y rentable, que ofrece mediciones rápidas y precisas.
Introduction
Interacciones biomoleculares:
Las proteínas son partes esenciales de los organismos y participan en numerosas vías moleculares como el metabolismo celular, la estructura celular, la señalización celular, las respuestas inmunes, la adhesión celular y más. Mientras que algunas proteínas realizan su(s) función(es) de forma independiente, la mayoría de las proteínas interactúan con otras proteínas utilizando una interfaz de unión para coordinar la actividad biológica adecuada1.
Las interacciones biomoleculares se pueden clasificar principalmente en función de las distintas características estructurales y funcionales de las proteínas involucradas2, por ejemplo, en función de las superficies de las proteínas, la estabilidad compleja o la persistencia de las interacciones3. La identificación de proteínas esenciales y su papel en las interacciones biomoleculares es vital para comprender los mecanismos bioquímicos a nivel molecular4. Actualmente, existen varios enfoques para detectar estas interacciones5: in vitro6, in silico7, en células vivas8, ex vivo9 e in vivo10, cada una con sus propias fortalezas y debilidades.
Los ensayos in vivo se realizan utilizando todo el animal como herramienta experimental11, ylos ensayos ex vivo se realizan en extractos de tejidos u órganos enteros (por ejemplo, corazón, cerebro, hígado) en un entorno externo controlado proporcionando alteraciones mínimas en condiciones naturales. La aplicación más común de los estudios in vivo y ex vivo es evaluar los efectos farmacocinéticos, farmacodinámicos y de toxicidad de los posibles agentes farmacológicos antes de los ensayos en humanos garantizando su seguridad y eficaciagenerales 12.
Las interacciones biomoleculares también se pueden detectar dentro de las células vivas. Las imágenes de células vivas nos permiten observar interacciones dinámicas a medida que ejecutan las reacciones de una vía bioquímica particular13. Además, las técnicas de detección, como la bioluminiscencia o la transferencia de energía de resonancia de fluorescencia, pueden proporcionar información sobre dónde y cuándo ocurren estas interacciones dentro de la célula14. Aunque la detección en células vivas ofrece detalles cruciales, estas metodologías de detección se basan en ópticas y etiquetas, que pueden no reflejar la biología nativa; también están menos controlados que los métodos in vitro y requieren experiencia especializada para realizar15.
Los métodos computacionales in silico se utilizan principalmente para el cribado a gran escala de moléculas diana antes de los experimentos in vitro . Los métodos de predicción computacional, las bases de datos basadas en computadora, el acoplamiento molecular, las relaciones cuantitativas estructura-actividad y otros enfoques de simulación de dinámica molecular se encuentran entre las herramientas in silico bien establecidas16. En comparación con las laboriosas técnicas experimentales, las herramientas in silico pueden hacer predicciones fácilmente con alta sensibilidad, pero con una precisión reducida en el rendimiento predictivo17.
Los ensayos in vitro se realizan con microorganismos o moléculas biológicas fuera de su contexto biológico estándar. Retratar las interacciones biomoleculares a través de métodos in vitro es fundamental para comprender las funciones de las proteínas y la biología detrás de la compleja red de funcionamiento celular. La metodología de ensayo preferida se elige de acuerdo con las propiedades intrínsecas de la proteína, los valores cinéticos y el modo e intensidad de las interacciones18,19.
La interacción Hsp90/Cdc37:
La vía chaperona-quinasa, que conecta Hsp90 y Cdc37, es una diana terapéutica prometedora en biología tumoral20. Hsp90 desempeña un papel central en el control del ciclo celular, el ensamblaje de proteínas, la supervivencia celular y las vías de señalización. Las proteínas que dependen de Hsp90 para sus funciones se entregan a Hsp90 para su complejación a través de una co-chaperona, como Cdc37. El complejo Hsp90/Cdc37 controla el plegamiento de la mayoría de las proteínas quinasas y sirve como centro para una multitud de redes de señalización intracelular21. Es una diana antitumoral prometedora debido a su elevada expresión en diversas neoplasias malignas, incluyendo leucemia mieloblástica aguda, mieloma múltiple y carcinoma hepatocelular22,23.
Técnicas de detección de interacción biomolecular in vitro de uso común
La coinmunoprecipitación (co-IP) es una técnica que se basa en la especificidad antígeno-anticuerpo para identificar interacciones biológicamente relevantes24. La principal desventaja de este método es su incapacidad para detectar interacciones de baja afinidad y valores cinéticos24. Se prefieren métodos biofísicos como la calorimetría de titulación isotérmica (ITC), la resonancia de plasmón de superficie (SPR), la interferometría de biocapa (BLI) y la tecnología FEB para determinar los valores cinéticos.
ItC es un método de detección biofísica basado en la determinación de la energía de unión junto con un análisis termodinámico completo para caracterizar las interacciones biomoleculares25. La principal ventaja de ITC es que no requiere ningún etiquetado o fijación de la proteína objetivo. Las principales dificultades encontradas por el ITC son la alta concentración de proteína objetivo requerida para un experimento y la dificultad para analizar complejos no covalentes debido a pequeñas entalpías de unión26. Tanto SPR como BLI son técnicas biofísicas sin etiquetas que se basan en la inmovilización de la molécula diana en la superficie del sensor, seguida de inyecciones posteriores del analito sobre el objetivo inmovilizado27,28. En SPR se miden alteraciones en el índice de refracción durante las interacciones biomoleculares27; en BLI, la interferencia en la luz reflejada se registra en tiempo real como un cambio en la longitud de onda en función del tiempo28. Tanto SPR como BLI comparten ventajas comunes de ofrecer capacidades de alta especificidad, sensibilidad y detección29. En ambos métodos, la proteína diana se inmoviliza en las superficies de los biosensores y, por lo tanto, puede haber cierta pérdida de la conformación nativa del objetivo, lo que dificulta la discriminación entre interacciones específicas vs. no específicas30. BLI utiliza costosos biosensores desechables de fibra óptica para inmovilizar el objetivo y, por lo tanto, es una técnica costosa31. En comparación con estas herramientas de detección biomolecular bien establecidas, la tecnología FEB ofrece una plataforma confiable y libre de etiquetas mediante el uso de bajas concentraciones nanomolares para la detección biomolecular en tiempo real con caracterización cinética. La tecnología FEB también supera los burbujeantes desafíos que enfrenta el ITC y es más rentable en comparación con SPR o BLI.
Los biosensores basados en transistores de efecto de campo (FET) son un campo emergente para detectar interacciones biomoleculares al ofrecer diversas aplicaciones biomédicas. En el sistema FET, los objetivos se inmovilizan a los chips del biosensor y las interacciones se detectan mediante cambios en la conductancia32. La característica única a considerar en el desarrollo de un biosensor electrónico eficiente son las propiedades fisicoquímicas como la naturaleza semiconductora y la estabilidad química del material de recubrimiento utilizado para fabricar la superficie del sensor33. Los materiales convencionales como el silicio utilizado para FET han limitado la sensibilidad de los sensores porque requiere capas de óxido intercaladas entre el canal del transistor y un entorno específico para un funcionamiento adecuado34. Además, los transistores de silicio son sensibles a ambientes con alto contenido de sal, lo que dificulta la medición de las interacciones biológicas en su entorno natural. El biosensor basado en grafeno se presenta como una alternativa, ya que ofrece una excelente estabilidad química y campo eléctrico. Dado que el grafeno es una sola capa atómica de carbono, es extremadamente sensible como semiconductor y químicamente compatible con soluciones biológicas; ambas cualidades son deseables para generar biosensores electrónicos compatibles35. El notable potencial de carga ultra alta de las biomoléculas ofrecidas por los biosensores recubiertos de grafeno conduce al desarrollo de la tecnología FEB de biosensores basados en grafeno.
Principio de la tecnología FEB: FEB es una técnica de detección biomolecular sin etiqueta que mide la corriente eléctrica a través del biosensor de grafeno al que se inmovilizan los objetivos de unión. Las interacciones entre la proteína inmovilizada y el analito dan lugar a alteraciones en la corriente que se monitorizan en tiempo real, lo que permite mediciones cinéticas precisas36.
Instrumentación: El sistema FEB comprende un chip sensor de transistor de efecto de campo de grafeno (gFET) y un lector electrónico que aplica un voltaje constante durante todo el experimento (Figura 1). El analito se aplica en solución a la proteína diana inmovilizada en la superficie del biosensor. Cuando se produce una interacción, se mide y registra una alteración en la corriente en tiempo real. A medida que aumenta la concentración de analitos, la fracción de analito unido también aumentará, causando mayores alteraciones en la corriente. Utilizando el software de análisis automatizado proporcionado con el instrumento (Tabla de Materiales), I-Response se mide y registra en términos de unidades de biodetección (BU)37. I-Response se define como la alteración en la corriente (I) a través del chip biosensor medida en tiempo real sobre la interacción del objetivo inmovilizado con el analito. El software de análisis automatizado FEB puede analizar tanto la I-Response como la C-Response a eventos de interacción dinámica, donde la C-Response registra las alteraciones en la capacitancia (C). Las variaciones tanto en la I-Response como en la C-Response corresponden directamente a la fracción de analito unido y pueden analizarse más a fondo para generar valores KD . La preferencia predeterminada del software de análisis automatizado es I-Response.
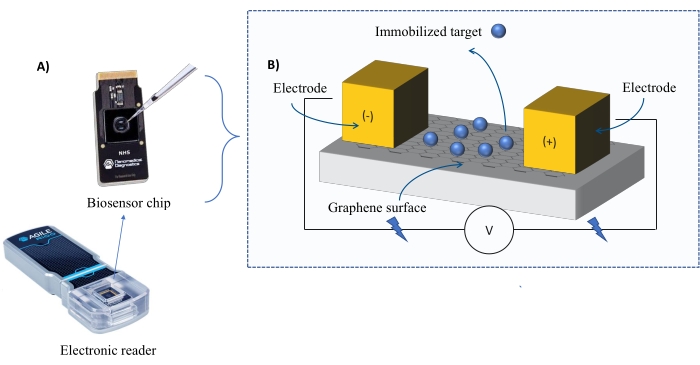
Figura 1: Descripción general de la configuración experimental. (A) Chip basado en grafeno y un lector electrónico. (B) Una visión general de los componentes del chip. El chip está unido a dos electrodos que suministran corriente al sistema. La superficie del chip está cubierta con grafeno, que cuando se activa puede unir al objetivo. Haga clic aquí para ver una versión más grande de esta figura.
Metodología:
Inicialmente, el chip biosensor activado se inserta en el dispositivo FEB (Figura 1) seguido de la ejecución de los pasos descritos a continuación: (1) Calibración: El experimento comienza con la calibración del sistema utilizando 1x solución salina tamponada con fosfato (PBS; pH = 7.4) para crear la respuesta de equilibrio basal. (2) Asociación: El analito se introduce en el chip, y el I-Response se monitorea hasta que se alcanza la saturación de unión. (3) Disociación: El analito se disocia usando 1x PBS. (4) Regeneración: Los restos del analito se eliminan usando 1x PBS. (5) Lavado: Se realizan un total de cinco lavados utilizando 1x PBS para la eliminación completa de los analitos unidos y no unidos del chip.
Análisis:
El análisis de datos se realiza utilizando el software totalmente automatizado proporcionado con el instrumento. El software de análisis automatizado genera un diagrama de ajuste de Hill con un valor KD . La gráfica de ajuste de Hill describe la asociación de un analito a la proteína objetivo en función de las concentraciones de analitos. La concentración a la que se alcanza una respuesta medio máxima es proporcional al valor KD . Un valor bajo de KD representa una alta afinidad de unión y viceversa.
Para validar los datos obtenidos del experimento FEB, las respuestas I se extraen de cada punto de lectura para cada concentración de analito utilizando el software de revisión / exportación de datos y se pueden exportar a otro software de análisis estadístico (consulte la Tabla de materiales) como se explica a continuación.
Protocol
Representative Results
Discussion
En este estudio, se evaluó la viabilidad de utilizar la tecnología FEB (un enfoque de caracterización cinética en tiempo real) para determinar la interacción biomolecular entre Hsp90 y Cdc37. El experimento exploratorio inicial (primer experimento) sugirió que la elección de las concentraciones adecuadas de analito es una parte crítica del experimento y que el experimento debería diseñarse incluyendo puntos de concentración por encima y por debajo del valor de KD , que se predijeron en función de l…
Declarações
The authors have nothing to disclose.
Acknowledgements
Esta investigación fue apoyada por una subvención de la Biational Science Foundation (BSF) a S.K.S. y N.Q.
Materials
| Automated analysis software | Agile plus software, Cardea (Nanomed) | NA CAS number: NA |
Referred to in the text as the automated analysis software supplied with the instrument. Generates automated analysis. |
| COOH-BPU (Biosensing Processing Unit) | Agile plus software, Cardea (Nanomed) | NA CAS number: NA |
biosensor chip |
| Data review software | Datalign 1.0, Cardea (Nanomed) | NA CAS number: NA |
Referred to as the supplied data review software in the text. Supplied with the instrument and allows to review and export the information data points. |
| Dialysis bag | CelluSep, Membrane filtration products | T2-10-15 CAS number: NA |
T2 tubings (6,000-8,000 MWCO), (10 mm fw, 6.4mm Ø, 0.32ml/cm, 15m) |
| EDC (1-Ethyl-3-(3-dimethylamino propyl) carbodiimide) | Cardea (Nanomed) | EDC160322-02 CAS number: 25952-53-8 |
White powder |
| ITC (Isothermal titration calorimetry) system | Microcal-PEAQ-ITC (Malvern, United Kingdom) | NA CAS number: NA |
|
| MES (2-(N-morpholino) ethane sulfonic acid) buffer | Merck | M3671-50G CAS number: 4432-31-9 |
White powder |
| NHS (N-Hydroxysulfosuccinimide) chips | Cardea (Nanomed) | NA CAS number: NA |
Graphene-based chip |
| PBS (Phosphate-buffered saline) X 10 | Bio-Lab | 001623237500 CAS number: 7758-11-4 |
Liquid transparent solution |
| Pipete | Thermo Scientific | 11855231 CAS number: NA |
Finnpipette F3 5-50 µL, yellow |
| Quench 1 (3.9 mM amino-PEG5-alcohol in 1 X PBS) | Cardea (Nanomed) | 0105-001-002-001 CAS number: NA |
Liquid, transparent solution |
| Quench 2 (1 M ethanolamine (pH=8.5)) | Cardea (Nanomed) | 0105-001-003-001 CAS number: NA |
Liquid, transparent solution |
| Recombinant protein Cdc37 | Abcam | ab256157 CAS number: NA |
|
| Recombinant protein Hsp90 beta | Abcam | ab80033 CAS number: NA |
|
| Spreadsheet | Excel, Microsoft office | NA CAS number: NA |
|
| Statistical software | GraphPad, Prism | NA CAS number: NA |
Referred to as the other statistical software. Sigma plot, phyton or other statistical programes may also be used |
| Sulfo-NHS | Cardea (Nanomed) | NHS160321-07 CAS number: 106627-54-7 |
White powder |
| Tips | Alex red | LC 1093-800-000 CAS number: NA |
Tip 1-200 µl, in bulk, 1,000 pcs |
Referências
- Tuncbag, N., Gursoy, A., Guney, E., Nussinov, R., Keskin, O. Architectures and functional coverage of protein-protein interfaces. Journal of Molecular Biology. 381 (3), 785-802 (2008).
- Berggård, T., Linse, S., James, P. Methods for the detection and analysis of protein–protein interactions. Proteomics. 7 (16), 2833-2842 (2007).
- Magliery, T. J., et al. Detecting protein-protein interactions with a green fluorescent protein fragment reassembly trap: Scope and mechanism. Journal of the American Chemical Society. 127 (1), 146-157 (2005).
- Xing, S., Wallmeroth, N., Berendzen, K. W., Grefen, C. Techniques for the analysis of protein-protein interactions in vivo. Plant Physiology. 171 (2), 727-758 (2016).
- Nguyen, T. N., Goodrich, J. A. Protein-protein interaction assays: Eliminating false positive interactions. Nature Methods. 3 (2), 135-139 (2006).
- Fernández-Suárez, M., Chen, T. S., Ting, A. Y. Protein-protein interaction detection in vitro and in cells by proximity biotinylation. Journal of the American Chemical Society. 130 (29), 9251-9253 (2008).
- Jiang, M., Niu, C., Cao, J., Ni, D. -. A., Chu, Z. In silico-prediction of protein–protein interactions network about MAPKs and PP2Cs reveals a novel docking site variants in Brachypodium distachyon. Scientific Reports. 8 (1), 15083 (2018).
- Yazawa, M., Sadaghiani, A. M., Hsueh, B., Dolmetsch, R. E. Induction of protein-protein interactions in live cells using light. Nature Biotechnology. 27 (10), 941-945 (2009).
- Wang, W., Goodman, M. T. Antioxidant property of dietary phenolic agents in a human LDL-oxidation ex vivo model: Interaction of protein binding activity. Nutrition Research. 19 (2), 191-202 (1999).
- Xing, S., Wallmeroth, N., Berendzen, K. W., Grefen, C. Techniques for the analysis of protein-protein interactions in vivo. Plant Physiology. 171 (2), 727-758 (2016).
- Qvit, N., Disatnik, M. -. H., Sho, E., Mochly-Rosen, D. Selective phosphorylation inhibitor of delta protein kinase C–Pyruvate dehydrogenase kinase protein–protein interactions: Application for myocardial injury in vivo. Journal of the American Chemical Society. 138 (24), 7626-7635 (2016).
- Alam, M. N., Bristi, N. J., Rafiquzzaman, M. Review on in vivo and in vitro methods evaluation of antioxidant activity. Saudi Pharmaceutical Journal. 21 (2), 143-152 (2013).
- Paulmurugan, R., Gambhir, S. S. Novel fusion protein approach for efficient high-throughput screening of small molecule–mediating protein-protein interactions in cells and living animals. Pesquisa do Câncer. 65 (16), 7413-7420 (2005).
- Boute, N., Jockers, R., Issad, T. The use of resonance energy transfer in high-throughput screening: BRET versus FRET. Trends in Pharmacological Sciences. 23 (8), 351-354 (2002).
- Deriziotis, P., Graham, S. A., Estruch, S. B., Fisher, S. E. Investigating protein-protein interactions in live cells using bioluminescence resonance energy transfer. Journal of Visualized Experiments: JoVE. (87), e51438 (2014).
- Ekins, S., Mestres, J., Testa, B. In silico pharmacology for drug discovery: Methods for virtual ligand screening and profiling. British Journal of Pharmacology. 152 (1), 9-20 (2007).
- Valerio, L. G. Application of advanced in silico methods for predictive modeling and information integration. Expert Opinion on Drug Metabolism & Toxicology. 8 (4), 395-398 (2012).
- Piehler, J. New methodologies for measuring protein interactions in vivo and in vitro. Current Opinion in Structural Biology. 15 (1), 4-14 (2005).
- Ideker, T., Sharan, R. Protein networks in disease. Genome Research. 18 (4), 644-652 (2008).
- Lu, H., et al. Recent advances in the development of protein–protein interactions modulators: mechanisms and clinical trials. Signal Transduction and Targeted Therapy. 5 (1), 213 (2020).
- Jarosz, D. Hsp90: A global regulator of the genotype-to-phenotype map in cancers. Advances in Cancer Research. 129, 225-247 (2016).
- Johnson, V. A., Singh, E. K., Nazarova, L. A., Alexander, L. D., McAlpine, S. R. Macrocyclic inhibitors of Hsp90. Current Topics in Medicinal Chemistry. 10 (14), 1380-1402 (2010).
- Mahalingam, D., et al. Targeting HSP90 for cancer therapy. British Journal of Cancer. 100 (10), 1523-1529 (2009).
- Stewart, A., Fisher, R. A. Co-Immunoprecipitation: Isolation of protein signaling complexes from native tissues. Methods in Cell Biology. 112, 33-54 (2012).
- Pierce, M. M., Raman, C. S., Nall, B. T. Isothermal titration calorimetry of protein-protein interactions. Methods. 19 (2), 213-221 (1999).
- Paketurytė, V., et al. Inhibitor binding to carbonic anhydrases by isothermal titration calorimetry. Carbonic Anhydrase as Drug Target. , 79-95 (2019).
- Grote, J., Dankbar, N., Gedig, E., Koenig, S. Surface plasmon resonance/mass spectrometry interface. Analytical Chemistry. 77 (4), 1157-1162 (2005).
- Kumaraswamy, S., Tobias, R. Label-free kinetic analysis of an antibody–antigen interaction using biolayer interferometry. Methods in Molecular Biology. , 165-182 (2015).
- Wallner, J., Lhota, G., Jeschek, D., Mader, A., Vorauer-Uhl, K. Application of bio-layer interferometry for the analysis of protein/liposome interactions. Journal of Pharmaceutical and Biomedical Analysis. 72, 150-154 (2013).
- Singh, A. N., Ramadan, K., Singh, S. Experimental methods to study the kinetics of protein–protein interactions. Advances in Protein Molecular and Structural Biology Methods. , 115-124 (2022).
- Frenzel, D., Willbold, D. Kinetic titration series with biolayer interferometry. PLoS One. 9 (9), 106882 (2014).
- Vu, C. -. A., Chen, W. -. Y. Field-effect transistor biosensors for biomedical applications: Recent advances and future prospects. Sensors. 19 (19), 4214 (2019).
- Bergveld, P. A critical evaluation of direct electrical protein detection methods. Biosensors & Bioelectronics. 6 (1), 55-72 (1991).
- Lowe, B. M., Sun, K., Zeimpekis, I., Skylaris, C. K., Green, N. G. Field-effect sensors – from pH sensing to biosensing: sensitivity enhancement using streptavidin–biotin as a model system. The Analyst. 142 (22), 4173-4200 (2017).
- Goldsmith, B. R., et al. Digital biosensing by foundry-fabricated graphene sensors. Scientific Reports. 9 (1), 434 (2019).
- Afsahi, S., et al. Novel graphene-based biosensor for early detection of Zika virus infection. Biosensors and Bioelectronics. 100, 85-88 (2018).
- Afsahi, S. J., et al. Towards novel graphene-enabled diagnostic assays with improved signal-to-noise ratio. MRS Advances. 2 (60), 3733-3739 (2017).
- Roe, S. M., et al. The mechanism of Hsp90 regulation by the protein kinase-specific cochaperone p50cdc37. Cell. 116 (1), 87-98 (2004).
- Gaiser, A. M., Kretzschmar, A., Richter, K. Cdc37-Hsp90 complexes are responsive to nucleotide-induced conformational changes and binding of further cofactors. The Journal of Biological Chemistry. 285 (52), 40921-40932 (2010).
- Popescu, A. I., Găzdaru, D. M., Chilom, C. G., Bacalum, M. Biophysical interactions: Their paramount importance for life. Romanian Reports in Physics. 65 (3), 1063-1077 (2013).
- Surya, S., Abhilash, J., Geethanandan, K., Sadasivan, C., Haridas, M. A profile of protein-protein interaction: Crystal structure of a lectin-lectin complex. International Journal of Biological Macromolecules. 87, 529-536 (2016).
- Velazquez-Campoy, A., Freire, E. ITC in the post-genomic era…? Priceless. Biophysical Chemistry. 115 (23), 115-124 (2005).
- Concepcion, J., et al. Label-free detection of biomolecular interactions using bioLayer interferometry for kinetic characterization. Combinatorial Chemistry & High Throughput Screening. 12 (8), 791-800 (2009).
- Helmerhorst, E., Chandler, D. J., Nussio, M., Mamotte, C. D. Real-time and label-free bio-sensing of molecular interactions by surface plasmon resonance: A laboratory medicine perspective. The Clinical Biochemist. Reviews. 33 (4), 161-173 (2012).
- Jacob, N. T., et al. Synthetic molecules for disruption of the MYC protein-protein interface. Bioorganic & Medicinal Chemistry. 26 (14), 4234-4239 (2018).

