Microscopietechnieken voor het interpreteren van schimmelkolonisatie in mycoheterotrofe plantenweefsels en symbiotische kieming van zaden
Summary
Dit protocol is bedoeld om gedetailleerde procedures te bieden voor het verzamelen, fixeren en onderhouden van mycoheterotrofe plantenmonsters, waarbij verschillende microscopietechnieken worden toegepast, zoals scanning- en transmissie-elektronenmicroscopie, licht-, confocale en fluorescentiemicroscopie om schimmelkolonisatie te bestuderen in plantenweefsels en zaden ontkiemd met mycorrhizaschimmels.
Abstract
Structurele plantkunde is een onmisbaar perspectief om de ecologie, fysiologie, ontwikkeling en evolutie van planten volledig te begrijpen. Bij het onderzoeken van mycoheterotrofe planten (d.w.z. planten die koolstof uit schimmels verkrijgen), kunnen opmerkelijke aspecten van hun structurele aanpassingen, de patronen van weefselkolonisatie door schimmels en de morfoanatomie van ondergrondse organen hun ontwikkelingsstrategieën en hun relaties met schimmeldraden, de bron van voedingsstoffen, verlichten. Een andere belangrijke rol van symbiotische schimmels is gerelateerd aan de kieming van orchideeënzaden; alle Orchidaceae-soorten zijn mycoheterotroof tijdens ontkieming en zaailingstadium (initiële mycoheterotrofie), zelfs degenen die fotosynthetiseren in volwassen stadia. Vanwege het gebrek aan voedingsreserves in orchideeënzaden zijn schimmelsymbionten essentieel om substraten te bieden en ontkieming mogelijk te maken. Het analyseren van kiemfasen door structurele perspectieven kan ook belangrijke vragen beantwoorden met betrekking tot de interactie van schimmels met de zaden. Verschillende beeldvormingstechnieken kunnen worden toegepast om fungi-endofyten in plantenweefsels te onthullen, zoals in dit artikel wordt voorgesteld. Vrije hand en dunne delen van plantenorganen kunnen worden gekleurd en vervolgens worden waargenomen met behulp van lichtmicroscopie. Een fluorochroom geconjugeerd aan tarwekiem agglutinine kan worden toegepast op de schimmels en co-geïncubeerd met Calcofluor White om de celwanden van planten te benadrukken in confocale microscopie. Bovendien zijn de methodologieën van scanning- en transmissie-elektronenmicroscopie gedetailleerd voor mycoheterotrofe orchideeën en worden de mogelijkheden onderzocht om dergelijke protocollen toe te passen in verwante planten. Symbiotische kieming van orchideeënzaden (d.w.z. in aanwezigheid van mycorrhizaschimmels) wordt in het protocol in detail beschreven, samen met mogelijkheden om de structuren verkregen uit verschillende stadia van ontkieming voor te bereiden voor analyses met licht-, confocale en elektronenmicroscopie.
Introduction
Structureel onderzoek in de plantkunde, dat betrekking heeft op plantenmorfologie en anatomie, is fundamenteel voor het begrijpen van het hele organisme 1,2, en biedt onmisbare perspectieven om te integreren en bij te dragen aan kennis over de ecologie, fysiologie, ontwikkeling en evolutie van planten3. Methoden in plantenmorfologie en anatomie omvatten momenteel protocollen, apparatuur en kennis die onlangs en meer dan een eeuw geleden zijn ontwikkeld2. De continue uitvoering en aanpassing van klassieke methoden (bijv. Lichtmicroscopie) samen met meer recente technieken (bijv. Confocale microscopie, röntgenmicrotomografie) hebben dezelfde essentiële basis: theoretische kennis die de ontwikkeling van een methodologie mogelijk maakt.
Het belangrijkste hulpmiddel in de anatomie en morfologie van planten is het beeld. Ondanks de misvatting dat dergelijke analyses eenvoudige observaties zijn, ruimte geven aan subjectieve interpretaties2, vereist het analyseren en begrijpen van beelden op dit gebied kennis van de toegepaste methoden (de apparatuur, type analyse, methodologische procedures), celcomponenten, histochemie en het plantenlichaam (weefselorganisatie en -functie, ontogenie, morfologische aanpassingen). Het interpreteren van de beelden verkregen via een verscheidenheid aan methoden kan leiden tot het correleren van vorm en functie, het ontcijferen van de chemische samenstelling van een structuur, het bevestigen van taxa, het begrijpen van infecties door fytopathogenen en andere dergelijke beoordelingen.
Bij het onderzoeken van mycoheterotrofe (MH) planten (d.w.z. niet-fotosynthetische planten die koolstof verkrijgen uit mycorrhizaschimmels 4,5), kunnen opmerkelijke aspecten van hun structurele aanpassingen, de patronen van weefselkolonisatie door schimmels en de morfoanatomie van ondergrondse organen hun ontwikkelingsstrategieën en relaties met schimmeldraden, die de bron van voedingsstoffen zijn, verlichten. De ondergrondse organen van MH-planten vertonen meestal belangrijke aanpassingen in verband met hun associatie met bodemschimmels, daarom is het essentieel om deze anatomische en morfologische onderzoeken uit te voeren6. De luchtorganen van MH-soorten mogen niet worden genegeerd, omdat endofyten ook in deze weefsels aanwezig kunnen zijn, zelfs als het geen mycorrhizaschimmels zijn (persoonlijke waarnemingen, nog niet gepubliceerd).
Naast de gevestigde essentie van mycorrhizaschimmels associëring met MH-soorten gedurende hun hele levenscyclus7, heeft elke orchideeënsoort, zelfs de autotrofe, een initieel verplicht mycoheterotroof stadium in natuurlijke omgevingen. Het komt voor omdat het embryo van de orchideeën ongedifferentieerd is en geen endosperm of zaadlobben heeft, waardoor het niet in staat is zich te ontwikkelen en zich te vestigen in natuurlijke omgevingen zonder de voedingsondersteuning van schimmelpartners 4,8. Gezien het feit dat symbiotische kiemprotocollen niet alleen kunnen worden toegepast op MH-soorten, maar ook op fotosynthetiserende orchideeën, gericht op het onderzoeken van orchidee-schimmelspecificiteit in kieming en protocormontwikkeling, een enorm toegepaste methodologie in initiatieven voor het behoud van bedreigde soorten 9,10,11.
In deze methodeassemblage beschrijven we belangrijke stappen die betrokken zijn bij het verzamelen, fixeren en opslaan van MH-fabrieksmonsters voor anatomisch onderzoek (sectie 1), oppervlakteanalyse en monsterselectie (sectie 2), sectiemethoden (uit de vrije hand: sectie 3, microtomie: sectie 4, cryomicrotomie: sectie 5), kleuring en montage (sectie 6), fluorescentie en confocale microscopie van schimmel-endofyten (sectie 7), scanning-elektronenmicroscopie (sectie 8), en transmissie-elektronenmicroscopie (rubriek 9). Daarnaast beschrijven we een symbiotische kiemingsmethode voor orchideeënzaden (MH en autotroof, sectie 10), omdat de eerder genoemde beeldvormingsmethoden met succes kunnen worden toegepast om schimmelkolonisatie van zaden, protocormen en zaailingen in het kiemproces te analyseren.
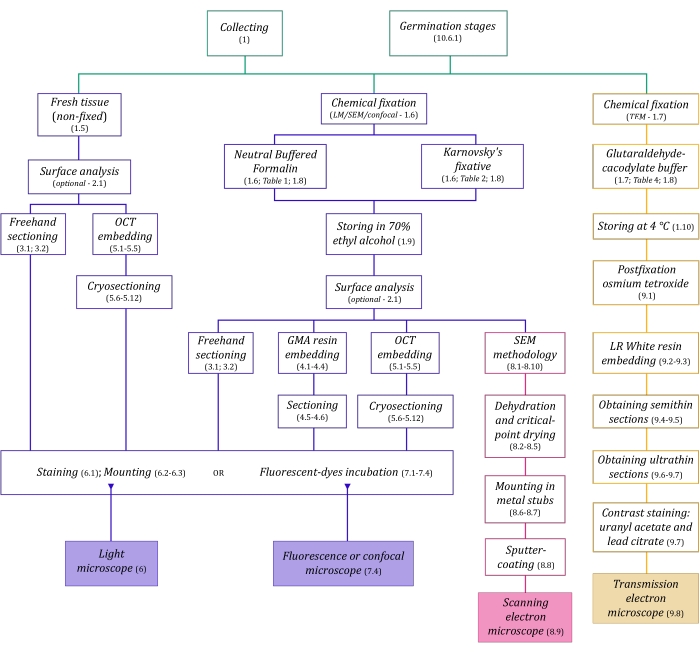
Figuur 1: Schematische samenvatting van beeldvormingsmethoden. De schema’s geven indicaties van protocolstappen waarin ze worden beschreven. Afkortingen: GMA = glycolmethacrylaat, OCT = optimale snijtemperatuurverbinding, SEM = scanningelektronenmicroscopie. Klik hier om een grotere versie van deze figuur te bekijken.
De hier in detail beschreven microscopietechnieken (figuur 1) worden voorafgegaan door de volgende essentiële stappen: verzamelen, fixeren, dehydrateren, insluiten en doorsnijden van monsters. Aangezien de stappen variabel zijn (figuur 1), afhankelijk van de gekozen techniek(en), is het belangrijk om vooruit te denken, rekening houdend met de fixeermiddelen die moeten worden voorbereid en naar de verzamelplaats moeten worden vervoerd, hoe de monsters moeten worden voorbereid voordat ze worden gefixeerd, de te gebruiken dehydratatieprocessen (sectie 1) en verschillende inbeddingsmogelijkheden en sectiemethoden (secties 4, 5, en 9). Figuur 1 geeft een overzicht van alle stappen die nodig zijn voor elke microscopietechniek die hieronder grondig wordt beschreven.
Protocol
Representative Results
Discussion
Beeldanalyses in de anatomie en morfologie van planten hebben een belangrijk potentieel om doelstellingen te bereiken en helpen de relaties tussen mycoheterotrofe planten en hun onmisbare schimmel-endofyten te begrijpen, zoals aangetoond door studies van ondergrondse organen 6,40, structurele analyses van symbiotische kieming van zaden39 en lucht- en voortplantingsstructuren41 . Structurele plantkunde, ondanks het f…
Declarações
The authors have nothing to disclose.
Acknowledgements
De auteurs bedanken de financiering van FAEPEX en FAPESP (2015/26479-6). MPP bedankt Capes voor zijn masterbeurs (proces 88887.600591/2021-00) en CNPq. JLSM bedankt CNPq voor productiviteitsbeurzen (303664/2020-7). De auteurs bedanken ook de toegang tot apparatuur en hulp van LME (Laboratory of Electron Microscopy – IB / Unicamp), INFABiC (National Institute of Science and Technology on Photonics Applied to Cell Biology – Unicamp) en LaBiVasc (Laboratory of Vascular Biology – DBEF / IB / Unicamp); LAMEB (UFSC) en Eliana de Medeiros Oliveira (UFSC) voor bijdragen aan cryoprotectieprotocol; LME voor bijdragen aan het TEM-protocol.
Materials
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation – OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation – OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation – OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
Referências
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology – Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).

