Técnicas de Microscopia para Interpretação da Colonização Fúngica em Tecidos de Plantas Micoheterotróficas e Germinação Simbiótica de Sementes
Summary
Este protocolo visa fornecer procedimentos detalhados para coleta, fixação e manutenção de amostras de plantas micoheterotróficas, aplicando diferentes técnicas de microscopia, como microscopia eletrônica de varredura e transmissão, microscopia de luz, confocal e fluorescência para estudar a colonização fúngica em tecidos e sementes geridas com fungos micorrizais.
Abstract
A botânica estrutural é uma perspectiva indispensável para compreender plenamente a ecologia, a fisiologia, o desenvolvimento e a evolução das plantas. Ao pesquisar plantas micoheterotróficas (ou seja, plantas que obtêm carbono de fungos), aspectos notáveis de suas adaptações estruturais, os padrões de colonização tecidual por fungos e a morfomia de órgãos subterrâneos podem iluminar suas estratégias de desenvolvimento e suas relações com a hifa, fonte de nutrientes. Outro papel importante dos fungos simbióticos está relacionado à germinação de sementes de orquídeas; todas as espécies de Orquídeas são micoterróticas durante a germinação e fase de mudas (micoheterotrofia inicial), mesmo as que fotossintetizam em estágios adultos. Devido à falta de reservas nutricionais em sementes de orquídeas, os simmbiontos fúngicos são essenciais para fornecer substratos e possibilitar a germinação. Analisar etapas de germinação por perspectivas estruturais também pode responder a questões importantes sobre a interação dos fungos com as sementes. Diferentes técnicas de imagem podem ser aplicadas para desvendar endofitos de fungos em tecidos vegetais, como são propostos neste artigo. Seções à mão livre e finas de órgãos vegetais podem ser manchadas e depois observadas usando microscopia leve. Um fluorocromo conjugado à aglutina germina de trigo pode ser aplicado aos fungos e co-incubado com Calcofluor White para destacar paredes de células vegetais em microscopia confocal. Além disso, as metodologias de digitalização e microscopia eletrônica de transmissão são detalhadas para orquídeas micterotróficas, e as possibilidades de aplicação desses protocolos em plantas relacionadas são exploradas. A germinação simbiótica das sementes de orquídeas (ou seja, na presença de fungos micorrizais) é descrita no protocolo em detalhes, juntamente com possibilidades de preparação das estruturas obtidas a partir de diferentes estágios de germinação para análises com microscopia de luz, confocal e elétron.
Introduction
A pesquisa estrutural em botânica, abrangendo morfologia vegetal e anatomia, é fundamental na compreensão de todo o organismo 1,2, e fornece perspectivas indispensáveis para integrar e contribuir para o conhecimento sobre a ecologia, fisiologia, desenvolvimento e evolução das plantas3. Os métodos de morfologia e anatomia vegetal atualmente compreendem protocolos, equipamentos e conhecimentos desenvolvidos recentemente, bem como há mais de um séculoatrás, 2. A execução contínua e adaptação dos métodos clássicos (por exemplo, microscopia leve) juntamente com técnicas mais recentes (por exemplo, microscopia confocal, microtomografia de raios-X) têm a mesma base essencial: conhecimento teórico que permite o desenvolvimento de uma metodologia.
A principal ferramenta na anatomia e morfologia das plantas é a imagem. Apesar do equívoco de que tais análises são observações simples, dando espaço a interpretações subjetivas2, analisar e compreender imagens nessa área requer conhecimento dos métodos aplicados (o equipamento, tipo de análise, procedimentos metodológicos), componentes celulares, histoquímica e o corpo vegetal (organização e função tecidual, ontogenia, adaptações morfológicas). Interpretar as imagens obtidas através de uma variedade de métodos pode levar à correlação entre forma e função, decifrando a composição química de uma estrutura, corroborando na descrição da taxa, na compreensão de infecções por fitopatógenos e outras avaliações desse tipo.
Ao pesquisar plantas micoheterotróficas (MH) (ou seja, plantas não fotossintéticas que obtêm carbono de fungos micorrizais 4,5), aspectos notáveis de suas adaptações estruturais, os padrões de colonização tecidual por fungos e a morfomia de órgãos subterrâneos podem iluminar suas estratégias de desenvolvimento e relações com a hifa, que são a fonte de nutrientes. Os órgãos subterrâneos das plantas de MS geralmente apresentam importantes adaptações relacionadas à sua associação com fungos do solo, por isso é essencial realizar essas investigações anatômicas e morfológicas6. Os órgãos aéreos da espécie MH não devem ser ignorados, pois os endófitos também podem estar presentes nesses tecidos, mesmo que não sejam fungos micorrizais (observações pessoais, ainda não publicadas).
Além da essencialidade bem estabelecida da associação de fungos micorrizais com espécies de MS durante todo o seu ciclode vida 7, todas as espécies de orquídeas, mesmo as autotróficas, têm um estágio micoheterotrófico obrigatório inicial em ambientes naturais. Ocorre porque o embrião das orquídeas é indiferenciado e carece de endosperm ou cotilledons, sendo assim incapaz de se desenvolver e se estabelecer em ambientes naturais sem o apoio nutricional dos parceiros fúngicos 4,8. Considerando isso, os protocolos simbióticos de germinação podem ser aplicados não apenas às espécies de MS, mas também às orquídeas fotossintestares, com o objetivo de investigar a especificidade orquídea-fungo no desenvolvimento de germinação e protocorma, metodologia muito aplicada em iniciativas de conservação de espécies ameaçadas 9,10,11.
Nesta montagem de métodos, descrevemos passos importantes envolvidos na coleta, fixação e armazenamento de amostras de plantas de MS para estudos anatômicos (seção 1), análise de superfície e seleção de amostras (seção 2), métodos de secção (à mão livre: seção 3, microtomia: seção 4, criomicrotomia: seção 5), coloração e montagem (seção 6), fluorescência e microscopia confocal de endofitos fúngicos (seção 7), microscopia eletrônica de varredura (seção 8), e microscopia eletrônica de transmissão (seção 9). Além disso, descrevemos um método de germinação simbiótica para sementes de orquídeas (MH e autotrófico, seção 10), pois os métodos de imagem mencionados anteriormente podem ser aplicados com sucesso para analisar a colonização fúngica de sementes, protocormas e mudas no processo de germinação.
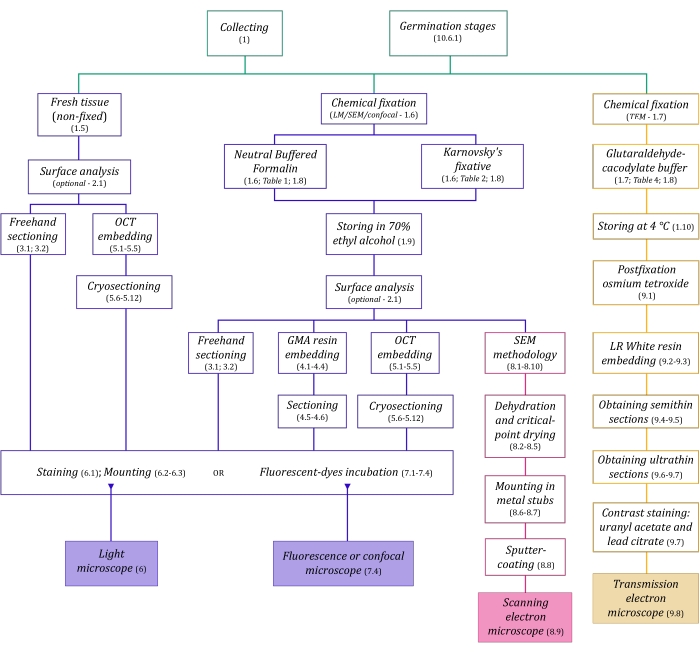
Figura 1: Resumição esquemática dos métodos de imagem. Os esquemas fornecem indicações de etapas de protocolo nas quais são detalhadas. Abreviaturas: GMA = methacrilato glicol, OCT = composto de temperatura de corte ideal, SEM = microscopia eletrônica de varredura. Clique aqui para ver uma versão maior desta figura.
As técnicas de microscopia descritas aqui em detalhes (Figura 1) são precedidas pelas seguintes etapas essenciais: coleta, fixação, desidratação, incorporação e secção de amostras. Como as etapas são variáveis (Figura 1) dependendo da técnica escolhida( s), é importante pensar com antecedência, considerando os fixativos a serem preparados e transportados para o local de coleta, como as amostras devem ser preparadas antes da fixação, os processos de desidratação a serem utilizados (seção 1) e diferentes possibilidades de incorporação e métodos de secção (seções 4, 5, e 9). A Figura 1 resume sequencialmente todas as etapas necessárias para cada técnica de microscopia completamente descrita abaixo.
Protocol
Representative Results
Discussion
As análises de imagem na anatomia e morfologia das plantas têm um importante potencial para cumprir objetivos e ajudar a entender as relações entre as plantas micoheterotróficas e seus endofofados fúngicos indispensáveis, como demonstrado por estudos de órgãos subterrâneos 6,40, análises estruturais da germinação simbiótica das sementes39, e estruturas aéreas e reprodutivas41 . A botânica estrutural,…
Declarações
The authors have nothing to disclose.
Acknowledgements
Os autores agradecem financiamento da FAEPEX e fapesp (2015/26479-6). MPP agradece à Capes pela bolsa de mestrado (processo 88887.600591/2021-00) e CNPq. JLSM agradece ao CNPq por bolsas de produtividade (303664/2020-7). Os autores também agradecem o acesso aos equipamentos e assistência prestados pelo LME (Laboratório de Microscopia Eletrônica – IB/Unicamp), INFABiC (Instituto Nacional de Ciência e Tecnologia em Fotônica Aplicada à Biologia Celular – Unicamp) e LaBiVasc (Laboratório de Biologia Vascular – DBEF/IB/Unicamp); LAMEB (UFSC) e Eliana de Medeiros Oliveira (UFSC) por contribuições ao protocolo de crioproteção; LME para contribuições ao protocolo TEM.
Materials
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation – OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation – OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation – OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
Referências
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology – Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).

