Вычислительное моделирование нейронов сетчатки для исследования зрительных протезов - Фундаментальные подходы
Summary
Мы суммируем рабочий процесс для вычислительного моделирования поведения нейрона сетчатки в ответ на электрическую стимуляцию. Вычислительная модель универсальна и включает в себя этапы автоматизации, которые полезны для моделирования ряда физиологических сценариев и прогнозирования результатов будущих исследований in vivo / in vitro .
Abstract
Вычислительное моделирование становится все более важным методом в нейронной инженерии из-за его способности предсказывать поведение систем in vivo и in vitro . Это имеет ключевое преимущество минимизации количества животных, необходимых в данном исследовании, предоставляя часто очень точное прогнозирование физиологических результатов. В области визуального протезирования вычислительное моделирование имеет множество практических применений, включая информирование о конструкции имплантируемой электродной решетки и прогнозирование визуальных восприятий, которые могут быть вызваны доставкой электрических импульсов от указанного массива. Некоторые модели, описанные в литературе, сочетают трехмерную (3D) морфологию для вычисления электрического поля и кабельную модель интересующего нейрона или нейронной сети. Чтобы повысить доступность этого двухэтапного метода для исследователей, которые могут иметь ограниченный предыдущий опыт в вычислительном моделировании, мы предоставляем видео фундаментальных подходов, которые должны быть приняты для построения вычислительной модели и использования ее для прогнозирования физиологических и психофизических результатов протоколов стимуляции, развернутых через зрительный протез. Руководство включает в себя шаги по построению 3D-модели в программном обеспечении для конечно-элементного моделирования (FEM), построение модели ганглиозных клеток сетчатки в многокамерном вычислительном программном обеспечении нейронов с последующим объединением двух. Программное обеспечение для моделирования конечных элементов для численного решения физических уравнений будет использоваться для решения распределения электрического поля при электрической стимуляции ткани. Затем было использовано специализированное программное обеспечение для моделирования электрической активности нейронной клетки или сети. Чтобы следовать этому руководству, потребуется знакомство с принципом работы нейропротеза, а также нейрофизиологическими концепциями (например, механизмом потенциала действия и пониманием модели Ходжкина-Хаксли).
Introduction
Визуальные нейропротезы представляют собой группу устройств, которые доставляют стимуляцию (электрическую, световую и т. Д.) Нервным клеткам в зрительном пути для создания фосфенов или ощущения видения света. Это стратегия лечения, которая используется в клинике в течение почти десятилетия для людей с постоянной слепотой, вызванной дегенеративными заболеваниями сетчатки. Как правило, полная система будет включать в себя внешнюю камеру, которая захватывает визуальную информацию вокруг пользователя, блок питания и вычислительный блок для обработки и преобразования изображения в серию электрических импульсов и имплантированную электродную решетку, которая взаимодействует с нервной тканью и доставляет электрические импульсы к нервным клеткам. Принцип работы позволяет размещать визуальный нейропротез в разных местах вдоль зрительного пути от сетчатки до зрительной коры, если он находится ниже по течению от поврежденной ткани. Большинство современных исследований в области зрительных нейропротезов сосредоточены на повышении эффективности стимуляции и улучшении пространственной остроты для обеспечения более естественного зрения.
В усилиях по повышению эффективности стимуляции вычислительное моделирование было экономически эффективным и эффективным методом для проверки конструкции протеза и моделирования его визуального результата. Вычислительное моделирование в этой области приобрело популярность с 1999 года, когда Гринберг1 смоделировал реакцию ганглиозной клетки сетчатки на внеклеточные электрические стимулы. С тех пор вычислительное моделирование стало использоваться для оптимизации параметров электрического импульса 2,3 или геометрического проектирования электрода 4,5. Несмотря на различия в сложности и исследовательских вопросах, эти модели работают, определяя распределение электрического напряжения в среде (например, нервной ткани) и оценивая электрический ответ, который нейроны в окрестностях будут производить из-за электрического напряжения.
Распределение электрического напряжения в проводнике можно найти, решив уравнения Пуассона6 во всех местах:
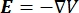
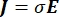
где E — электрическое поле, V — электрический потенциал, J — плотность тока, а σ — электропроводность. В 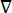 уравнении указывает оператор градиента. В случае стационарного тока на модель накладываются следующие граничные условия:
уравнении указывает оператор градиента. В случае стационарного тока на модель накладываются следующие граничные условия:
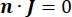
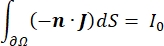
где n — нормаль поверхности, Ω — границу, а I0 — конкретный ток. Вместе они создают электрическую изоляцию на внешних границах и создают источник тока для выбранной границы. Если предположить монополярный точечный источник в однородной среде с изотропной проводимостью, то внеклеточный электрический потенциал в произвольном месте может быть рассчитан на7:
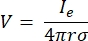
где Ie — ток и — расстояние между электродом и точкой измерения. Когда среда неоднородна или анизотропна, или электродная решетка имеет несколько электродов, вычислительный набор для численного решения уравнений может быть удобным. Конечно-элементное программное обеспечение для моделирования6 разбивает объемный проводник на небольшие участки, известные как «элементы». Элементы взаимосвязаны друг с другом так, что эффекты изменения одного элемента влияют на изменение в других, и это решает физические уравнения, которые служат для описания этих элементов. С увеличением вычислительной скорости современных компьютеров этот процесс может быть завершен в течение нескольких секунд. Как только электрический потенциал рассчитан, можно оценить электрический отклик нейрона.
Нейрон посылает и получает информацию в виде электрических сигналов. Такие сигналы бывают двух форм – градуированные потенциалы и потенциалы действия. Градуированные потенциалы представляют собой временные изменения мембранного потенциала, при которых напряжение через мембрану становится более положительным (деполяризация) или отрицательным (гиперполяризация). Градуированные потенциалы обычно имеют локализованные эффекты. В клетках, которые их производят, потенциалы действия — это реакции «все или ничего», которые могут перемещаться на большие расстояния по длине аксона. Как градуированные, так и активные потенциалы чувствительны как к электрической, так и к химической среде. Всплеск потенциала действия может быть произведен различными типами нейрональных клеток, включая ганглиозные клетки сетчатки, когда пороговый трансмембранный потенциал пересекается. Всплеск и распространение потенциала действия затем вызывают синаптическую передачу сигналов нисходящим нейронам. Нейрон может быть смоделирован как кабель, который разделен на цилиндрические сегменты, где каждый сегмент имеет емкость и сопротивление из-за липидной двухслойной мембраны8. Нейронная вычислительная программа9 может оценить электрическую активность электрически возбудимой клетки, дискретизируя клетку на несколько отсеков и решая математическую модель10:
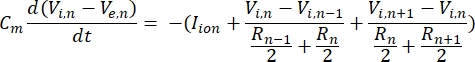
В этом уравнении Cm— емкость мембраны, Ve,n — внеклеточный потенциал в узле n, Vi,n — внутриклеточный потенциал в узле n, Rn— внутриклеточное (продольное) сопротивление в узле n, а I-ион — ионный ток, проходящий через ионные каналы в узле n. Значения V из модели FEM реализованы как Ve,n для всех узлов в нейроне, когда стимуляция активна.
Трансмембранные токи из ионных каналов могут быть смоделированы с использованием формул Ходжкина-Хаксли11:
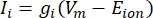
где gi — удельная проводимость канала, Vm — трансмембранный потенциал (Vi,n — Ve,n), а E-ион — обратный потенциал ионного канала. Для каналов с напряжением, таких как Канал Na, вводятся безразмерные параметры, m и h, которые описывают вероятность открытия или закрытия каналов:
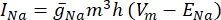
где 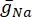 — максимальная мембранная проводимость для конкретного ионного канала, а значения параметров m и h определяются дифференциальными уравнениями:
— максимальная мембранная проводимость для конкретного ионного канала, а значения параметров m и h определяются дифференциальными уравнениями:
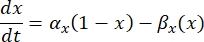
где αx и βx являются зависимыми от напряжения функциями, определяющими константы скорости ионного канала. Как правило, они принимают форму:
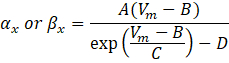
Значения параметров в этих уравнениях, включая максимальную проводимость, а также константы A, B, C и D, обычно находились из эмпирических измерений.
С помощью этих строительных блоков можно построить модели различной сложности, выполнив описанные шаги. Программное обеспечение FEM полезно, когда уравнение Пуассона не может быть решено аналитически, например, в случае неоднородной или анизотропной проводимости в объемном проводнике или когда геометрия электродной решетки сложна. После того, как значения внеклеточного потенциала были решены, модель нейронного кабеля может быть численно решена в вычислительном программном обеспечении нейронов. Объединение двух программ позволяет вычислять сложную нейронную клетку или сеть в неоднородном электрическом поле.
Простая двухэтапная модель ганглиозной клетки сетчатки при супрахороидальной стимуляции будет построена с использованием вышеупомянутых программ. В этом исследовании ганглиозная клетка сетчатки будет подвергаться воздействию диапазона величин импульсов электрического тока. Расположение клетки относительно стимула также варьируется, чтобы показать зависимость расстояние-порог. Кроме того, исследование включает в себя валидацию вычислительного результата по сравнению с исследованием in vivo порога активации коры с использованием различных размеров стимулирующего электрода12, а также исследование in vitro , показывающее взаимосвязь между расстоянием электрод-нейрон и порог активации13.
Protocol
Representative Results
Discussion
В этой статье мы продемонстрировали рабочий процесс моделирования, который сочетает в себе моделирование конечных элементов и биофизических нейронов. Модель очень гибкая, так как ее можно модифицировать по своей сложности в соответствии с различными целями, и она обеспечивает способ …
Declarações
The authors have nothing to disclose.
Acknowledgements
Это исследование финансируется Грантом проекта Национального совета по здравоохранению и медицинским исследованиям (номер гранта 1109056).
Materials
| Computer workstation | N/A | N/A | Windows 64-bit operating system, at least 4GB of RAM, at least 3 GB of disk space |
| Anaconda Python | Anaconda Inc. | Version 3.9 | The open source Individual Edition containing Python 3.9 and preinstalled packages to perform data manipulation, as well as Spyder Integrated Development Environment. It could be used to control the simulation, as well as to display and analyse the simulation data. |
| COMSOL Multiphysics | COMSOL | Version 5.6 | The simulation suite to perform finite element modelling. The licence for the AC/DC module should be purchased. The Application Builder capability should be included in the licence to follow the automation tutorial. |
| NEURON | NEURON | Version 8.0 | A freely-distributed software to perform the computation of neuronal cells and/or neural networks. |
Referências
- Greenberg, R. J., Velte, T. J., Humayun, M. S., Scarlatis, G. N., de Juan, E. A computational model of electrical stimulation of the retinal ganglion cell. IEEE Transactions on Bio-medical Engineering. 46 (5), 505-514 (1999).
- Guo, T., et al. Mediating retinal ganglion cell spike rates using high-frequency electrical stimulation. Frontiers in Neuroscience. 13, 413 (2019).
- Loizos, K., et al. Increasing electrical stimulation efficacy in degenerated retina: Stimulus waveform design in a multiscale computational model. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 26 (6), 1111-1120 (2018).
- Cao, X., Sui, X., Lyu, Q., Li, L., Chai, X. Effects of different three-dimensional electrodes on epiretinal electrical stimulation by modeling analysis. Journal of Neuroengineering and Rehabilitation. 12 (1), 73 (2015).
- Wilke, R. G. H., Moghadam, G. K., Lovell, N. H., Suaning, G. J., Dokos, S. Electric crosstalk impairs spatial resolution of multi-electrode arrays in retinal implants. Journal of Neural Engineering. 8 (4), 046016 (2011).
- AC/DC module user’s guide. COMSOL AB Available from: https://doc.comsol.com/5.4/doc/com.comsol.help.acdc/ACDCModuleUsersGuide.pdf (2018)
- Malmivuo, P., Malmivuo, J., Plonsey, R. . Bioelectromagnetism: Principles and Applications of Bioelectric and Biomagnetic Fields. , (1995).
- Rall, W. Electrophysiology of a dendritic neuron model. Biophysical Journal. 2, 145-167 (1962).
- Carnevale, N. T., Hines, M. L. . The Neuron Book. , (2006).
- Rattay, F. The basic mechanism for the electrical stimulation of the nervous system. Neurociência. 89 (2), 335-346 (1999).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Liang, T., et al. Threshold suprachoroidal-transretinal stimulation current required by different-size electrodes in rabbit eyes. Ophthalmic Research. 45 (3), 113-121 (2011).
- Jensen, R. J., Rizzo, J. F., Ziv, O. R., Grumet, A., Wyatt, J. Thresholds for activation of rabbit retinal ganglion cells with an ultrafine, extracellular microelectrode. Investigative Ophthalmology and Visual Science. 44 (8), 3533-3543 (2003).
- Kim, W., Choi, M., Kim, S. -. W. The normative retinal and choroidal thicknesses of the rabbit as revealed by spectral domain optical coherence tomography. Journal of the Korean Ophthalmological Society. 62 (3), 354-361 (2021).
- Guo, T., et al. Influence of cell morphology in a computational model of ON and OFF retinal ganglion cells. 35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). 2013, 4553-4556 (2013).
- Haberbosch, L., et al. Safety aspects, tolerability and modeling of retinofugal alternating current stimulation. Frontiers in Neuroscience. 13, 783 (2019).
- Sheasby, B. W., Fohlmeister, J. F. Impulse encoding across the dendritic morphologies of retinal ganglion cells. Journal of Neurophysiology. 81 (4), 1685-1698 (1999).
- Rockhill, R. L., Daly, F. J., MacNeil, M. A., Brown, S. P., Masland, R. H. The diversity of ganglion cells in a mammalian retina. Journal of Neuroscience. 22 (9), 3831-3843 (2002).
- Lukasiewicz, P., Werblin, F. A slowly inactivating potassium current truncates spike activity in ganglion cells of the tiger salamander retina. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 8 (12), 4470-4481 (1988).
- Van Rossum, G. . Python Reference Manual. , (1995).
- . Welcome to Spyder’s Documentation – Spyder 5 documentation Available from: https://docs.spyder-idle.org/current/index.html (2022)
- Rattay, F. Ways to approximate current-distance relations for electrically stimulated fibers. Journal of Theoretical Biology. 125 (3), 339-349 (1987).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Direct activation and temporal response properties of rabbit retinal ganglion cells following subretinal stimulation. Journal of Neurophysiology. 102 (5), 2982-2993 (2009).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Frequency-dependent reduction of voltage-gated sodium current modulates retinal ganglion cell response rate to electrical stimulation. Journal of Neural Engineering. 8 (6), 066007 (2011).
- Joucla, S., Glière, A., Yvert, B. Current approaches to model extracellular electrical neural microstimulation. Frontiers in Computational Neuroscience. 8, 13 (2014).
- . OpenFOAM Available from: https://www.openfoam.com/ (2022)
- Barba, L., Forsyth, G. CFD Python: The 12 steps to Navier-Stokes equations. Journal of Open Source Education. 1 (9), 21 (2018).

