Kemik Analoglarının Üretimi için Hücre Yüklü Süspansiyonlarda Seramik Çok Yönlü Biyobaskı
Summary
Bu protokol, jelatin bazlı granüler bir destekte bir kalsiyum fosfat mürekkebi biriktirerek kemik benzeri yapılar üretmek için bir 3D baskı tekniğini açıklar. Baskılı kemik analogları, baskının doğrudan toplanması veya multifazik yapılar için canlı bir hücre matrisi içinde çapraz bağlanma esnekliği ile serbest formda biriktirilir.
Abstract
Yapısal olarak, kemik dokusu, hiyerarşik, yüksek mineralize bir matris içine gömülü metabolik olarak aktif hücreler içeren inorganik-organik bir kompozittir. Bu organizasyonun, kemiğin heterojen ortamı nedeniyle çoğaltılması zordur. Hücre süspansiyonlarında seramik çok yönlü biyobaskı (COBICS), kemiğin mineral ve hücresel yapısını benzersiz bir şekilde kopyalayan mikrojel bazlı bir biyobaskı tekniğidir. COBICS, kemik mimetik yapılarının eklemeli üretimindeki en büyük zorluklardan ikisi olan fedakarlık destek malzemelerine veya zorlu son işlem adımlarına (örneğin, radyasyon ve yüksek sıcaklıkta sinterleme) ihtiyaç duymadan karmaşık, biyolojik olarak ilgili yapıları yazdırır. Bu teknik, jelatin bazlı bir mikrojel süspansiyon içinde yeni bir kalsiyum fosfat bazlı mürekkebin serbest biçimli ekstrüzyonu yoluyla sağlanır. Süspansiyonun akma gerilme özellikleri, birikmeye izin verir ve basılan kemik yapısını destekler. UV çapraz bağlama ve nanoçökeltme daha sonra yerine “kilitleyin”. Hücre yüklü biyomalzemeler içinde nanoyapılı kemik-mimetik seramikler basma yeteneği, makro ve mikro mimari üzerinde mekansal zamansal kontrol sağlar ve klinik ortamlarda karmaşık kemik yapılarının gerçek zamanlı olarak üretilmesini kolaylaştırır.
Introduction
Kemik, endojen iyileşme kapasitesinin tehlikeye girdiği kritik bir kusur boyutuna kadar normal hücresel bileşimini, oryantasyonunu ve mekanik gücünü yeniden yaratarak iyileşebilen vücuttaki birkaç yapıdan biri olarak olağanüstü rejenerasyon yeteneklerine sahiptir1. Kemik, kıkırdak ve bağ ile birlikte, vücut hareketini destekler ve kolaylaştırırken, aynı zamanda mineralleri ve yağları depolar ve kan hücreleri üretir. Sert, yoğun bir bağ dokusu olarak, kemik esas olarak inorganik bir fazdan, sudan ve esas olarak kollajen liflerinden oluşan organik malzemedenoluşur 2. Hücreler, kollajen I liflerinin ve hidroksiapatit (HA) kristallerinin bu yüksek mineralize matrisine gömülür ve hiyerarşik bir yapı oluşturur3.
Bu dokunun karmaşık organizasyonu, heterojen kemik mikro ve nano ortamlarını çoğaltmak için sentetik alternatiflerin üretilmesini son derece zorluhale getirir 3. Bu amaçla, biyoseramikler, hücre yüklü hidrojeller ve sentetik malzemeler de dahil olmak üzere çeşitli malzemeler, kemik matrisleri oluşturmak için çözümler olarak önerilmiştir. İskele imalat teknikleri arasında, 3D baskı tabanlı teknikler son zamanlarda ortaya çıkmış ve hastaya özgü tedavi vaadi ile son derece sofistike ve hassas yapıların üretilmesine izin verme konusundaki olağanüstü yetenekleri nedeniyle doku mühendisliği topluluğundan çok dikkat çekmiştir 4,5,6 . Hidrojeller, matris taklitlerinin ve biyo-mürekkeplerin en popüler seçimi olmuştur, çünkü hücreler ve biyoaktif moleküllerle birlikte basılabildikleri için fonksiyonel yapılar oluştururlar6. Bununla birlikte, hidrojeller, mekanik mukavemet ve metabolik olarak aktif hücreler içeren yüksek kalsifiye, inorganik bir faz gibi kemiğin fonksiyonel özelliklerinden yoksundur.
3D baskılı seramik iskeleler tipik olarak sinterleme, yüksek sıcaklık işlemleri veya in vitro veya in vivo uygulamalardan önce iyice yıkanması gereken sert kimyasalların kullanılması dahil olmak üzere işlem sonrası adımlar gerektirir5. Bu sınırlamaları ele almak için, Lode ve ark.7 yakın zamanda hidroksiapatit tarafından oluşturulan, fizyolojik koşullar altında basılabilen ve ayarlanabilen α-trikalsiyum fosfat bazlı bir macun geliştirdi. Bununla birlikte, bu malzeme nemli bir ortamda işlem sonrası işlem ve ardından uzun süre sulu çözelti daldırma gerektirdiğinden canlı hücrelerle birlikte basılamaz.
Alternatif olarak, inorganik parçacıkların dahil edildiği hücre yüklü hidrojeller, 3D kemik matrisi 8,9’un yerine önerilmiştir. Hücre canlılığını destekleme konusundaki büyük yeteneklerine rağmen, yoğun mineralize kemik dokusu ortamını özetleyemezler. Thrivikarman ve ark.10, nano ölçekli apatit birikimini daha iyi taklit etmek için kollajenöz olmayan bir protein analoğu ile aşırı doymuş bir kalsiyum ve fosfat ortamının kullanıldığı biyomimetik bir yaklaşım benimsemiştir. Bununla birlikte, yapıları hala kemiğe benzeyen mikro ve makro ölçekli mimariye sahip katı 3B yapılar üretemez.
Bu çalışma, bu eksiklikleri, hem hücreleri hem de büyüme faktörlerini entegre edebilen inorganik ve organik fazlarda kemik taklit eden yapılar üretmek için bir baskı stratejisinin geliştirilmesi yoluyla ele almaktadır11. COBICS, mikrojel bazlı bir biyobaskı tekniği kullanarak kemiğin mineral ve hücresel yapısını benzersiz bir şekilde özetler. Buradaki protokol, seramik kemik mürekkebi ve jelatin bazlı mikrojellerin sentezlenmesi ve daha sonra COBICS’i etkinleştiren hücrelerin birleştirilmesi sürecini açıklamaktadır. İşlem, kemik mürekkebinin ana öncü malzemesinin sentezi ile başlar. Çapraz bağlanabilir hidrojel daha sonra sentezlenir ve mikrojeller halinde oluşturulur. Son olarak, kemik mürekkebi, hücrelerle yüklü mikrojellerin bir destek banyosunda çok yönlü olarak biriktirilir (Şekil 1).
Kemik mürekkebi, uygun akma gerilmesi özelliklerine sahip mikrojellerin herhangi bir süspansiyonuna, yani belirli bir kesme hızında akışkanlaştırma ve daha sonra biriken yapıyı destekleme yeteneğine sahip herhangi bir süspansiyona basılabilir. İki esnek yaklaşım gösterilmiştir: jelatin mikrojellerinden oluşan bir süspansiyon ve jelatin metakrilat (GelMA) mikrojellerinden oluşan bir süspansiyon. İlk süspansiyon, sıcaklık 37 ° C’ye yükseltildiğinde çözülür, askıya alınmış hidrojellerin (FRESH) serbest biçimli geri dönüşümlü gömülmesi tekniği12, ikincisi ise baskıdan sonra fotoçapraz bağlanabilir, mikrojelleri etkili bir şekilde “diker” ve basılı kemik mürekkebini yerine kilitler. Bu çalışma, karmaşık kemik mimetik yapılarının in situ baskısı ile hücre büyümesini destekleyebilmenin eşsiz avantajını sağladığı için GelMA’yı matris olarak kullanmaya odaklanmaktadır. Nihayetinde, bu yaklaşım, yüksek düzeyde biyomimikri ve hastalık modellemesi, ilaç keşfi ve rejeneratif mühendislik için geniş etkileri olan karmaşık doku modellerinin üretilmesini sağlar.
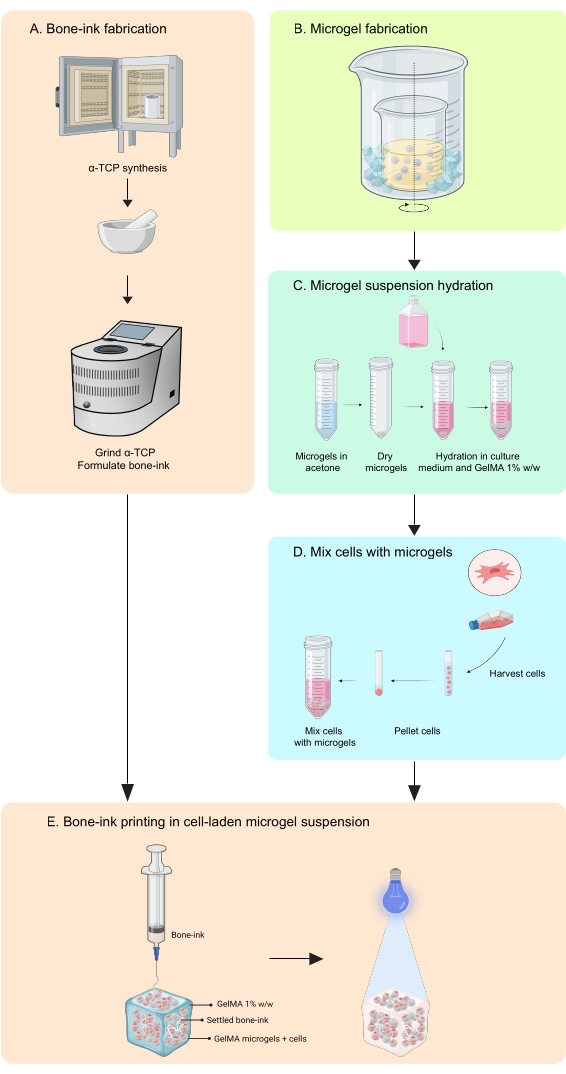
Şekil 1: İş akışının şeması . (A) Kemik mürekkebi, α-trikalsiyum fosfat sentezinden ve ardından gliserol, polisorbat 80 ve amonyum fosfat dibazik ile kombinasyonundan başlayarak sentezlenir. (B) GelMA mikrojelleri, yağda su emülsiyonu yöntemi ile üretilir. Elde edilen mikrojeller daha sonra (C) hidratlanır ve (D) hücrelerle birleştirilir. Hücre-mikrojel kompozitler daha sonra kemik-mürekkebin biriktirildiği granüler bir banyo olarak kullanılır. (E) Tüm yapı daha sonra UV çapraz bağlanır ve kültür için inkübatöre aktarılır. Kısaltmalar: α-TCP = α-trikalsiyum fosfat; GelMA = jelatin metakrilat. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
3D baskı tekniği COBICS, mineralize kemik benzeri yapıların ekstrüzyon yoluyla canlı hücreler içeren çapraz bağlanabilir bir mikrojel süspansiyonuna üretilmesini sağlamak için geliştirilmiştir. Teknik, parçalanabilir bir mikrojel süspansiyonuna uygulanmıştır ve hücreler sistem içinde iyi canlılık, yayılma ve osteojenik farklılaşma yeteneği gösterir11. Bu teknik kullanılarak oluşturulan yapıların başarısının önemli bir belirleyicisi, α-TCP tabanlı kemik mür…
Declarações
The authors have nothing to disclose.
Acknowledgements
Yazarlar, Ulusal Sağlık ve Tıbbi Araştırma Konseyi’ne (Hibe no. GNT1111694 ve GNT1141602) ve Avustralya Araştırma Konseyi’ne (Hibe no. FT180100417, FL150100060 ve CE14100036) teşekkür etmek istemektedir. Yazarlar, New South Wales Üniversitesi’ndeki Biyomedikal Görüntüleme Tesisi’ne teşekkür etmek istiyor. Rakamlar Biorender.com, Adobe Photoshop ve Adobe Illustrator ile oluşturulmuştur ve ücretli bir abonelik altında dışa aktarılmıştır.
Materials
| 3D Printer Extruder | Hyrel3D | EMO-25 | |
| 50 mL centrifuge tubes | Falcon | BDAA352070 | |
| Absolute Ethanol 100% Denatured | Chem-Supply | ||
| Acetone | Chem-Supply | 154871 | |
| Alumina crucible | Coors | ||
| Ammonium phosphate dibasic (NaHPO4) | Sigma | A5764 | |
| Autodesk Fusion 360 | Autodesk | ||
| Biosafety cabinet level 2 | |||
| Calcium carbonate | Sigma | 239216 | |
| Calcium hydrogen phosphate (CaHPO4) | Sigma | C7263 | |
| Cell culture flasks | Corning | various volumes used | |
| Cellulose Dialysis Tubes, 14 kDa cut-off | Sigma | D9777 | |
| Centrifuge | Eppendorf | 5430R | |
| Centrifuge | Sigma | 3-16KL | |
| Dispensing Tip, 23 G | Nordson | 7018302 | |
| DMEM, low glucose, pyruvate | Thermo FIsher | 11885084 | |
| DPBS, no calcium, no magnesium | Thermo FIsher | 14190144 | |
| Elevator furnace | Labec | ||
| Engine HR Multihead Printer | Hyrel3D | ||
| Fetal Bovine Serum | Bovogen | ||
| Gelatin type A, from porcine skin | Sigma | G2500 | |
| General Purpose Stainless Steel Tips | Nordson EF | ||
| Glycerol | Sigma | G9012 | |
| Human adipose derived stem cells | ATCC | PCS-500-011 | |
| LSM 800 Confocal Microscope | ZEISS | ||
| Lyophilizer (Alpha 1-4 LDplus) | Christ | 101541 | |
| Magnetic hot plate and stirrer | |||
| Methacrylic anhydride | Sigma | 276685 | |
| Mini 2 Desktop 3D Printer | LulzBot | ||
| Parafilm sealing film | Parafilm | PM996 | |
| Penicillin-Streptomycin | Thermo FIsher | 15140122 | |
| Planetary ball mill | |||
| Planetary ball mill jar | |||
| Polyoxyethylenesorbitan monooleate Tween-80 | Sigma | P6224 | |
| Scanning electron microscope | FEI Nova NanoSEM 450 FE-SEM | ||
| Science Kimwipes Delicate Task Wipers | Kimtech | 18813156 | |
| Stainless steel standard test sieve | |||
| Sunflower Oil | Community Co | ||
| Trypsin-EDTA 0.25% phenol red | Thermo FIsher | 25200056 | |
| ZEN Microscope Software | ZEISS | ||
| Live/Dead viability/ cytotoxicity kit for mammalian cells | Invitrogen | L3224 | |
| DMEM, low glucose, no phenol red | Thermo Fisher | 11054020 |
Referências
- Bates, P., Ramachandran, M. Bone injury, healing and grafting. Basic Orthopaedic Sciences. The Stanmore Guide. , 123-134 (2007).
- Lin, X., et al. The bone extracellular matrix in bone formation and regeneration. Frontiers in Pharmacology. 11, 757 (2020).
- Reznikov, N., et al. A materials science vision of extracellular matrix mineralization. Nature Reviews Materials. 1, 16041 (2016).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Lin, K., et al. 3D printing of bioceramic scaffolds-Barriers to the clinical translation: From promise to reality, and future perspectives. Materials. 12 (17), 2660 (2019).
- Qu, M., et al. Multi-dimensional printing for bone tissue engineering. Advanced Healthcare Materials. 10 (11), 2001986 (2021).
- Lode, A., et al. Fabrication of porous scaffolds by three-dimensional plotting of a pasty calcium phosphate bone cement under mild conditions. Journal of Tissue Engineering and Regenerative Medicine. 8 (9), 682-693 (2014).
- Bernal, P. N., et al. Volumetric bioprinting of complex living-tissue constructs within seconds. Advanced Materials. 31 (42), 1904209 (2019).
- Diloksumpan, P., et al. Combining multi-scale 3D printing technologies to engineer reinforced hydrogel-ceramic interfaces. Biofabrication. 12 (2), 025014 (2020).
- Thrivikraman, G., et al. Rapid fabrication of vascularized and innervated cell-laden bone models with biomimetic intrafibrillar collagen mineralization. Nature Communications. 10 (1), 3520 (2019).
- Romanazzo, S., et al. Synthetic bone-like structures through omnidirectional ceramic bioprinting in cell suspensions. Advanced Functional Materials. 31 (13), 2008216 (2021).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758 (2015).
- Phromsopha, T., Baimark, Y. Preparation of starch/gelatin blend microparticles by a water-in-oil emulsion method for controlled release drug delivery. International Journal of Biomaterials. 2014, 829490 (2014).
- Moreno, D., et al. Solid-state synthesis of alpha tricalcium phosphate for cements used in biomedical applications. Boletín de la Sociedad Española de Cerámica y Vidrio. 59 (5), 193-200 (2020).

