用于生成骨类似物的细胞悬浮液中的陶瓷全向生物打印
Summary
该协议描述了一种3D打印技术,通过将磷酸钙墨水沉积在基于明胶的颗粒载体中来制造骨状结构。印刷的骨类似物以自由形式沉积,具有直接收获印刷品或在活细胞基质内交联以进行多相构建体的灵活性。
Abstract
在结构上,骨组织是一种无机有机复合材料,含有嵌入分层、高度矿化基质中的代谢活性细胞。由于骨骼的异质环境,这种组织很难复制。细胞悬浮液中的陶瓷全向生物打印(COBICS)是一种基于微凝胶的生物打印技术,可独特地复制骨骼的矿物质和细胞结构。COBICS打印复杂的生物学相关结构,无需牺牲支撑材料或苛刻的后处理步骤(例如辐射和高温烧结),这是骨模拟结构增材制造中的两个最大挑战。该技术是通过在明胶基微凝胶悬浮液中自由挤出新型磷酸钙基油墨来实现的。悬浮液的屈服应力特性允许沉积并支撑打印的骨结构。然后紫外线交联和纳米沉淀将其“锁定”到位。在充满细胞的生物材料中打印纳米结构的模拟骨陶瓷的能力提供了对宏观和微观结构的时空控制,并促进了临床环境中复杂骨骼结构的实时制造。
Introduction
骨骼具有非凡的再生能力,是体内为数不多的可以通过重建其正常的细胞组成、方向和机械强度来愈合的结构之一,直到内源性愈合能力受损时出现严重的缺陷大小1.骨骼与软骨和韧带一起支持和促进身体运动,同时还储存矿物质和脂肪并产生血细胞。骨作为一种坚硬、致密的结缔组织,主要由无机相、水和主要由胶原纤维组成的有机物质组成2。细胞嵌入这种高度矿化的胶原蛋白I纤维和羟基磷灰石(HA)晶体基质中,形成分层结构3。
这种组织的复杂组织使得合成替代品的制造变得异常具有挑战性3.为此,已经提出了各种材料,包括生物陶瓷,富含细胞的水凝胶和合成材料作为创建骨基质的解决方案。在支架制造技术中,基于3D打印的技术最近出现并受到组织工程界的广泛关注,因为它们具有制造高度复杂和精密结构的卓越能力,具有患者特异性治疗的巨大前景4,5,6.水凝胶一直是基质模拟物和生物墨水最受欢迎的选择,因为它们可以与细胞和生物活性分子一起打印,产生功能构建体6。然而,水凝胶缺乏骨骼的功能特性,例如机械强度和含有代谢活性细胞的高度钙化无机相。
3D打印陶瓷支架通常需要后处理步骤,包括烧结,高温处理或使用刺激性化学品,这些化学品必须在体外或体内应用之前彻底清洗5。为了解决这些限制,Lode等人7最近开发了一种由羟基磷灰石形成的α-三钙磷酸盐基糊剂,可以在生理条件下印刷和凝固。然而,这种材料仍然不能与活细胞一起打印,因为它需要在潮湿的环境中进行后处理,然后长时间浸泡水溶液。
或者,已经提出了含有无机颗粒的含有细胞的水凝胶作为3D骨基质8,9的替代品。尽管它们具有很强的支持细胞活力的能力,但它们无法概括密集的矿化骨组织环境。Thrivikarman等人10 采用了仿生方法,其中过饱和钙和磷酸盐培养基与非胶原蛋白类似物一起使用,以更好地模拟纳米级磷灰石沉积。然而,他们的结构仍然无法生成具有类似于骨骼的微观和宏观尺度架构的刚性3D结构。
本研究通过开发打印策略来解决这些缺点,以在无机和有机相中制造能够整合细胞和生长因子的骨骼模拟构建体11。COBICS使用基于微凝胶的生物打印技术独特地概括了骨骼的矿物质和细胞结构。本文中的协议描述了合成陶瓷骨墨水和基于明胶的微凝胶,然后组合实现COBICS的细胞的过程。该过程从骨墨的主要前体材料的合成开始。然后将可交联的水凝胶合成并形成微凝胶。最后,将骨墨水全向沉积在装有细胞的微凝胶的支撑浴中(图1)。
骨墨水可以打印到具有适当屈服应力特性的任何微凝胶悬浮液中,即能够以特定的剪切速率流化并随后支撑沉积结构。已经证明了两种灵活的方法:由明胶微凝胶组成的悬浮液和由甲基丙烯酸明胶(GelMA)微凝胶组成的悬浮液。前者悬浮液在温度升至37°C时溶解,悬浮水凝胶的自由形式可逆包埋(FRESH)技术12,而后者可以在印刷后进行光交联,有效地将微凝胶“缝合”在一起并将印刷的骨墨锁定到位。本研究的重点是使用GelMA作为基质,因为它提供了能够通过原 位 打印复杂骨模拟结构来支持细胞生长的独特优势。最终,这种方法能够生成具有高水平仿生学的复杂组织模型,并对疾病建模、药物发现和再生工程具有广泛的影响。
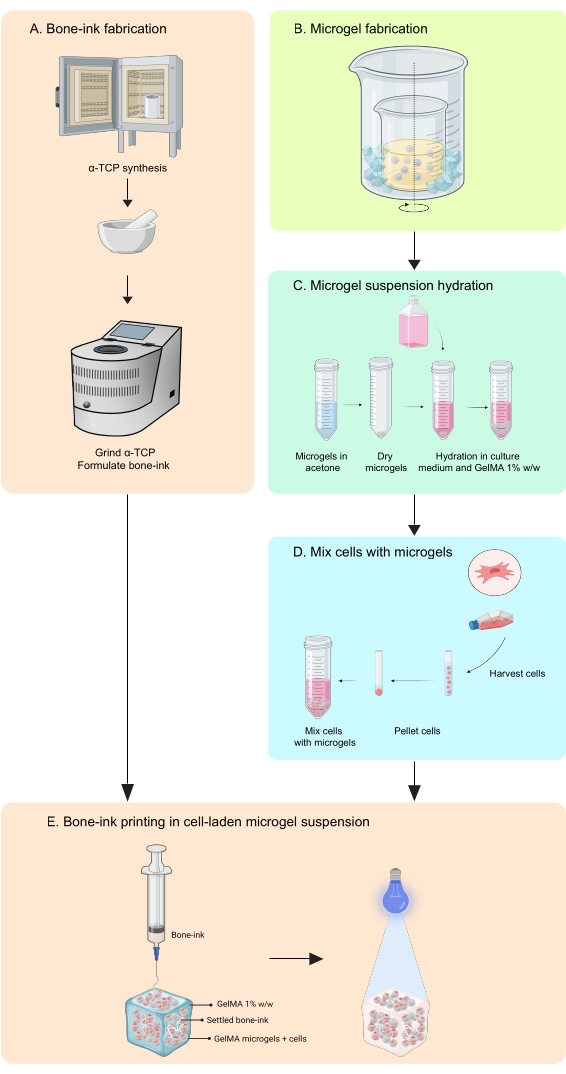
图 1:工作流程示意图 。 (A)骨墨从α-磷酸三钙合成开始,随后与甘油,聚山梨醇酯80和磷酸二铵结合。(B)GelMA微凝胶采用油包水乳液法制备。然后将获得的微凝胶(C)水合和(D)与细胞结合。然后将细胞微凝胶复合材料用作颗粒浴,其中沉积骨墨。(E)然后将整个构建体紫外线交联并转移到培养箱中进行培养。缩写:α-TCP = α-磷酸三钙;GelMA =甲基丙烯酸明胶。请点击此处查看此图的大图。
Protocol
Representative Results
Discussion
开发3D打印技术COBIS是为了通过挤出成含有活细胞的可交联微凝胶悬浮液来制造矿化的骨状结构。该技术已应用于可降解微凝胶悬浮液,并且细胞在系统内显示出良好的活力、扩散和成骨分化能力11。使用这种技术创建的构造成功的关键决定因素是基于α-TCP的骨墨水的正确合成。首先,α-TCP的形成在很大程度上取决于适当的温度控制。为了形成正确的磷酸三钙相,在反应越过相界?…
Declarações
The authors have nothing to disclose.
Acknowledgements
作者要感谢国家健康和医学研究委员会(批准号GNT1111694和GNT1141602)和澳大利亚研究委员会(批准号FT180100417,FL150100060和CE14100036)。作者要感谢新南威尔士大学的生物医学成像设施。图表是用 Biorender.com、Adobe Photoshop和Adobe Illustrator创建的,并已通过付费订阅导出。
Materials
| 3D Printer Extruder | Hyrel3D | EMO-25 | |
| 50 mL centrifuge tubes | Falcon | BDAA352070 | |
| Absolute Ethanol 100% Denatured | Chem-Supply | ||
| Acetone | Chem-Supply | 154871 | |
| Alumina crucible | Coors | ||
| Ammonium phosphate dibasic (NaHPO4) | Sigma | A5764 | |
| Autodesk Fusion 360 | Autodesk | ||
| Biosafety cabinet level 2 | |||
| Calcium carbonate | Sigma | 239216 | |
| Calcium hydrogen phosphate (CaHPO4) | Sigma | C7263 | |
| Cell culture flasks | Corning | various volumes used | |
| Cellulose Dialysis Tubes, 14 kDa cut-off | Sigma | D9777 | |
| Centrifuge | Eppendorf | 5430R | |
| Centrifuge | Sigma | 3-16KL | |
| Dispensing Tip, 23 G | Nordson | 7018302 | |
| DMEM, low glucose, pyruvate | Thermo FIsher | 11885084 | |
| DPBS, no calcium, no magnesium | Thermo FIsher | 14190144 | |
| Elevator furnace | Labec | ||
| Engine HR Multihead Printer | Hyrel3D | ||
| Fetal Bovine Serum | Bovogen | ||
| Gelatin type A, from porcine skin | Sigma | G2500 | |
| General Purpose Stainless Steel Tips | Nordson EF | ||
| Glycerol | Sigma | G9012 | |
| Human adipose derived stem cells | ATCC | PCS-500-011 | |
| LSM 800 Confocal Microscope | ZEISS | ||
| Lyophilizer (Alpha 1-4 LDplus) | Christ | 101541 | |
| Magnetic hot plate and stirrer | |||
| Methacrylic anhydride | Sigma | 276685 | |
| Mini 2 Desktop 3D Printer | LulzBot | ||
| Parafilm sealing film | Parafilm | PM996 | |
| Penicillin-Streptomycin | Thermo FIsher | 15140122 | |
| Planetary ball mill | |||
| Planetary ball mill jar | |||
| Polyoxyethylenesorbitan monooleate Tween-80 | Sigma | P6224 | |
| Scanning electron microscope | FEI Nova NanoSEM 450 FE-SEM | ||
| Science Kimwipes Delicate Task Wipers | Kimtech | 18813156 | |
| Stainless steel standard test sieve | |||
| Sunflower Oil | Community Co | ||
| Trypsin-EDTA 0.25% phenol red | Thermo FIsher | 25200056 | |
| ZEN Microscope Software | ZEISS | ||
| Live/Dead viability/ cytotoxicity kit for mammalian cells | Invitrogen | L3224 | |
| DMEM, low glucose, no phenol red | Thermo Fisher | 11054020 |
Referências
- Bates, P., Ramachandran, M. Bone injury, healing and grafting. Basic Orthopaedic Sciences. The Stanmore Guide. , 123-134 (2007).
- Lin, X., et al. The bone extracellular matrix in bone formation and regeneration. Frontiers in Pharmacology. 11, 757 (2020).
- Reznikov, N., et al. A materials science vision of extracellular matrix mineralization. Nature Reviews Materials. 1, 16041 (2016).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Lin, K., et al. 3D printing of bioceramic scaffolds-Barriers to the clinical translation: From promise to reality, and future perspectives. Materials. 12 (17), 2660 (2019).
- Qu, M., et al. Multi-dimensional printing for bone tissue engineering. Advanced Healthcare Materials. 10 (11), 2001986 (2021).
- Lode, A., et al. Fabrication of porous scaffolds by three-dimensional plotting of a pasty calcium phosphate bone cement under mild conditions. Journal of Tissue Engineering and Regenerative Medicine. 8 (9), 682-693 (2014).
- Bernal, P. N., et al. Volumetric bioprinting of complex living-tissue constructs within seconds. Advanced Materials. 31 (42), 1904209 (2019).
- Diloksumpan, P., et al. Combining multi-scale 3D printing technologies to engineer reinforced hydrogel-ceramic interfaces. Biofabrication. 12 (2), 025014 (2020).
- Thrivikraman, G., et al. Rapid fabrication of vascularized and innervated cell-laden bone models with biomimetic intrafibrillar collagen mineralization. Nature Communications. 10 (1), 3520 (2019).
- Romanazzo, S., et al. Synthetic bone-like structures through omnidirectional ceramic bioprinting in cell suspensions. Advanced Functional Materials. 31 (13), 2008216 (2021).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758 (2015).
- Phromsopha, T., Baimark, Y. Preparation of starch/gelatin blend microparticles by a water-in-oil emulsion method for controlled release drug delivery. International Journal of Biomaterials. 2014, 829490 (2014).
- Moreno, D., et al. Solid-state synthesis of alpha tricalcium phosphate for cements used in biomedical applications. Boletín de la Sociedad Española de Cerámica y Vidrio. 59 (5), 193-200 (2020).

