Bioprinting omnidirezionale ceramico in sospensioni caricate di cellule per la generazione di analoghi ossei
Summary
Questo protocollo descrive una tecnica di stampa 3D per fabbricare strutture simili all’osso depositando un inchiostro di fosfato di calcio in un supporto granulare a base di gelatina. Gli analoghi ossei stampati sono depositati in forma libera, con flessibilità per la raccolta diretta della stampa o la reticolazione all’interno di una matrice cellulare vivente per costrutti multifasici.
Abstract
Strutturalmente, il tessuto osseo è un composito inorganico-organico contenente cellule metabolicamente attive incorporate all’interno di una matrice gerarchica altamente mineralizzata. Questa organizzazione è difficile da replicare a causa dell’ambiente eterogeneo dell’osso. Il bioprinting omnidirezionale ceramico in sospensioni cellulari (COBICS) è una tecnica di bioprinting basata su microgel che replica in modo univoco la struttura minerale e cellulare dell’osso. COBICS stampa costrutti complessi e biologicamente rilevanti senza la necessità di materiali di supporto sacrificali o fasi di post-elaborazione difficili (ad esempio, radiazioni e sinterizzazione ad alta temperatura), che sono due delle maggiori sfide nella produzione additiva di costrutti mimetici ossei. Questa tecnica è resa possibile tramite l’estrusione a forma libera di un nuovo inchiostro a base di fosfato di calcio all’interno di una sospensione di microgel a base di gelatina. Le proprietà di tensione di snervamento della sospensione consentono la deposizione e supportano la struttura ossea stampata. La reticolazione UV e la nanoprecipitazione lo “bloccano” in posizione. La capacità di stampare ceramiche nanostrutturate osseo-mimetiche all’interno di biomateriali carichi di cellule fornisce un controllo spaziotemporale sulla macro e micro-architettura e facilita la fabbricazione in tempo reale di complessi costrutti ossei in contesti clinici.
Introduction
L’osso ha notevoli capacità di rigenerazione come una delle poche strutture del corpo che può guarire ricreando la sua normale composizione cellulare, l’orientamento e la forza meccanica fino a una dimensione critica del difetto, quando la capacità di guarigione endogena è compromessa1. L’osso, insieme alla cartilagine e al legamento, supporta e facilita il movimento del corpo, immagazzinando anche minerali e grassi e producendo cellule del sangue. Come tessuto connettivo duro e denso, l’osso è composto principalmente da una fase inorganica, acqua e materiale organico composto principalmente da fibre di collagene2. Le cellule sono incorporate all’interno di questa matrice altamente mineralizzata di fibre di collagene I e cristalli di idrossiapatite (HA), formando una struttura gerarchica3.
La complessa organizzazione di questo tessuto rende eccezionalmenteimpegnativa la fabbricazione di alternative sintetiche per replicare i micro e nano-ambienti ossei eterogenei 3. A tale scopo, una varietà di materiali, tra cui bioceramiche, idrogel carichi di cellule e materiali sintetici sono stati proposti come soluzioni per creare matrici ossee. Tra le tecniche di fabbricazione degli scaffold sono recentemente emerse tecniche basate sulla stampa 3D che hanno ricevuto molta attenzione dalla comunità dell’ingegneria tissutale grazie alla loro notevole capacità di consentire la fabbricazione di strutture altamente sofisticate e precise con grandi promesse di trattamento specifico per il paziente 4,5,6 . Gli idrogel sono stati la scelta più popolare di imitazioni a matrice e bio-inchiostri poiché possono essere stampati insieme a cellule e molecole bioattive, generando costrutti funzionali6. Tuttavia, gli idrogel mancano delle proprietà funzionali dell’osso, come la resistenza meccanica e una fase altamente calcificata e inorganica contenente cellule metabolicamente attive.
Gli scaffold ceramici stampati in 3D richiedono in genere fasi di post-elaborazione, tra cui sinterizzazione, trattamenti ad alta temperatura o utilizzo di sostanze chimiche aggressive che devono essere accuratamente lavate prima delle applicazioni in vitro o in vivo 5. Per ovviare a queste limitazioni, Lode et al.7 hanno recentemente sviluppato una pasta a base di fosfato α-tricalcico formata da idrossiapatite, che può essere stampata e impostata in condizioni fisiologiche. Tuttavia, questo materiale non può ancora essere stampato insieme a cellule vive in quanto richiede un post-trattamento in un ambiente umido e la successiva immersione in soluzione acquosa per un lungo periodo.
In alternativa, sono stati proposti idrogel carichi di cellule con particelle inorganiche incorporate in sostituzione della matrice ossea 3D 8,9. Nonostante la loro grande capacità di supportare la vitalità cellulare, non sono in grado di ricapitolare l’ambiente densamente mineralizzato del tessuto osseo. Thrivikarman et al.10 hanno adottato un approccio biomimetico in cui è stato utilizzato un mezzo supersaturo di calcio e fosfato con un analogo proteico non collagenoso per imitare meglio la deposizione di apatite su scala nanometrica. Tuttavia, i loro costrutti non possono ancora generare costrutti 3D rigidi con un’architettura su micro e macro scala simile all’osso.
Il presente studio affronta queste carenze attraverso lo sviluppo di una strategia di stampa per fabbricare costrutti che imitano l’osso, in fasi inorganiche e organiche, che sono in grado di integrare sia le cellule che i fattori di crescita11. COBICS ricapitola in modo univoco la struttura minerale e cellulare dell’osso utilizzando una tecnica di bioprinting basata su microgel. Il protocollo qui descritto descrive il processo di sintesi dell’inchiostro ceramico e dei microgel a base di gelatina e quindi la combinazione di cellule che abilitano COBICS. Il processo inizia con la sintesi del principale materiale precursore dell’inchiostro osseo. L’idrogel reticolabile viene quindi sintetizzato e formato in microgel. Infine, l’inchiostro osseo viene depositato omnidirezionalmente in un bagno di supporto dei microgel carichi di cellule (Figura 1).
L’inchiostro osseo può essere stampato in qualsiasi sospensione di microgel che hanno le appropriate caratteristiche di snervamento, cioè la capacità di fluidizzare ad una specifica velocità di taglio e successivamente sostenere la struttura depositata. Sono stati dimostrati due approcci flessibili: una sospensione costituita da microgel di gelatina e una sospensione costituita da microgel di gelatina metacrilato (GelMA). La prima sospensione si dissolve quando la temperatura viene portata a 37 °C, l’incorporazione reversibile a forma libera di idrogel sospesi (FRESH) tecnica12, mentre la seconda può essere fotoreticolata dopo la stampa, “cucendo” efficacemente i microgel insieme e bloccando l’inchiostro osseo stampato in posizione. Il presente studio si concentra sull’utilizzo di GelMA come matrice in quanto offre il vantaggio unico di essere in grado di supportare la crescita cellulare con la stampa in situ di strutture mimetiche ossee complesse. In definitiva, questo approccio consente la generazione di modelli tissutali complessi con alti livelli di biomimetica e ampie implicazioni per la modellazione delle malattie, la scoperta di farmaci e l’ingegneria rigenerativa.
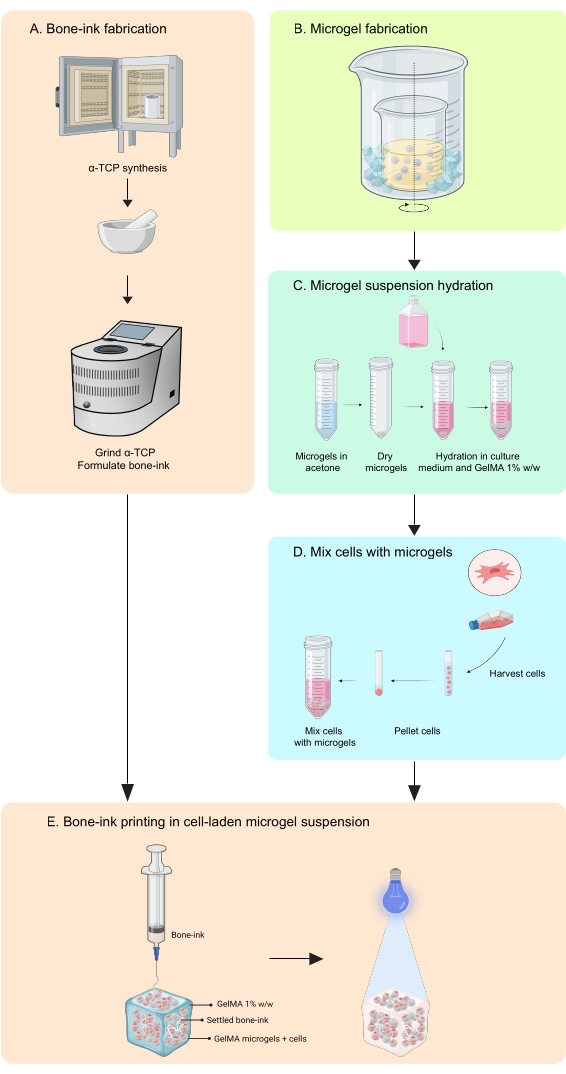
Figura 1: Schema del flusso di lavoro . (A) L’inchiostro osseo viene sintetizzato a partire dalla sintesi del fosfato α-tricalcico e dalla sua successiva combinazione con glicerolo, polisorbato 80 e fosfato di ammonio bibasico. (B) I microgel GelMA sono fabbricati con il metodo dell’emulsione acqua-in-olio. I microgel ottenuti sono quindi (C) idratati e (D) combinati con le cellule. I compositi di microgel cellulare vengono quindi utilizzati come bagno granulare in cui viene depositato l’inchiostro osseo. (E) L’intero costrutto viene quindi reticolato UV e trasferito all’incubatore per la cultura. Abbreviazioni: α-TCP = fosfato α-tricalcico; GelMA = metacrilato di gelatina. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Protocol
Representative Results
Discussion
La tecnica di stampa 3D COBICS è stata sviluppata per consentire la fabbricazione di strutture simili a ossa mineralizzate tramite estrusione in una sospensione di microgel reticolabile contenente cellule vive. La tecnica è stata applicata a una sospensione di microgel degradabile e le cellule mostrano una buona vitalità, diffusione e capacità di differenziazione osteogenica all’interno del sistema11. Un fattore determinante per il successo dei costrutti creati utilizzando questa tecnica è la…
Declarações
The authors have nothing to disclose.
Acknowledgements
Gli autori desiderano ringraziare il National Health and Medical Research Council (Grant no. GNT1111694 e GNT1141602) e l’Australian Research Council (Grant no. FT180100417, FL150100060 e CE14100036). Gli autori vorrebbero riconoscere la Biomedical Imaging Facility presso l’Università del New South Wales. Le figure sono state create con Biorender.com, Adobe Photoshop e Adobe Illustrator e sono state esportate con un abbonamento a pagamento.
Materials
| 3D Printer Extruder | Hyrel3D | EMO-25 | |
| 50 mL centrifuge tubes | Falcon | BDAA352070 | |
| Absolute Ethanol 100% Denatured | Chem-Supply | ||
| Acetone | Chem-Supply | 154871 | |
| Alumina crucible | Coors | ||
| Ammonium phosphate dibasic (NaHPO4) | Sigma | A5764 | |
| Autodesk Fusion 360 | Autodesk | ||
| Biosafety cabinet level 2 | |||
| Calcium carbonate | Sigma | 239216 | |
| Calcium hydrogen phosphate (CaHPO4) | Sigma | C7263 | |
| Cell culture flasks | Corning | various volumes used | |
| Cellulose Dialysis Tubes, 14 kDa cut-off | Sigma | D9777 | |
| Centrifuge | Eppendorf | 5430R | |
| Centrifuge | Sigma | 3-16KL | |
| Dispensing Tip, 23 G | Nordson | 7018302 | |
| DMEM, low glucose, pyruvate | Thermo FIsher | 11885084 | |
| DPBS, no calcium, no magnesium | Thermo FIsher | 14190144 | |
| Elevator furnace | Labec | ||
| Engine HR Multihead Printer | Hyrel3D | ||
| Fetal Bovine Serum | Bovogen | ||
| Gelatin type A, from porcine skin | Sigma | G2500 | |
| General Purpose Stainless Steel Tips | Nordson EF | ||
| Glycerol | Sigma | G9012 | |
| Human adipose derived stem cells | ATCC | PCS-500-011 | |
| LSM 800 Confocal Microscope | ZEISS | ||
| Lyophilizer (Alpha 1-4 LDplus) | Christ | 101541 | |
| Magnetic hot plate and stirrer | |||
| Methacrylic anhydride | Sigma | 276685 | |
| Mini 2 Desktop 3D Printer | LulzBot | ||
| Parafilm sealing film | Parafilm | PM996 | |
| Penicillin-Streptomycin | Thermo FIsher | 15140122 | |
| Planetary ball mill | |||
| Planetary ball mill jar | |||
| Polyoxyethylenesorbitan monooleate Tween-80 | Sigma | P6224 | |
| Scanning electron microscope | FEI Nova NanoSEM 450 FE-SEM | ||
| Science Kimwipes Delicate Task Wipers | Kimtech | 18813156 | |
| Stainless steel standard test sieve | |||
| Sunflower Oil | Community Co | ||
| Trypsin-EDTA 0.25% phenol red | Thermo FIsher | 25200056 | |
| ZEN Microscope Software | ZEISS | ||
| Live/Dead viability/ cytotoxicity kit for mammalian cells | Invitrogen | L3224 | |
| DMEM, low glucose, no phenol red | Thermo Fisher | 11054020 |
Referências
- Bates, P., Ramachandran, M. Bone injury, healing and grafting. Basic Orthopaedic Sciences. The Stanmore Guide. , 123-134 (2007).
- Lin, X., et al. The bone extracellular matrix in bone formation and regeneration. Frontiers in Pharmacology. 11, 757 (2020).
- Reznikov, N., et al. A materials science vision of extracellular matrix mineralization. Nature Reviews Materials. 1, 16041 (2016).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Lin, K., et al. 3D printing of bioceramic scaffolds-Barriers to the clinical translation: From promise to reality, and future perspectives. Materials. 12 (17), 2660 (2019).
- Qu, M., et al. Multi-dimensional printing for bone tissue engineering. Advanced Healthcare Materials. 10 (11), 2001986 (2021).
- Lode, A., et al. Fabrication of porous scaffolds by three-dimensional plotting of a pasty calcium phosphate bone cement under mild conditions. Journal of Tissue Engineering and Regenerative Medicine. 8 (9), 682-693 (2014).
- Bernal, P. N., et al. Volumetric bioprinting of complex living-tissue constructs within seconds. Advanced Materials. 31 (42), 1904209 (2019).
- Diloksumpan, P., et al. Combining multi-scale 3D printing technologies to engineer reinforced hydrogel-ceramic interfaces. Biofabrication. 12 (2), 025014 (2020).
- Thrivikraman, G., et al. Rapid fabrication of vascularized and innervated cell-laden bone models with biomimetic intrafibrillar collagen mineralization. Nature Communications. 10 (1), 3520 (2019).
- Romanazzo, S., et al. Synthetic bone-like structures through omnidirectional ceramic bioprinting in cell suspensions. Advanced Functional Materials. 31 (13), 2008216 (2021).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758 (2015).
- Phromsopha, T., Baimark, Y. Preparation of starch/gelatin blend microparticles by a water-in-oil emulsion method for controlled release drug delivery. International Journal of Biomaterials. 2014, 829490 (2014).
- Moreno, D., et al. Solid-state synthesis of alpha tricalcium phosphate for cements used in biomedical applications. Boletín de la Sociedad Española de Cerámica y Vidrio. 59 (5), 193-200 (2020).

