骨類似体の生成のための細胞内懸濁液中のセラミック全方向性バイオプリンティング
Summary
このプロトコルは、ゼラチンベースの顆粒支持体にリン酸カルシウムインクを堆積させることによって骨様構造を作製する3D印刷技術を説明する。印刷された骨類似体は自由形態で寄託され、多相構築物用の生細胞マトリックス内で印刷物を直接採取したり架橋したりするための柔軟性を備えています。
Abstract
構造的には、骨組織は、階層的で高度に石灰化されたマトリックス内に埋め込まれた代謝活性細胞を含む無機-有機複合体です。この組織は、骨の不均一な環境のために複製することは困難です。細胞懸濁液中のセラミック全方向性バイオプリンティング(COBICS)は、骨のミネラルおよび細胞構造を独自に複製するミクロゲルベースのバイオプリンティング技術である。COBICSは、骨模倣コンストラクトの積層造形における最大の課題の2つである犠牲サポート材料や過酷な後処理ステップ(放射線や高温焼結など)を必要とせずに、複雑で生物学的に関連するコンストラクトを印刷します。この技術は、ゼラチンベースのミクロゲル懸濁液内の新規リン酸カルシウムベースのインクの自由形状押出によって可能になります。懸濁液の降伏応力特性は、沈着を可能にし、印刷された骨構造を支持する。UV架橋とナノ沈殿は、それを所定の位置に「ロック」します。細胞を含んだ生体材料内にナノ構造の骨模倣セラミックを印刷する機能は、マクロおよびミクロアーキテクチャの時空間制御を提供し、臨床現場での複雑な骨構造のリアルタイム製造を容易にします。
Introduction
骨は、内因性の治癒能力が損なわれる重大な欠陥サイズまで、正常な細胞組成、配向、および機械的強度を再現することによって治癒できる体内で数少ない構造の1つとして、顕著な再生能力を持っています1。骨は、軟骨や靭帯とともに、体の動きをサポートおよび促進すると同時に、ミネラルや脂肪を貯蔵し、血球を生成します。硬くて緻密な結合組織として、骨は主に無機相、水、およびコラーゲン線維を主成分とする有機材料で構成されています2。細胞は、コラーゲンI繊維とハイドロキシアパタイト(HA)結晶のこの高度にミネラル化されたマトリックス内に埋め込まれ、階層構造を形成します3。
この組織の複雑な構成は、不均一な骨のマイクロおよびナノ環境を再現するための合成代替物の製造を非常に困難にします3。この目的のために、バイオセラミックス、細胞を含んだヒドロゲル、合成材料など、さまざまな材料が骨マトリックスを作成するためのソリューションとして提案されています。足場製造技術の中で、3D印刷ベースの技術が最近登場し、患者固有の治療の大きな可能性を備えた高度に洗練された精密な構造の製造を可能にする優れた能力により、組織工学コミュニティから多くの注目を集めています4,5,6.ヒドロゲルは、細胞および生理活性分子と一緒に印刷して機能的構築物を生成することができるため、マトリックス模倣物およびバイオインクの最も一般的な選択肢である6。しかしながら、ヒドロゲルは、機械的強度および高度に石灰化された代謝活性細胞を含む無機相などの骨の機能的特性を欠いている。
3Dプリントされたセラミックスキャフォールドは通常、焼結、高温処理、またはin vitro または in vivo アプリケーションの前に徹底的に洗浄する必要がある過酷な化学物質の使用を含む後処理ステップを必要とします5。これらの制限に対処するために、Lodeら7 は最近、ハイドロキシアパタイトによって形成されたα-リン酸三カルシウムベースのペーストを開発し、生理学的条件下で印刷および設定することができます。ただし、この材料は、湿度の高い環境での後処理とそれに続く長期間の水溶液浸漬を必要とするため、生細胞と一緒に印刷することはできません。
あるいは、無機粒子が組み込まれた細胞を含んだヒドロゲルが、3D骨マトリックス8,9の代替物として提案されている。細胞の生存率をサポートする優れた能力にもかかわらず、高密度に石灰化した骨組織環境を再現することはできません。Thrivikarman et al.10は、ナノスケールのアパタイト堆積をよりよく模倣するために、過飽和カルシウムおよびリン酸媒体を非コラーゲン性タンパク質類似体と共に使用する生体模倣アプローチを採用した。しかし、それらの構造は、骨に似たミクロおよびマクロスケールのアーキテクチャを持つ剛性のある3D構造を生成することはできません。
本研究は、細胞と成長因子の両方を統合することができる無機相と有機相で骨模倣構造を製造するための印刷戦略の開発を通じて、これらの欠点に対処します11。COBICSは、ミクロゲルベースのバイオプリンティング技術を使用して、骨のミネラルおよび細胞構造を独自に再現します。本明細書のプロトコルは、セラミック骨インクおよびゼラチンベースのミクロゲルを合成し、次いでCOBICSを可能にする細胞を組み合わせるプロセスを記載する。このプロセスは、ボーンインクの主な前駆体材料の合成から始まります。次いで、架橋性ヒドロゲルを合成し、ミクロゲルに形成する。最後に、ボーンインクは、細胞を積んだミクロゲルの支持浴に全方向に堆積されます(図1)。
ボーンインクは、適切な降伏 – 応力特性、すなわち特定の剪断速度で流動化し、続いて堆積構造を支持する能力を有するミクロゲルの任意の懸濁液に印刷され得る。2つの柔軟なアプローチが実証されている:ゼラチンミクロゲルからなる懸濁液およびゼラチンメタクリレート(GelMA)ミクロゲルからなる懸濁液。前者の懸濁液は、温度が37°Cに上昇すると溶解し、懸濁ヒドロゲルの自由形状可逆包埋(FRESH)技術12であり、後者は印刷後に光架橋することができ、効果的に「ステッチ」して、印刷されたボーンインクを所定の位置にロックします。本研究では、複雑な骨模倣構造の in situ 印刷で細胞増殖をサポートできるという独自の利点を提供するため、GelMAをマトリックスとして使用することに焦点を当てています。最終的に、このアプローチにより、高レベルの生体模倣と疾患モデリング、創薬、再生工学に幅広い影響を与える複雑な組織モデルの生成が可能になります。
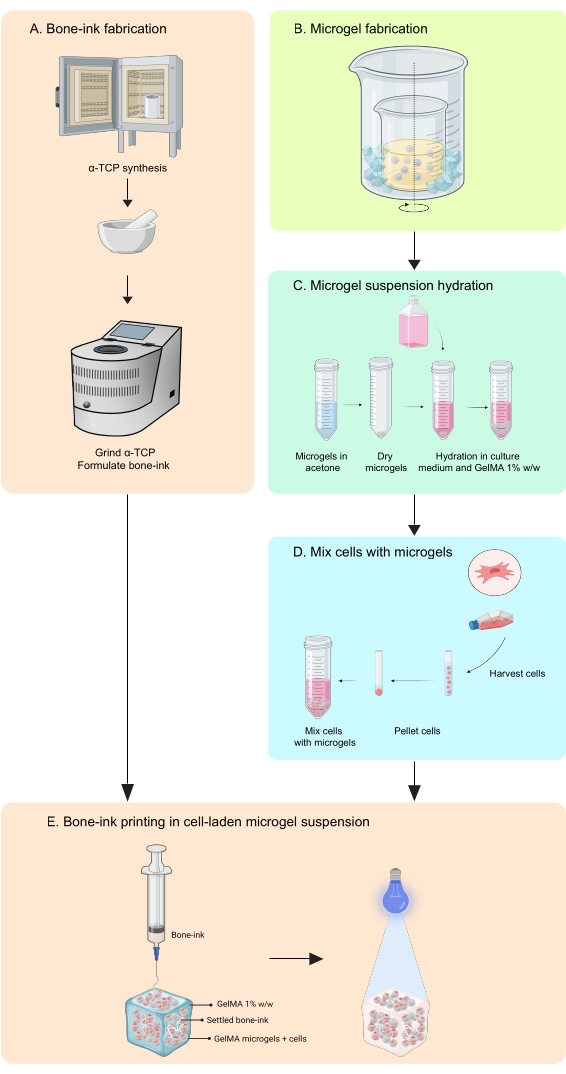
図1:ワークフローの概略図。 (A)骨インクは、α-リン酸三カルシウムの合成とそれに続くグリセロール、ポリソルベート80、リン酸二アンモニウムとの併用から開始して合成されます。(B)GelMAミクロゲルは、油中水型エマルジョン法により作製される。得られたミクロゲルは、次いで、(C)水和され、(D)細胞と結合される。次に、セル-ミクロゲル複合材料は、骨インクが堆積する粒状浴として使用されます。(E)次いで、構築物全体をUV架橋し、培養のためにインキュベーターに移す。略語:α-TCP =α-リン酸三カルシウム;GelMA=ゼラチンメタクリレート。この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
3D印刷技術COBICSは、生細胞を含む架橋可能なミクロゲル懸濁液への押し出しによる石灰化骨様構造の製造を可能にするために開発されました。この技術は、分解性ミクロゲル懸濁液に適用されており、細胞は、系11内で良好な生存率、拡散性、および骨形成分化能を示す。この手法を使用して作成されたコンストラクトの成功の重要な決定要因は、α-TCPベースのボーンインク…
Declarações
The authors have nothing to disclose.
Acknowledgements
著者らは、国立保健医療研究評議会(助成金番号GNT1111694およびGNT1141602)およびオーストラリア研究評議会(助成金番号FT180100417、FL150100060、およびCE14100036)に感謝したいと思います。著者らは、ニューサウスウェールズ大学の生物医学画像施設に感謝したいと思います。図は Biorender.com、Adobe Photoshop、Adobe Illustratorで作成され、有料サブスクリプションでエクスポートされています。
Materials
| 3D Printer Extruder | Hyrel3D | EMO-25 | |
| 50 mL centrifuge tubes | Falcon | BDAA352070 | |
| Absolute Ethanol 100% Denatured | Chem-Supply | ||
| Acetone | Chem-Supply | 154871 | |
| Alumina crucible | Coors | ||
| Ammonium phosphate dibasic (NaHPO4) | Sigma | A5764 | |
| Autodesk Fusion 360 | Autodesk | ||
| Biosafety cabinet level 2 | |||
| Calcium carbonate | Sigma | 239216 | |
| Calcium hydrogen phosphate (CaHPO4) | Sigma | C7263 | |
| Cell culture flasks | Corning | various volumes used | |
| Cellulose Dialysis Tubes, 14 kDa cut-off | Sigma | D9777 | |
| Centrifuge | Eppendorf | 5430R | |
| Centrifuge | Sigma | 3-16KL | |
| Dispensing Tip, 23 G | Nordson | 7018302 | |
| DMEM, low glucose, pyruvate | Thermo FIsher | 11885084 | |
| DPBS, no calcium, no magnesium | Thermo FIsher | 14190144 | |
| Elevator furnace | Labec | ||
| Engine HR Multihead Printer | Hyrel3D | ||
| Fetal Bovine Serum | Bovogen | ||
| Gelatin type A, from porcine skin | Sigma | G2500 | |
| General Purpose Stainless Steel Tips | Nordson EF | ||
| Glycerol | Sigma | G9012 | |
| Human adipose derived stem cells | ATCC | PCS-500-011 | |
| LSM 800 Confocal Microscope | ZEISS | ||
| Lyophilizer (Alpha 1-4 LDplus) | Christ | 101541 | |
| Magnetic hot plate and stirrer | |||
| Methacrylic anhydride | Sigma | 276685 | |
| Mini 2 Desktop 3D Printer | LulzBot | ||
| Parafilm sealing film | Parafilm | PM996 | |
| Penicillin-Streptomycin | Thermo FIsher | 15140122 | |
| Planetary ball mill | |||
| Planetary ball mill jar | |||
| Polyoxyethylenesorbitan monooleate Tween-80 | Sigma | P6224 | |
| Scanning electron microscope | FEI Nova NanoSEM 450 FE-SEM | ||
| Science Kimwipes Delicate Task Wipers | Kimtech | 18813156 | |
| Stainless steel standard test sieve | |||
| Sunflower Oil | Community Co | ||
| Trypsin-EDTA 0.25% phenol red | Thermo FIsher | 25200056 | |
| ZEN Microscope Software | ZEISS | ||
| Live/Dead viability/ cytotoxicity kit for mammalian cells | Invitrogen | L3224 | |
| DMEM, low glucose, no phenol red | Thermo Fisher | 11054020 |
Referências
- Bates, P., Ramachandran, M. Bone injury, healing and grafting. Basic Orthopaedic Sciences. The Stanmore Guide. , 123-134 (2007).
- Lin, X., et al. The bone extracellular matrix in bone formation and regeneration. Frontiers in Pharmacology. 11, 757 (2020).
- Reznikov, N., et al. A materials science vision of extracellular matrix mineralization. Nature Reviews Materials. 1, 16041 (2016).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Lin, K., et al. 3D printing of bioceramic scaffolds-Barriers to the clinical translation: From promise to reality, and future perspectives. Materials. 12 (17), 2660 (2019).
- Qu, M., et al. Multi-dimensional printing for bone tissue engineering. Advanced Healthcare Materials. 10 (11), 2001986 (2021).
- Lode, A., et al. Fabrication of porous scaffolds by three-dimensional plotting of a pasty calcium phosphate bone cement under mild conditions. Journal of Tissue Engineering and Regenerative Medicine. 8 (9), 682-693 (2014).
- Bernal, P. N., et al. Volumetric bioprinting of complex living-tissue constructs within seconds. Advanced Materials. 31 (42), 1904209 (2019).
- Diloksumpan, P., et al. Combining multi-scale 3D printing technologies to engineer reinforced hydrogel-ceramic interfaces. Biofabrication. 12 (2), 025014 (2020).
- Thrivikraman, G., et al. Rapid fabrication of vascularized and innervated cell-laden bone models with biomimetic intrafibrillar collagen mineralization. Nature Communications. 10 (1), 3520 (2019).
- Romanazzo, S., et al. Synthetic bone-like structures through omnidirectional ceramic bioprinting in cell suspensions. Advanced Functional Materials. 31 (13), 2008216 (2021).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758 (2015).
- Phromsopha, T., Baimark, Y. Preparation of starch/gelatin blend microparticles by a water-in-oil emulsion method for controlled release drug delivery. International Journal of Biomaterials. 2014, 829490 (2014).
- Moreno, D., et al. Solid-state synthesis of alpha tricalcium phosphate for cements used in biomedical applications. Boletín de la Sociedad Española de Cerámica y Vidrio. 59 (5), 193-200 (2020).

