ייצור וניצול מימן בכור ממברנות
Summary
כורי ממברנות מאפשרים הידרוגנציה בתנאי סביבה ללא קלט H2 ישיר. אנו יכולים לעקוב אחר ייצור המימן וניצולו במערכות אלה באמצעות ספקטרומטריית מסות אטמוספרית (atm-MS) וספקטרומטריית מסות כרומטוגרפיית גז (GC-MS).
Abstract
הידרוגנציה תעשייתית צורכת ~ 11 Mt של גז H2 שמקורו במאובנים בשנה. הקבוצה שלנו המציאה כור ממברנות כדי לעקוף את הצורך להשתמש בגז H2 לכימיה של הידרוגנציה. כור הממברנה שואב מימן ממים ומניע תגובות באמצעות חשמל מתחדש. בכור זה, חתיכה דקה של Pd מפרידה תא ייצור מימן אלקטרוכימי מתא הידרוגנציה כימי. ה-Pd בכור הממברנה פועל כ-(i) קרום סלקטיבי-מימני, (ii) קתודה, ו-(iii) זרז להידרוגנציה. כאן אנו מדווחים על השימוש בספקטרומטריית מסות אטמוספרית (atm-MS) ובספקטרומטריית מסה של כרומטוגרפיית גז (GC-MS) כדי להדגים כי הטיה אלקטרוכימית יישומית על פני קרום Pd מאפשרת הידרוגנציה יעילה ללא קלט H2 ישיר בכור ממברנה. עם atm-MS, מדדנו חדירת מימן של 73%, שאפשרה הידרוגנציה של פרופיופנון לפרופילבנזן עם 100% סלקטיביות, כפי שנמדד על ידי GC-MS. בניגוד להידרוגנציה אלקטרוכימית קונבנציונלית, המוגבלת לריכוזים נמוכים של חומר מוצא המומס באלקטרוליט פרוטי, ההפרדה הפיזית של ייצור המימן מניצול בכור הממברנה מאפשרת הידרוגנציה בכל ממס ובכל ריכוז. השימוש בריכוזים גבוהים ובמגוון רחב של ממסים חשוב במיוחד למדרגיות הכורים ולמסחור עתידי.
Introduction
תגובות הידרוגנציה תרמוכימיות משמשות ~ 20% מכל הסינתזה הכימית1. תגובות אלה דורשות כמויות גדולות של גז H 2, אשר נגזרים בדרך כלל דלקים מאובנים, טמפרטורות בין 150 ° C ו 600 ° C, ולחצים עד 200 אטמוספירה2. הידרוגנציה אלקטרוכימית היא דרך מושכת לעקוף דרישות אלה ולהניע תגובות הידרוגנציה באמצעות מים וחשמל מתחדש3. עבור הידרוגנציה אלקטרוכימית קונבנציונלית, חומר הזנה בלתי רווי מומס באלקטרוליט פרוטי בתא אלקטרוכימי. כאשר פוטנציאל מוחל על התא, חמצון מים מתרחש באנודה, בעוד הידרוגנציה מתרחשת בקתודה. במערך תגובה זה, הן חמצון מים אלקטרוכימי והן הידרוגנציה כימית מתרחשים באותה סביבת תגובה. המצע האורגני מומס באלקטרוליט פרוטי כדי לאפשר הן פיצול מים אלקטרוכימי והן הידרוגנציה של חומרי ההזנה. הקרבה של תגובות אלה יכולה להוביל להיווצרות תוצרי לוואי ופליטת אלקטרודות כאשר המגיב רגיש להתקפה נוקלאופילית או אם ריכוז המגיב גבוה מדי (>0.25 מטר)4.
אתגרים אלה הניעו את הקבוצה שלנו לחקור דרכים חלופיות להניע אלקטרוכימית תגובות הידרוגנציה 5,6,7. חיפוש זה הביא לשימוש בקרום Pd, המשמש בדרך כלל בהפרדת גזי מימן8. אנו משתמשים בו כאלקטרודה לאלקטרוליזה של מים בצד הכור האלקטרוכימי. יישום חדשני זה של קרום פלדיום מאפשר הפרדה פיזית של אתר חמצון המים האלקטרוכימי מאתר ההידרוגנציה הכימית. תצורת הכור המתקבלת כוללת שני תאים: 1) תא אלקטרוכימי לייצור מימן; ו-2) תא כימי להיצרות (איור 1). פרוטונים נוצרים בתא האלקטרוכימי על ידי הפעלת פוטנציאל על פני אנודת Pt וקרום Pd, המשמש גם כקתודה. פרוטונים אלה נודדים לאחר מכן לקרום Pd, שם הם מצטמצמים לאטומי מימן שנספגים על פני השטח. ניתן לחלק את התא האלקטרוכימי כך שיכלול קרום חילופי קטיונים אופציונלי כדי להקל על נדידת פרוטון זו. אטומי המימן הנספחים על פני השטח חודרים דרך האתרים האוקטהדרליים הבין-תאיים של סריג Pd fcc9 ומופיעים בצד הנגדי של הממברנה בתא ההידרוגנציה, שם הם מגיבים עם הקשרים הבלתי רוויים של חומר גלם נתון ליצירת תוצרים מוקשים 7,10,11,12,13,14,15,16. ה-Pd בכור הממברנה, אם כן, פועל כ-(i) קרום סלקטיבי-מימני, (ii) קתודה, ו-(iii) זרז להידרוגנציה.
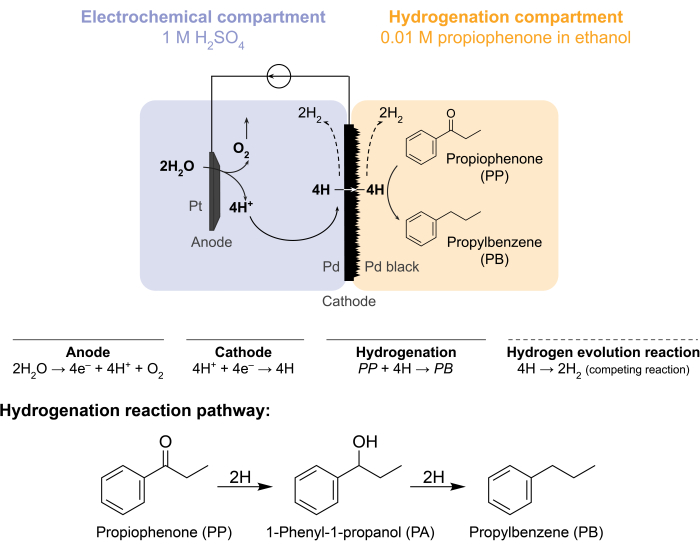
איור 1: הידרוגנציה בכור ממברנה. חמצון המים באנודה מייצר פרוטונים, אשר מופחתים על קתודה פלדיום. H מחלחל דרך קרום ה-Pd ומגיב עם פרופיופנון ליצירת פרופילבנזן. אבולוציה של מימן היא תגובה מתחרה שיכולה להתרחש משני צדי קרום הפלדיום. עבור ספקטרומטריית מסות אטמוספרית, לא נעשה שימוש בחומרי הזנה כימיים, מה שמחייב את H לעזוב את הכור בצורה של גז H2 בתאים האלקטרוכימיים או בתאי ההידרוגנציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כור הממברנה מורכב על ידי דחיסת קרום Pd בין תאי האנודה והקתודה של תא H אלקטרוכימי12. אורינגים עמידים בפני כימיקלים משמשים כדי לאבטח את הממברנה למקומה ולהבטיח אטימה ללא דליפות. התא האלקטרוכימי של כור הממברנה מכיל תמיסה מימית עשירה במימן. במחקר זה, אנו משתמשים ב- 1 M H 2 SO4 ובאנודה המורכבת מחוט Pt עטוף ברשת פלטינהבגודל 5 ס”מ2חלקים. האנודה שקועה בתמיסת האלקטרוליטים דרך חור בחלק העליון של התא האלקטרוכימי. תא ההידרוגנציה הכימית מכיל חומר הזנה ממס והידרוגנציה 7,10,11,12,16,17. החור בחלק העליון של תא H משמש לדגימה. הניסויים המוצגים כאן משתמשים בפרופיופנון 0.01 M באתנול כמזון הידרוגנציה. עם זאת, חומר המוצא (והריכוז) יכולים להיות מגוונים כדי להתאים לצרכי הניסוי. לדוגמה, חומר מוצא המכיל שרשרת פחמימנים ארוכה וקבוצה פונקציונלית אלקין עשוי להיות מומס בפנטאן כדי לשפר את המסיסות11. הזרם המופעל עבור התגובה יכול להיות בין 5 mA/cm 2 ל-300 mA/cm2. כל התגובות מתבצעות תחת טמפרטורת הסביבה והלחץ.
ספקטרומטריית מסה אטמוספרית (atm-MS) משמשת למדידת אחוז המימן בתא האלקטרוכימי המחלחל לתא ההידרוגנציה11,12. מדידה זו חשובה להבנת תשומות האנרגיה הדרושות לכור הממברנה, מכיוון שהיא חושפת את ניצול המימן המרבי האפשרי (כלומר, כמה מהמימן המיוצר יכול לשמש בפועל לתגובות הידרוגנציה). חדירת מימן דרך קרום Pd מחושבת על ידי מדידת כמות H2 המתפתחת הן מהתאים האלקטרוכימיים והן מתאי ההידרוגנציה11,12. ערך חלחול של 100% פירושו שכל המימן המיוצר בתא האלקטרוכימי מועבר דרך קרום Pd לתא ההידרוגנציה ולאחר מכן משתלב ליצירת גז מימן. ערך חלחול של <100% פירושו שאבולוציה של מימן מתרחשת בתא האלקטרוכימי לפני שהוא מחלחל דרך הממברנה. מכיוון ש-H2 מיוצר מתא אלקטרוכימי או הידרוגנציה, הוא נכנס למכשיר ומיונן ל-H2+. המרובע בוחר מקטעים של m/z = +2, והמטען המתאים נמדד על ידי הגלאי. העלילה המתקבלת בטכניקה זו היא המטען היוני לאורך זמן. המטען היוני נמדד תחילה עבור תא ההידרוגנציה, וכאשר האות מתייצב, התעלות משתנות כדי למדוד את התא האלקטרוכימי. חדירת מימן מחושבת על ידי חלוקת המטען היוני הממוצע בתא ההידרוגנציה במטען היוני הכולל שנמדד בכור (משוואה 1)11,12. כדי לחשב חדירת מימן, H2 מתאי ההידרוגנציה והאלקטרוכימיה נמדדים בנפרד באמצעות atm-MS.
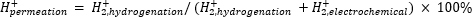 (הק’ 1)
(הק’ 1)
ספקטרומטריית מסה של כרומטוגרפיית גז (GC-MS) משמשת למעקב אחר התקדמות תגובת ההידרוגנציה12,14,15,16. כדי לאסוף נתונים לדוגמה, תא ההידרוגנציה של הכור מלא בפרופיופנון 0.01 M באתנול. על ידי החלת פוטנציאל על פני אנודת Pt וקתודה Pd, מימן תגובתי מסופק לתא ההידרוגנציה. אטומי המימן הריאקטיביים מבצעים מימן את חומרי ההזנה הבלתי רוויים, והמוצרים מכומתים באמצעות GC-MS, שם הדגימה מקוטעת ומיוננת. על ידי ניתוח המסה של שברים אלה, ניתן לקבוע את הרכב תמיסת ההידרוגנציה, וניתן לחשב את שיעורי התגובה12,14,15,16.
Protocol
Representative Results
Discussion
קרום ה-Pd מאפשר חדירת מימן והידרוגנציה כימית. הכנת ממברנה זו חשובה, אם כן, ליעילות כור הממברנה. גודל קרום ה-Pd, הקריסטלוגרפיה ופני השטח מכווננים כדי לשפר את תוצאות הניסוי. למרות שמתכת Pd יכולה לפתח מימן בכל עובי, קרומי Pd מגולגלים ל -25 מיקרומטר. סטנדרטיזציה זו של עובי הממברנה מבטיחה שהזמן שלוקח ל?…
Declarações
The authors have nothing to disclose.
Acknowledgements
אנו אסירי תודה למועצת המחקר הקנדית למדעי הטבע וההנדסה (RGPIN-2018-06748), לקרן הקנדית לחדשנות (229288), למכון הקנדי למחקר מתקדם (BSE-BERL-162173) ולקתדרות המחקר של קנדה על התמיכה הכספית. מחקר זה בוצע בחלקו הודות למימון מקרן קנדה הראשונה למצוינות במחקר, תוכנית חומרים קוונטיים וטכנולוגיות עתידיות. אנו מודים לבן הרינג במתקן הכלים המשותפים של UBC על הסיוע בפיתוח המכשיר והשיטה של GC-MS. אנו מודים לד”ר מוניקה סטולר על תרומתה לפיתוח ולעריכה של כתב יד זה. לבסוף, אנו מודים לכל קבוצת ברלינגוט באוניברסיטת קולומביה הבריטית על תמיכתם המתמשכת ושיתוף הפעולה בחקר כור הממברנה.
Materials
| Ag/AgCl Reference Electrode | BASi research products | MW-2021 | Reference electrode |
| Analytical Balance | Cole-Parmer | RK-11219-03 | Instrument |
| Atmospheric Mass Spectrometer | ESS CatalySys | NA | Instrument |
| Bench Power Supply | Newark | 1550 | Instrument |
| Conductive Copper Foil Electrical Tape | McMaster Carr | 76555A711 | Electrochemical cell assembly |
| Dichloromethane | Sigma Aldrich | 270997 | Reagent |
| Electric Rolling Press with Dual Micrometer | MTI Corporation | MR100A | Equipment |
| Electrochemical glass H-cell | University of British Columbia glass blowing | NA | Electrochemical cell assembly |
| ESS catalysis QUADSTAR | ESS CatalySys | NA | Software |
| Ethanol | Sigma Aldrich | 493511 | Reagent |
| Flat Rolling Mill | Pepetolls | 18700A | Equipment |
| Gas Chromatography Mass Spectrometer | Agilent | NA | Instrument |
| GC-MS vial | Agilent | 5067-0205 | Vial for GC-MS |
| Hexanes | Sigma Aldrich | 1.0706 | Reagent |
| Hydrochloric Acid | Sigma Aldrich | 258148 | Reagent |
| Hydrogen peroxide solution (30% v/v) | Sigma Aldrich | H1009 | Reagent |
| Isopropyl Alcohol | Sigma Aldrich | W292907 | Reagent |
| Masshunter Aquisition Software | Agilent | G1617FA | Software |
| Micropipette (100 µL – 1000 µL) | Gilson | F123602 | instrument |
| Micropipette (20 µL – 200 µL) | Gilson | F123601 | Instrument |
| Mitutoyo Digital Micrometer | Uline | H-2780 | Instrument |
| Muffle Furnace | MTI Corporation | KSL-1100X | Equipment |
| Nitric acid | Sigma Aldrich | 438073 | Reagent |
| Nitrogen gas | Sigma Aldrich | 608661 | Reagent |
| Palladium (II) Chloride | Sigma Aldrich | 520659 | Reagent |
| Pd wafer bar, 1 oz, 99.95% | Silver Gold Bull. | NA | Reagent |
| Platinum Auxiliary Electrode | BASi research products | MW-1032 | Anode |
| Potentiostat | Metrohm | PGSTAT302N | Instrument |
| Propiophenone | Sigma Aldrich | P51605 | Reagent |
| Proton Exchange Membrane, Nafion 212 | Fuel cell store | NA | Electrochemical cell assembly |
| Sulfuric acid | Sigma Aldrich | 258105 | Reagent |
Referências
- Rytter, E., Hillestad, M., Austbø, B., Lamb, J. J., Sarker, S., Lamb, J. J., Pollet, B. G. Chapter six – Thermochemical production of fuels. Hydrogen, Biomass and Bioenergy. , 89-117 (2020).
- Arpe, H. -. J. . Industrial Organic Chemistry. , (2017).
- Orella, M. J., Román-Leshkov, Y., Brushett, F. R. Emerging opportunities for electrochemical processing to enable sustainable chemical manufacturing. Current Opinion in Chemical Engineering. 20, 159-167 (2018).
- May, A. S., Biddinger, E. J. Strategies to control electrochemical hydrogenation and hydrogenolysis of furfural and minimize undesired side reactions. ACS Catalysis. 10 (5), 3212-3221 (2020).
- Tang, B. Y., Bisbey, R. P., Lodaya, K. M., Toh, W. L., Surendranath, Y. Reaction environment impacts charge transfer but not chemical reaction steps in hydrogen evolution catalysis. ChemRxiv. , (2022).
- Iwakura, C., Yoshida, Y., Inoue, H. A new hydrogenation system of 4-methylstyrene using a palladinized palladium sheet electrode. Journal of Electroanalytical Chemistry. 431 (1), 43-45 (1997).
- Inoue, H., Abe, T., Iwakura, C. Successive hydrogenation of styrene at a palladium sheet electrode combined with electrochemical supply of hydrogen. Chemical Communications. , 55-56 (1996).
- Conde, J. J., Maroño, M., Sánchez-Hervás, J. M. Pd-based membranes for hydrogen separation: Review of alloying elements and their influence on membrane properties. Separation and Purification Reviews. 46 (2), 152-177 (2017).
- Wicke, E., Brodowsky, H., Züchner, H., Alefeld, G., VÖlkl, J. Hydrogen in palladium and palladium alloys. Hydrogen in Metals II. Topics in Applied Physics., edited by Alefeld, G., Völkl, J. 29, (1978).
- Sato, T., Sato, S., Itoh, N. Using a hydrogen-permeable palladium membrane electrode to produce hydrogen from water and hydrogenate toluene. International Journal Hydrogen Energy. 41 (12), 5419-5427 (2016).
- Sherbo, R. S., Delima, R. S., Chiykowski, V. A., MacLeod, B. P., Berlinguette, C. P. Complete electron economy by pairing electrolysis with hydrogenation. Nature Catalysis. 1, 501-507 (2018).
- Sherbo, R. S., Kurimoto, A., Brown, C. M., Berlinguette, C. P. Efficient electrocatalytic hydrogenation with a palladium membrane reactor. Journal of American Chemical Society. 141 (19), 7815-7821 (2019).
- Kurimoto, A., Sherbo, R. S., Cao, Y., Loo, N. W. X., Berlinguette, C. P. Electrolytic deuteration of unsaturated bonds without using D2. Nature Catalysis. 3, 719-726 (2020).
- Jansonius, R. P., et al. Hydrogenation without H2 using a palladium membrane flow cell. Cell Reports Physical Science. 1 (7), 100105 (2020).
- Huang, A., et al. Electrolysis can be used to resolve hydrogenation pathways at palladium surfaces in a membrane reactor. Journal of American Chemical Society Au. 1 (3), 336-343 (2021).
- Delima, R. S., et al. Selective hydrogenation of furfural using a membrane reactor. Energy and Environmental Science. 15 (1), 215-224 (2021).
- Sato, T., Takada, A., Itoh, N. Low-temperature hydrogenation of toluene by electrolysis of water with hydrogen permeable palladium membrane electrode. Chemistry Letters. 46 (4), 477-480 (2017).
- Maoka, T., Enyo, M. Overpotential decay transients and the reaction mechanism on the Pd-H2 electrode. Surface Technology. 8 (5), 441-450 (1979).
- Kurimoto, A., et al. Physical separation of H2 activation from hydrogenation chemistry reveals the specific role of secondary metal catalysts. Angewandte Chemie International Edition. 60 (21), 11937-11942 (2021).

