4.1:
화학양론
4.1:
화학양론
균형 잡힌 화학 방정식은 매우 간결한 형식으로 많은 정보를 제공합니다. 화학 적 포뮬러는 화학 적 변화에 관련된 반응제 및 제품의 정체성을 제공하여 반응의 분류를 허용합니다. 계수는 이러한 화학 종의 상대적 숫자를 제공하여 반응에 의해 소비되고 생산되는 물질의 양 사이의 관계에 대한 정량적 평가를 허용합니다. 이러한 양적 관계는 반응의 stoichiometry로 알려져 있으며, 그리스어 단어 스토이치온(“요소”를 의미함)과 메트로른(“측정”을 의미함)에서 유래한 용어입니다.
반응의 stoichiometry는 원하는 양의 제품을 생산하기 위해 얼마나 많은 반응제가 필요한지 예측하는 데 도움이 되며, 어떤 경우에는 특정 양의 반응제에서 얼마나 많은 제품이 형성될지 예측하는 데 도움이 됩니다.
스토이치오메트릭 계수
화학 방정식의 계수는 각 물질의 두더지 수를 나타냅니다. 예를 들어, 암모니아를 생성하기 위해 질소 가스 및 수소 가스의 반응을 고려하십시오. Stoichiometry는 질소의 1개의 두더지 및 수소의 3개의 두더지가 암모니아의 2개의 두더지를 생성하기 위하여 반응한다는 것을 표시합니다.

한 두더지가 Avogadro의 분자 수를 포함하기 때문에, 분자의 상대적인 수는 두더지의 상대적인 수와 동일합니다. 방정식을 읽는 다른 방법은 “질소의 1 분자와 수소의 3개의 분자는 암모니아의 2개의 분자를 생성하기 위하여 반응합니다.”
스토이치오메트릭 인자
균형 잡힌 화학 방정식은 주어진 양의 다른 반응제로 반응하거나 주어진 양의 제품을 산출하는 데 필요한 하나의 반응제의 양을 결정하는 데 사용됩니다. 균형 잡힌 방정식의 계수는 원하는 수량의 계산을 허용하는 stoichiometric 요인을 도출하는 데 사용됩니다. 수소와 질소의 반응에서 암모니아 분자는 2:3 비율로 수소 분자에서 생산됩니다. 이것은 수소의 3개의 두더지가 암모니아의 2개의 두더지와 동등하다는 것을 의미합니다.
이를 바탕으로 다음 스토이치오메트릭 인자가 파생됩니다.
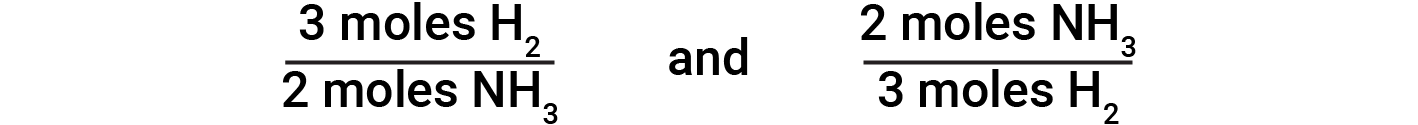
이러한 스토이치오메트릭 인자는 주어진 수의 수소 분자에서 생성된 암모니아 분자의 수 또는 주어진 수의 암모니아 분자를 생성하는 데 필요한 수소 분자수를 계산하는 데 사용될 수 있다. 유사한 요인은 어떤 화학 방정식에서 물질의 어떤 쌍에 대해 파생 될 수있다.
두더지 변환
질소와 수소로부터암모니아 형성을 위한 균형 잡힌 화학반응의 경우,N2와 NH3 사이의 다음 스토이치오메트릭 두더지 비율은 1:2이다. 이어서, 암모니아의 어금량은 관심있는 두 물질에 관한 스토이치오메트릭 변환 계수에 의해 질소의 어금니양을 곱하여 유래된다.

매스 투 매스 변환
stoichiometry에 근거를 둔 물질의 질량 사이 변환하는 것은 두더지 비율과 어금니 질량의 지식이 필요합니다. 예를 들어, 암모니아0.170kg을 생산하는 데 필요한 수소의 질량을 찾기 위해 먼저, 암모니아의 질량을 암모니아의 양(두더지)으로 변환하는 데 사용된다. 이어서, 균형 방정식으로부터 적절한 금습계계는 암모니아(moles)의 양을 수소(moles)의 양으로 변환한다. 마지막으로, 수소의 어금니 덩어리는 수소(두더지)의 양을 수소 의 질량으로 변환합니다.
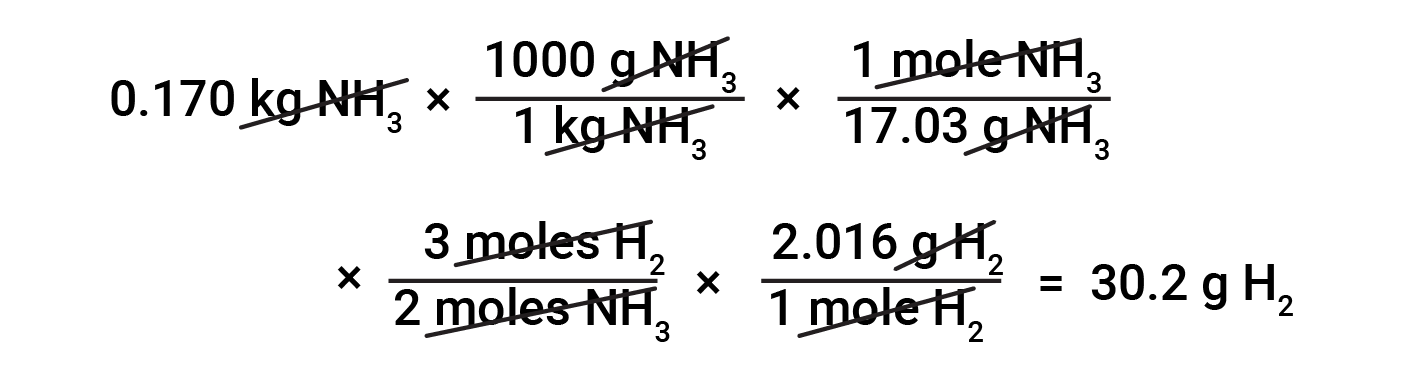
시작 및 종료 계산 단계의 다양한 변형은 제공및 추구되는 특정 수량(볼륨, 솔루션 농도 등)에 따라 가능합니다. 세부 사항에 관계없이 이러한 모든 계산은 균형 잡힌 화학 방정식에서 파생된 stoichiometric 요인의 사용이라는 일반적인 필수 구성 요소를 공유합니다.
