4.8:
Reações Químicas em Soluções Aquosas
4.8:
Reações Químicas em Soluções Aquosas
As substâncias químicas interagem de muitas maneiras diferentes. Certas reações químicas apresentam padrões comuns de reatividade. Devido ao grande número de reações químicas, torna-se necessário classificá-las com base nos padrões de interação observados.
A água é um solvente bom que pode dissolver muitas substâncias. Por esta razão, muitas reações químicas ocorrem em água. Tais reações são chamadas reações aquosas. Os três tipos mais comuns de reações aquosas são precipitação, ácido-base, e oxidação-redução.
Reações em Soluções Aquosas
Uma reação de precipitação envolve a troca de iões entre compostos iónicos em solução aquosa para formar um sal insolúvel ou um precipitado. Em uma reação ácido-base, um ácido reage com uma base, e os dois se neutralizam um ao outro, produzindo sal e água. Uma reação de oxidação-redução envolve a transferência de eletrões entre as espécies que reagem. Diz-se que o reagente que perde eletrões é oxidado, e que o reagente que ganha eletrões é reduzido.
Equações para Reações Aquosas
Quando estão envolvidos iões, há várias formas de representar as reações que ocorrem em meios aquosos, cada uma com um nível de detalhe diferente. Para compreendermos isto, tomemos como exemplo uma reação de precipitação. A reação é entre soluções aquosas de compostos iónicos, como BaCl2 e AgNO3. Os produtos da reação são o Ba(NO3)2 aquoso e AgCl sólido.

Esta equação equilibrada é chamada de equação molecular. As equações moleculares fornecem informações estequiométricas para fazer cálculos quantitativos e também ajudam a identificar os reagentes utilizados e os produtos formados. No entanto, as equações moleculares não fornecem os detalhes do processo de reação em solução, ou seja, não indicam as diferentes espécies iónicas presentes na solução.
Os compostos iónicos como BaCl2, AgNO3, e Ba(NO3)2 são solúveis em água. Dissolvem-se dissociando-se nos seus iões constituintes e os iões são homogeneamente dispersos na solução.



Como AgCl é um sal insolúvel, não se dissocia em iões e permanece em solução como sólido. Tendo em conta os factores acima referidos, uma representação mais realista da reação seria:
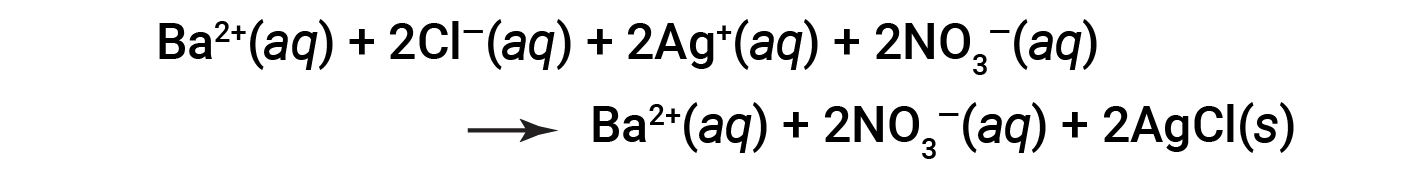
Esta é a equação iónica completa na qual todos os iões dissolvidos são explicitamente representados.
Esta equação iónica completa indica duas espécies químicas que estão presentes de forma idêntica em ambos os lados, Ba2+ (aq) e NO3− (aq). Estes são chamados iões espectadores. A presença destes iões é necessária para manter a neutralidade da carga. Como não são nem quimicamente nem fisicamente alterados pelo processo, eles podem ser eliminados da equação.

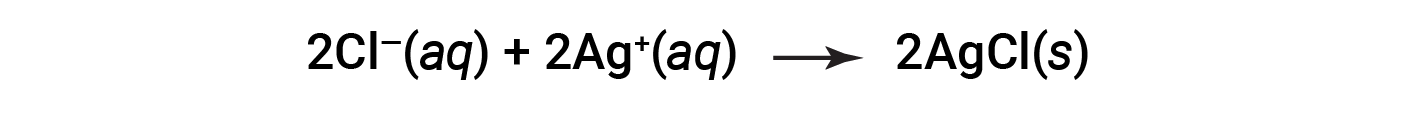
Esta equação pode ser ainda mais simplificada para originar:
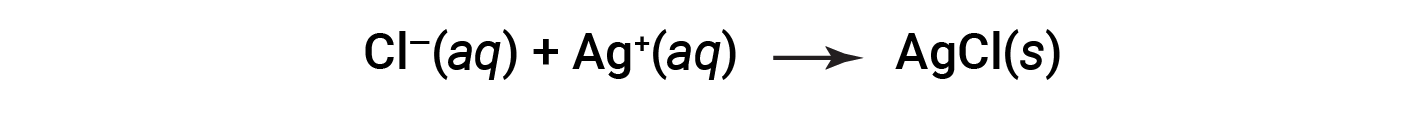
Esta é a equação iónica líquida. Indica que o cloreto de prata sólido pode ser produzido a partir de iões de cloreto e de prata dissolvidos, independentemente da fonte destes iões.
Este texto é adaptado de OpenStax Chemistry 2e, Section 4.1: Writing and Balancing Chemical Equations.
