4.12:
Reações de Ácidos, Bases e de Neutralização
4.12:
Reações de Ácidos, Bases e de Neutralização
Uma reação ácido-base é aquela em que um ião de hidrogénio, H+, é transferido de uma espécie química para outra. Tais reações são de importância central para numerosos processos naturais e tecnológicos, desde as transformações químicas que ocorrem dentro de células ou lagos e oceanos até à produção industrial de fertilizantes, produtos farmacêuticos, e outras substâncias essenciais para a sociedade.
Há diversas maneiras de definir um ácido. No contexto das soluções aquosas, um ácido é uma substância que se dissolve para produzir iões de hidrogénio.

Esta é a definição de Arrhenius de um ácido, cujo nome vem do químico Sueco Svante Arrhenius (1859–1927). Um ião de hidrogénio, representado pelo símbolo H+, é chamado de protão. Em solução, os protões combinam-se quimicamente com moléculas de água, através dos pares isolados de oxigénio, para formar iões de hidrónio, H3O+.
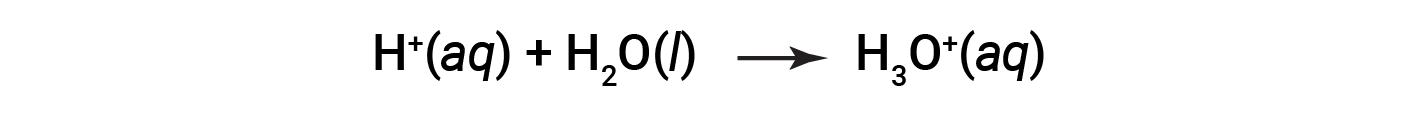
A equação química para a ionização de um ácido é escrita como

Os ácidos que reagem completamente com água desta forma são chamados ácidos fortes. HCl, HNO3 e HBr são alguns exemplos.
A maioria dos ácidos encontrados no dia-a-dia são ácidos fracos. O ácido cítrico em frutos, o ácido acético em vinagre, e o ácido láctico no leite são alguns exemplos. Um exemplo familiar de um ácido fraco é o ácido acético, o ingrediente principal no vinagre alimentar. Quando dissolvidas em água em condições típicas, apenas cerca de 1% das moléculas de ácido acético estão presentes na forma ionizada, CH3CO2−.

A utilização de uma seta dupla na equação acima indica o aspecto de reação parcial deste processo.
Uma base é uma substância que se dissolve em água para produzir iões hidróxido, OH−. As bases mais comuns são compostos iónicos compostos por catiões de metais alcalinos ou alcalinoterrosos (grupos 1 e 2) combinados com o ião hidróxido—por exemplo, NaOH e Ca(OH)2. Ao contrário dos compostos ácidos discutidos anteriormente, estes compostos não reagem quimicamente com água; em vez disso, dissolvem-se e dissociam-se, libertando iões hidróxido directamente na solução. Por exemplo, KOH e Ba(OH)2 dissolvem-se em água e dissociam-se completamente para produzir catiões (K+ e Ba2+, respectivamente) e iões hidróxido, OH−. Estas bases, juntamente com outros hidróxidos que se dissociam completamente em água, são consideradas bases fortes.
Considere a dissolução do hidróxido de sódio em água como um exemplo:

Esta equação confirma que o hidróxido de sódio é uma base. Quando dissolvido em água, o NaOH dissocia-se para produzir iões Na+ e OH−. Isto também é válido para qualquer outro composto iónico que contenha iões hidróxido. Uma vez que o processo de dissociação é essencialmente completo quando os compostos iónicos se dissolvem em água em condições típicas, NaOH e outros hidróxidos iónicos são todos classificados como bases fortes.
Ao contrário dos hidróxidos iónicos, alguns compostos produzem iões hidróxido quando dissolvidos ao reagir quimicamente com moléculas de água. Em todos os casos, estes compostos reagem apenas parcialmente e são então classificados como bases fracas. Estes tipos de compostos são também abundantes na natureza e são comodidades importantes em várias tecnologias. Por exemplo, a produção global da base fraca amoníaco é normalmente superior a 100 toneladas métricas por ano, uma vez que é amplamente utilizada como fertilizante agrícola, uma matéria-prima para a síntese química de outros compostos, e um ingrediente ativo nos produtos de limpeza domésticos. Quando dissolvido em água, o amoníaco reage parcialmente para produzir iões hidróxido, como se mostra aqui:

Isto é, por definição, uma reação ácido-base que envolve a transferência de iões H+ de moléculas de água para moléculas de amoníaco. Em condições típicas, apenas cerca de 1% do amoníaco dissolvido está presente como iões NH4+.
Uma reação de neutralização é um tipo específico de reação ácido-base, em que os reagentes são um ácido e uma base (mas não água), e os produtos são frequentemente sal e água:

Para ilustrar uma reação de neutralização, considere o que acontece quando um antiácido típico, como o leite de magnésia (uma suspensão aquosa de Mg(OH)2 sólido) é ingerido para aliviar os sintomas associados ao excesso de ácido gástrico (HCl):

Note que, para além de água, esta reação produz um sal, cloreto de magnésio. O H+ (aq) do ácido (forte ou fraco) combina-se com o OH− (aq) da base (ou produzido pela reação entre uma base fraca e água) para formar H2O (l). Por exemplo, a reação entre as soluções aquosas de HCl (ácido forte) e NaOH (base forte) é escrita da seguinte forma:

Tanto HCl como NaOH são submetidos a 100% de ionização. A equação iónica completa, portanto, pode ser escrita como:
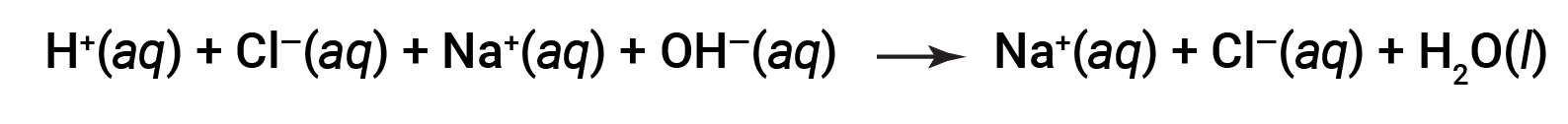
Cl– e Na+ são designados iões espectadores, que se cancelam, tornando a equação iónica líquida como:
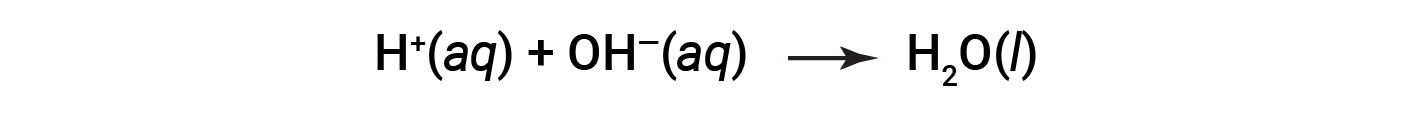
Este texto é adaptado de OpenStax Chemistry 2e, Section: 4.2: Classifying Chemical Reactions.
