6.11:
Entalpia standard di formazione
6.11:
Entalpia standard di formazione
I cambiamenti di entalpia sono tipicamente tabulati per reazioni in cui sia i reagenti che i prodotti sono alle stesse condizioni. Uno stato standard è un insieme comunemente accettato di condizioni utilizzate come punto di riferimento per la determinazione delle proprietà in altre condizioni diverse. Per i chimici, lo stato standard IUPAC si riferisce a materiali sotto una pressione di 1 bar e soluzioni a 1 M e non specifica una temperatura. Molte tabelle termochimiche elencano valori con uno stato standard di 1 atm. Poiché la ΔH di una reazione cambia molto poco con cambiamenti di pressione così piccoli (1 bar = 0,987 atm), i valori di ΔH (ad eccezione dei valori misurati più precisamente) sono essenzialmente gli stessi in entrambi gli insiemi di condizioni standard. Una “o” in apice nel simbolo di modifica dell’entalpia designa lo stato standard. Poiché la temperatura abituale (ma non tecnicamente standard) è di 298,15 K, questa temperatura sarà assunta a meno che non venga specificata un’altra temperatura. Pertanto, il simbolo (ΔH°) è usato per indicare un cambiamento di entalpia per un processo che si verifica in queste condizioni. (Il simbolo ΔH è usato per indicare un cambiamento di entalpia per una reazione che si verifica in condizioni non standard.)
I cambiamenti di entalpia per molti tipi di processi chimici e fisici sono disponibili nella letteratura di riferimento, compresi quelli per reazioni di combustione, transizioni di fase e reazioni di formazione. Poiché il cambiamento di entalpia per una data reazione è proporzionale alle quantità di sostanze coinvolte, può essere riportato su tale base (cioè, come ΔH per quantità specifiche di reagenti). Tuttavia, spesso troviamo più utile dividere una proprietà estesa (ΔH) per un’altra (quantità di sostanza), e segnalare un valore intensivo per quantità di ΔH, spesso “normalizzato” su base per talpa.
Entalpia standard di formazione
L’entalpia standard di formazione ΔHf° è un cambiamento di entalpia per una reazione in cui esattamente 1 talpa di una sostanza pura è formata da elementi liberi nei loro stati più stabili in condizioni di stato standard. Questi valori sono particolarmente utili per calcolare o prevedere cambiamenti di entalpia per reazioni chimiche poco pratiche o pericolose da eseguire, o per processi per i quali è difficile effettuare misurazioni. Usando valori noti di entalpie standard di formazione, è possibile determinare il cambiamento di entalpia per ogni reazione.
L’entalpia standard di formazione di CO2 (g) è −393,5 kJ/mol. Questo è il cambiamento dell’entalpia per la reazione esotermica:
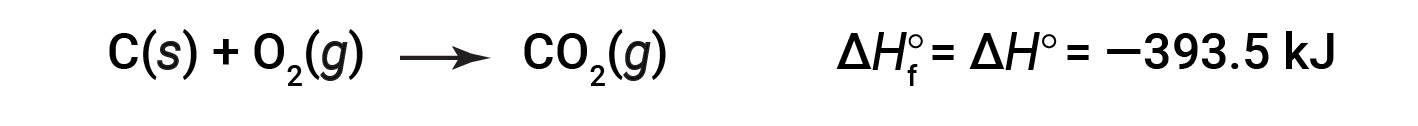
a partire dai reagenti ad una pressione di 1 atm e 25 °C (con il carbonio presente come grafite, la forma più stabile di carbonio in queste condizioni) e terminando con una talpa di CO2,anche a 1 atm e 25 °C. Per il biossido di azoto, NO2 (g), ΔHf° è 33,2 kJ/mol. Questo è il cambiamento dell’entalpia per la reazione endotermica:
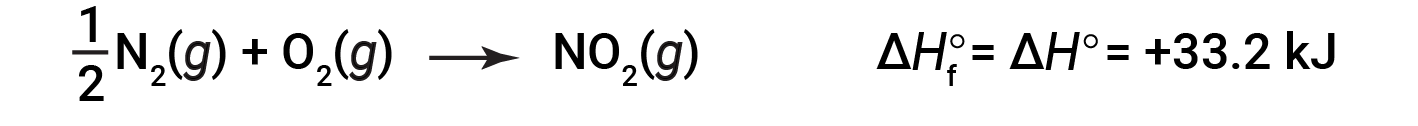
Un’equazione di reazione con 1/2mole di N2 e 1 talpa di O2 è corretta in questo caso perché l’entalpia standard di formazione si riferisce sempre a 1 talpa di prodotto: NO2 (g).
Per definizione, l’entalpia standard di formazione di un elemento nella sua forma più stabile è uguale a zero in condizioni standard. Ad esempio, gli entalpie standard di formazione di carbonio (grafene), gas ossigeno biatomico, gas azoto biatomico, metallo di sodio e mercurio liquido sono zero in condizioni standard.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 5.3: Entalpia.
Suggested Reading
- Hawk, Eric Leigh. "The calculation of standard enthalpies of formation of alkanes: Illustrating molecular mechanics and spreadsheet programs." Journal of chemical education 76, no. 2 (1999): 278.
- Mazzuca, James W., Alexis R. Downing, and Christopher Potter. "Empirically corrected electronic structure calculations applied to the enthalpy of combustion physical chemistry laboratory." Journal of Chemical Education 96, no. 6 (2019): 1165-1170.
- Jansen, Michael P. "The Cost of Converting a Gasoline-Powered Vehicle to Propane. A Practical Review Problem for Senior High School or Introductory Chemistry." Journal of Chemical Education 77, no. 12 (2000): 1578.
