7.6:
Spettri di emissione
7.6:
Spettri di emissione
Quando solidi, liquidi o gas condensati vengono riscaldati a sufficienza, irradiano parte dell’energia in eccesso come luce. I fotoni prodotti in questo modo hanno una gamma di energie, e quindi producono uno spettro continuo in cui è presente una serie ininterrotta di lunghezze d’onda.
A differenza degli spettri continui, la luce può anche verificarsi come spettri discreti o di linea con larghezza di linea molto strette intervallate in tutte le regioni spettrali. L’eccitante di un gas a bassa pressione parziale utilizzando una corrente elettrica, o riscaldarlo, produrrà spettri di linea. Lampadine fluorescenti e insegne al neon funzionano in questo modo. Ogni elemento mostra il proprio insieme caratteristico di linee, così come le molecole, anche se i loro spettri sono generalmente molto più complicati.
Ogni linea di emissione consiste in una singola lunghezza d’onda della luce, il che implica che la luce emessa da un gas consiste in un insieme di energie discrete. Ad esempio, quando una scarica elettrica passa attraverso un tubo contenente idrogeno gassoso abassa pressione, le molecole H 2 vengono suddivise in atomi H separati e si osserva un colore blu-rosa. Il passaggio della luce attraverso un prisma produce uno spettro di linea, indicando che questa luce è composta da fotoni di quattro lunghezze d’onda visibili.
L’origine degli spettri discreti negli atomi e nelle molecole fu estremamente sconcertante per gli scienziati alla fine del XIX secolo. Secondo la teoria elettromagnetica classica, dovrebbero essere osservati solo spettri continui. Altre linee discrete per l’atomo di idrogeno sono state trovate nelle regioni UV e IR. Johannes Rydberg generalizzò il lavoro di Balmer e sviluppò una formula empirica che predisse tutte le linee di emissione dell’idrogeno, non solo quelle limitate all’intervallo visibile, dove, n1 e n2 sono interi, n1 < n2
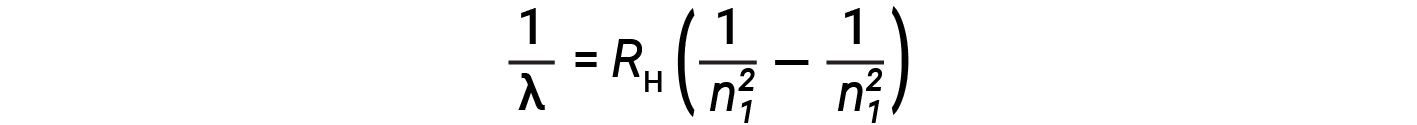
Anche alla fine del XIX secolo, la spettroscopia era una scienza molto precisa, e quindi le lunghezze d’onda dell’idrogeno furono misurate con altissima precisione, il che implicava che anche la costante di Rydberg poteva essere determinata in modo molto preciso. Che una formula così semplice come la formula di Rydberg potesse tenere conto di misurazioni così precise sembrava sbalorditiva all’epoca, ma fu l’eventuale spiegazione degli spettri di emissione di Neils Bohr nel 1913 che alla fine convinse gli scienziati ad abbandonare la fisica classica e spinse lo sviluppo della meccanica quantistica moderna.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 3.1: Energia Elettromagnetica.
