7.13:
원자 궤도(오비탈)의 에너지
7.13:
원자 궤도(오비탈)의 에너지
원자에서, 음하전전자는 양전하 핵에 끌린다. 다중 전자 원자에서 전자 전자 반발도 관찰됩니다. 매력적이고 반발력은 개별 입자에 대한 전하의 기호 및 크기뿐만 아니라 입자 사이의 거리뿐만 아니라 에 따라 달라집니다. 파티클의 충전이 반대면 서로 를 끌어들입니다. 두 파티클모두 동일한 전하를 가지면 서로를 격퇴합니다.
전하의 크기가 증가함에 따라 힘의 크기가 증가합니다. 그러나, 요금의 분리가 더 많은 경우, 힘이 감소. 따라서 전자와 그 핵 사이의 매력의 힘은 그들 사이의 거리에 직접 비례한다. 전자가 핵에 더 가까워지면 핵에 더 단단히 결합됩니다. 따라서, 다른 껍질 (다른 거리에서)에 있는 전자는 다른 에너지를 가지고 있습니다.
여러 에너지 레벨을 가진 원자의 경우, 내부 전자는 전자 전자 반발로 인해 핵의 당김으로부터 외부 전자를 부분적으로 보호합니다. 코어 전자는 외부 껍질에서 전자를 보호하고, 동일한 원자 껍질의 전자는 서로 경험하는 핵 어트랙션을 효율적으로 차단하지 않습니다. 이는 효과적인 핵충전,Zeff의 개념으로 설명될 수 있다. 이것은 어떤 전자 전자 반발을 고려하여 핵에 의해 특정 전자에 가해지는 당김입니다. 수소의 경우 전자가 하나뿐이므로 핵전하(Z)와 효과적인 핵전하(Zeff)는 동일하다. 다른 모든 원자의 경우 내부 전자는 핵의 당김으로부터 외부 전자를 부분적으로 보호하고 따라서 다음과 같이 합니다.

궤도 침투는 전자가 핵에 더 가까워지는 능력을 설명합니다. s-orbital의 전자는 핵에 더 가까워지고 더 관통 능력을 가질 수 있습니다. 구형 s-orbital에 대한 확률 밀도는 핵에서 0이 아닙니다. 다른 서브셸에는 공간 방향이 다릅니다. 아령 모양의 궤도로 인해 p-전자는훨씬 적게 침투합니다. 그것의 파화기능은 전자를 찾는 확률이 0인 핵을 통과하는 노드가 있습니다. 따라서, 상기 궤도 전자는 핵에 더 단단히 결합되고 p-전자보다에너지가 낮다. d-전자는 p 궤도 전자보다 더 낮은 침투와 높은 에너지를 가지고 있습니다.
다양한 포탄과 서브쉘의 경우, 전자의 관통력의 경향은 다음과 같이 묘사될 수 있다.
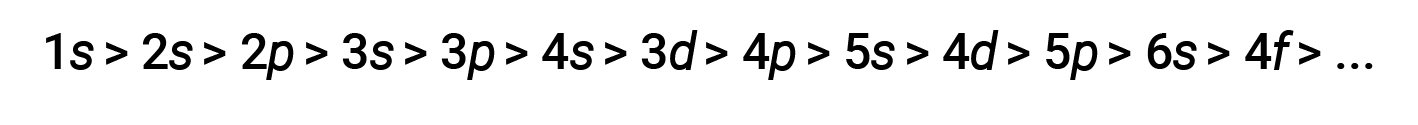
차폐 및 침투의 효과는 크고,4s 전자는3d 전자보다 에너지가 낮을 수 있다.
