8.4:
Energia de Ionização
8.4:
Energia de Ionização
A quantidade de energia necessária para remover o eletrão mais fracamente ligado de um átomo gasoso no seu estado fundamental é chamada a sua primeira energia de ionização (IE1). A primeira energia de ionização para um elemento, X, é a energia necessária para formar um catião com carga 1+:
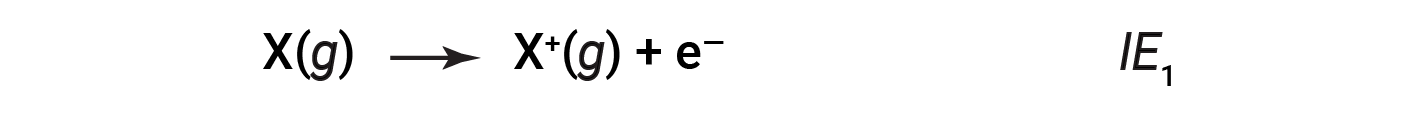
A energia necessária para remover o segundo eletrão mais fracamente ligado é chamada de segunda energia de ionização (IE2).
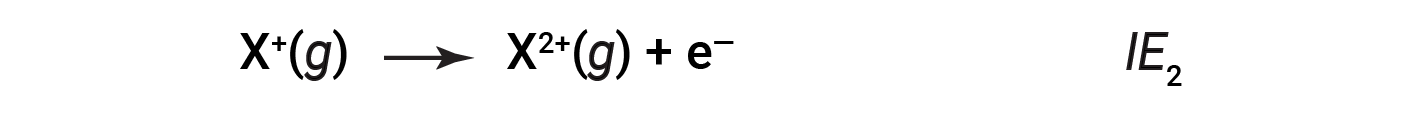
A energia necessária para remover o terceiro eletrão é a terceira energia de ionização, e assim por diante. É sempre necessária energia para remover eletrões de átomos ou iões, pelo que os processos de ionização são endotérmicos e os valores de IE são sempre positivos. Para átomos maiores, o eletrão mais fracamente ligado está localizado mais longe do núcleo e assim é mais fácil de ser removido. Portanto, à medida que o tamanho (raio atómico) aumenta, a energia de ionização deve diminuir.
Dentro de um período, a IE1 aumenta geralmente com o aumento de Z. Descendo um grupo, o valor de IE1 geralmente diminui com o aumento de Z. Existem alguns desvios sistemáticos dessa tendência, no entanto. Note-se que a energia de ionização do boro (número atómico 5) é inferior à do berílio (número atómico 4), embora a carga nuclear de boro seja superior em um protão. Isto pode ser explicado porque a energia das subcamadas aumenta à medida que l aumenta, devido à penetração e à proteção. Dentro de qualquer camada, os eletrões s têm menos energia do que os eletrões p. Isto significa que um eletrão s é mais difícil de ser removido de um átomo do que um eletrão p na mesma camada. O eletrão removido durante a ionização do berílio ([He]2s2) é um eletrão s, enquanto que o eletrão removido durante a ionização do boro ([He]2s22p1) é um eletrão p; isto resulta em uma menor primeira energia de ionização para o boro, embora a sua carga nuclear seja maior por um protão. Assim, vemos um pequeno desvio da tendência prevista a ocorrer de cada vez que uma nova subcamada começa.
Outro desvio ocorre à medida que as orbitais ficam mais de metade cheias. A primeira energia de ionização para o oxigénio é ligeiramente inferior à do azoto, apesar da tendência para de os valores de IE1 aumentarem ao longo de um período. Para o oxigénio, a remoção de um eletrão elimina a repulsão eletrão-eletrão causada pelo emparelhamento dos eletrões na orbital 2p e resulta em uma orbital meio cheia (que é energicamente favorável). Mudanças análogas ocorrem em períodos seguintes.
A remoção de um eletrão de um catião é mais difícil do que a remoção de um eletrão de um átomo neutro por causa da atração eletrostática maior ao catião. Da mesma forma, remover um eletrão de um catião com carga positiva mais alta é mais difícil do que remover um eletrão de um ião com uma carga mais baixa. Assim, as energias de ionização sucessivas para um elemento aumentam sempre. Como se vê na Tabela 1, há um grande aumento nas energias de ionização para cada elemento. Este salto corresponde à remoção dos eletrões centrais, que são mais difíceis de remover do que os eletrões de valência. Por exemplo, Sc e Ga têm ambos três eletrões de valência, pelo que o rápido aumento da energia de ionização ocorre após a terceira ionização.
Tabela 1: Energias de Ionização Sucessivas para Elementos Seleccionados (kJ/mol)
| Elemento | IE1 | IE2 | IE3 | IE4 | IE5 | IE6 | IE7 |
| K | 418,8 | 3051,8 | 4419,6 | 5876,9 | 7975,5 | 9590,6 | 11343 |
| Ca | 589,8 | 1145,4 | 4912,4 | 6490,6 | 8153,0 | 10495,7 | 12272,9 |
| Sc | 633,1 | 1235,0 | 2388,7 | 7090,6 | 8842,9 | 10679,0 | 13315,0 |
| Ga | 578,8 | 1979,4 | 2964,6 | 6180 | 8298,7 | 10873,9 | 13594,8 |
| Ge | 762,2 | 1537,5 | 3302,1 | 4410,6 | 9021,4 | Não disponível | Não disponível |
| As | 944,5 | 1793,6 | 2735,5 | 4836,8 | 6042,9 | 12311,5 | Não disponível |
Este texto é adaptado de OpenStax Chemistry 2e, Section 6.5: Periodic Variations in Element Properties.
