10.1:
Teoria VSEPR e forme di base
10.1:
Teoria VSEPR e forme di base
Panoramica della teoria VSEPR
La teoria della repulsione della coppia elettrone del guscio di valenza (teoria VSEPR) ci permette di prevedere la struttura molecolare, inclusi angoli di legame approssimativi attorno a un atomo centrale, di una molecola da un esame del numero di legami e coppie di elettroni solitari nella sua struttura di Lewis. Il modello VSEPR presuppone che le coppie di elettroni nel guscio di valenza di un atomo centrale adottino una disposizione che minimizza le repulsioni tra queste coppie di elettroni massimizzando la distanza tra loro. Gli elettroni nel guscio di valenza di un atomo centrale formano coppie di elettroni, situate principalmente tra atomi legati, o coppie solitarie. La repulsione elettrostatica di questi elettroni è ridotta quando le varie regioni ad alta densità di elettroni assumono posizioni il più lontano possibile l’una dall’altra.
La teoria VSEPR prevede la disposizione delle coppie di elettroni attorno ad ogni atomo centrale e, di solito, la corretta disposizione degli atomi in una molecola. Dovremmo capire, tuttavia, che la teoria considera solo le repulsioni della coppia di elettroni. Altre interazioni, come le repulsioni nucleare-nucleari e le attrazioni nucleari-elettrone, sono anche coinvolte nella disposizione finale che gli atomi adottano in una particolare struttura molecolare.
Applicazione della teoria VSEPR
La teoria VSEPR può essere usata per prevedere la struttura delle molecole. Per esempio, prevediamo la struttura di una molecola gassosa di CO2. La struttura di Lewis di CO2 (Figura 1) mostra solo due gruppi di elettroni attorno all’atomo di carbonio centrale. Con due gruppi di legame e nessuna coppia solitaria di elettroni sull’atomo centrale, i legami sono il più distanti possibile, e la repulsione elettrostatica tra queste regioni ad alta densità di elettroni è ridotta al minimo quando si trovano sui lati opposti dell’atomo centrale. L’angolo di legame è di 180°.
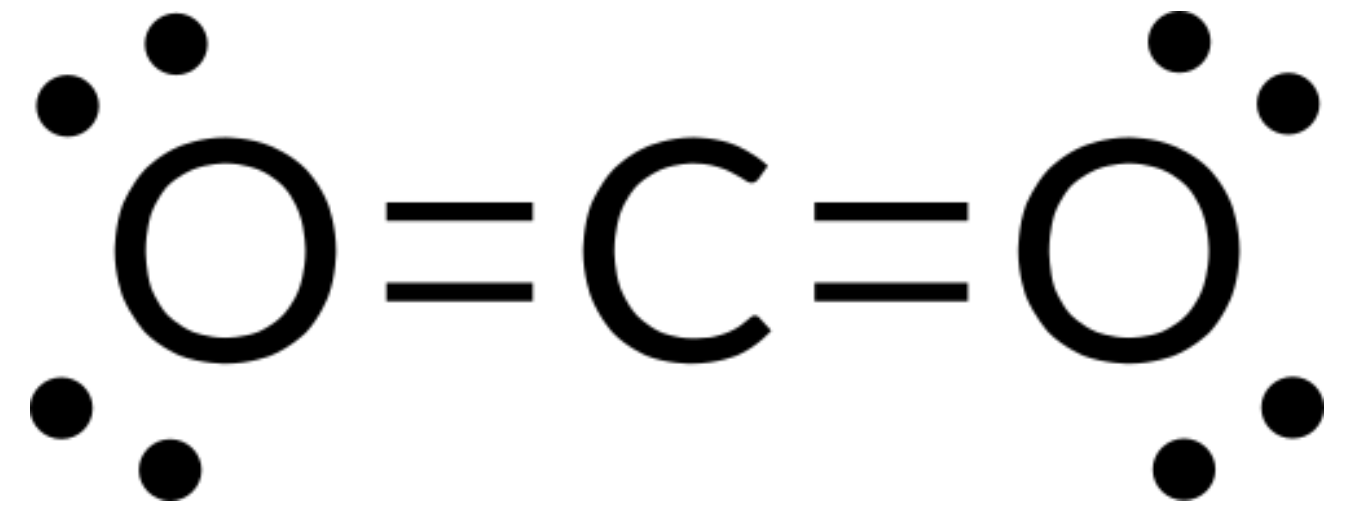
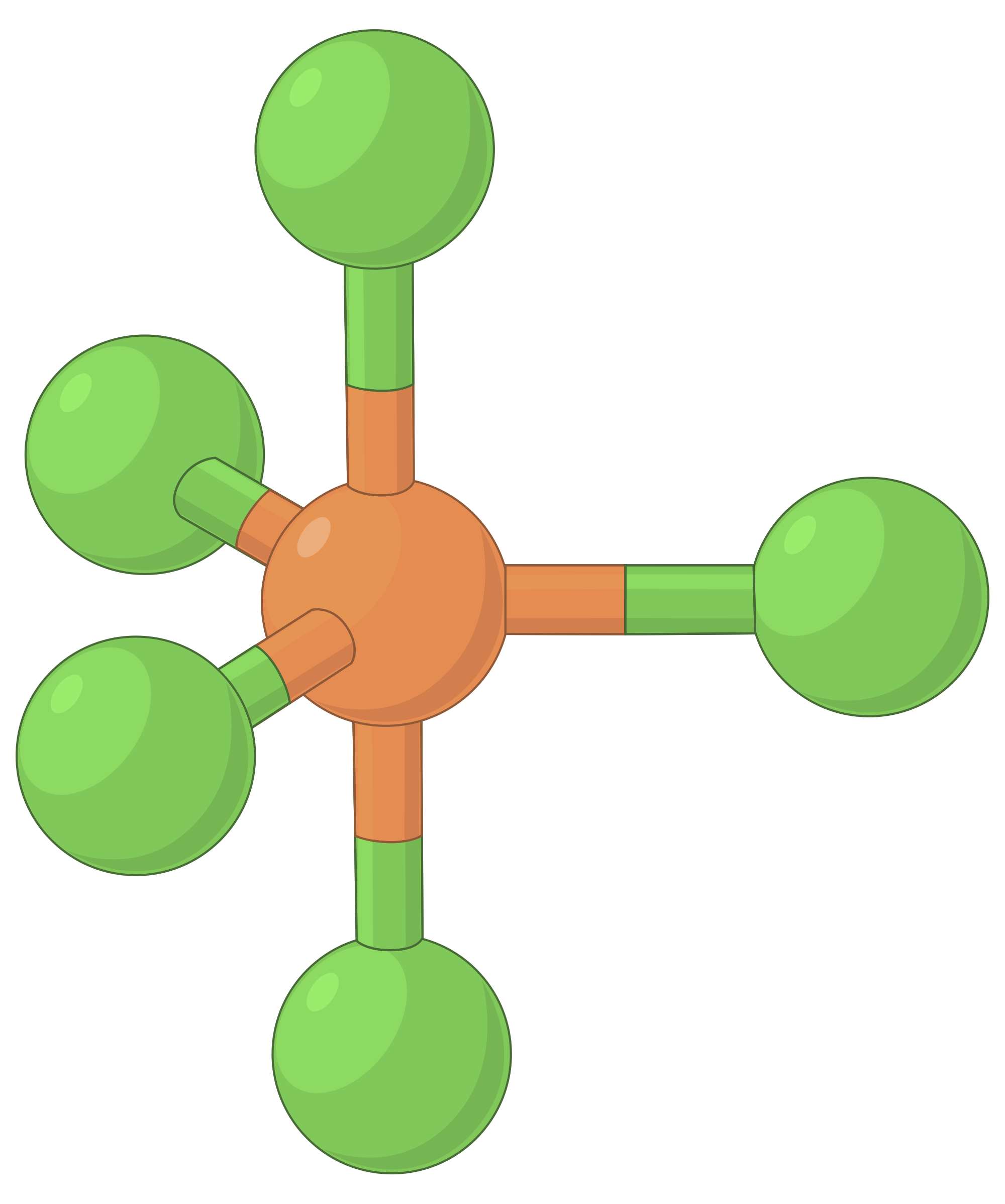
La tabella seguente illustra le geometrie della coppia elettrone che minimizzano le repulsioni tra regioni ad alta densità di elettroni (legami e/o coppie solitarie). Due regioni di densità elettronica attorno ad un atomo centrale in una molecola formano una geometria lineare; tre regioni formano una geometria planare trigonale; quattro regioni formano una geometria tetraedrica; cinque regioni formano una geometria bipirramidale trigonale, e sei regioni formano una geometria ottaedrica.
| Bef2 | BF3 | Ch4 | PCl5 | SF6 | |
| Numero di regioni di elettroni | 2 | 3 | 4 | 5 | 6 |
| Geometria della regione elettronica | Lineare; Angolo di 180° | Planare trigonale; tutti gli angoli 120° | Tetraedro; tutti gli angoli 109.5° | Bipirramidale trigonale, angoli 90° o 120°. | Ottaedro; tutti gli angoli 90° o 180°. |
| Disposizione spaziale | 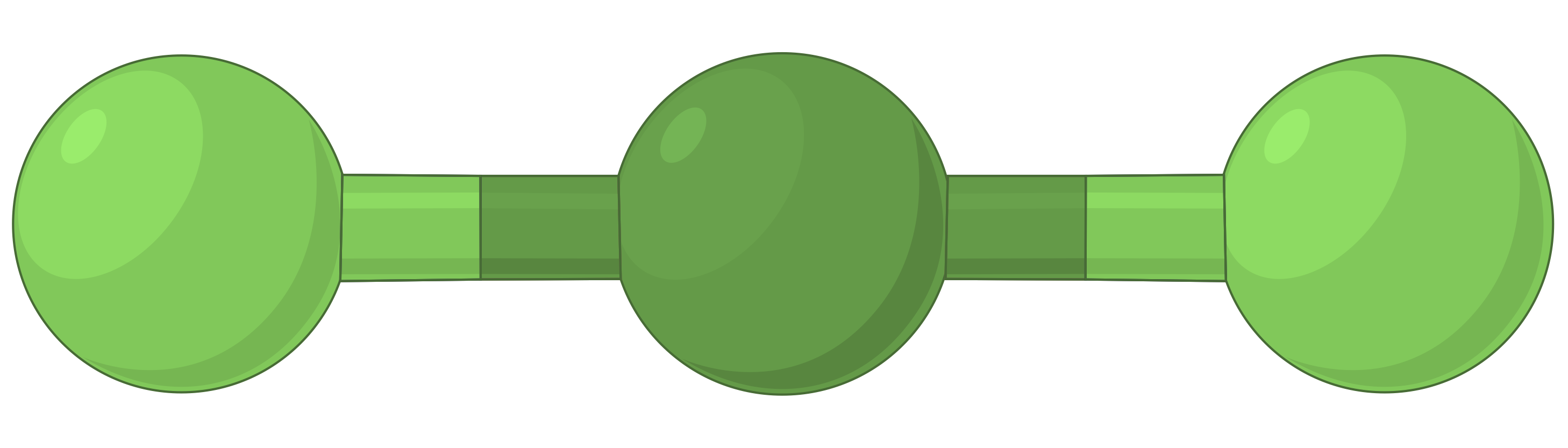 |
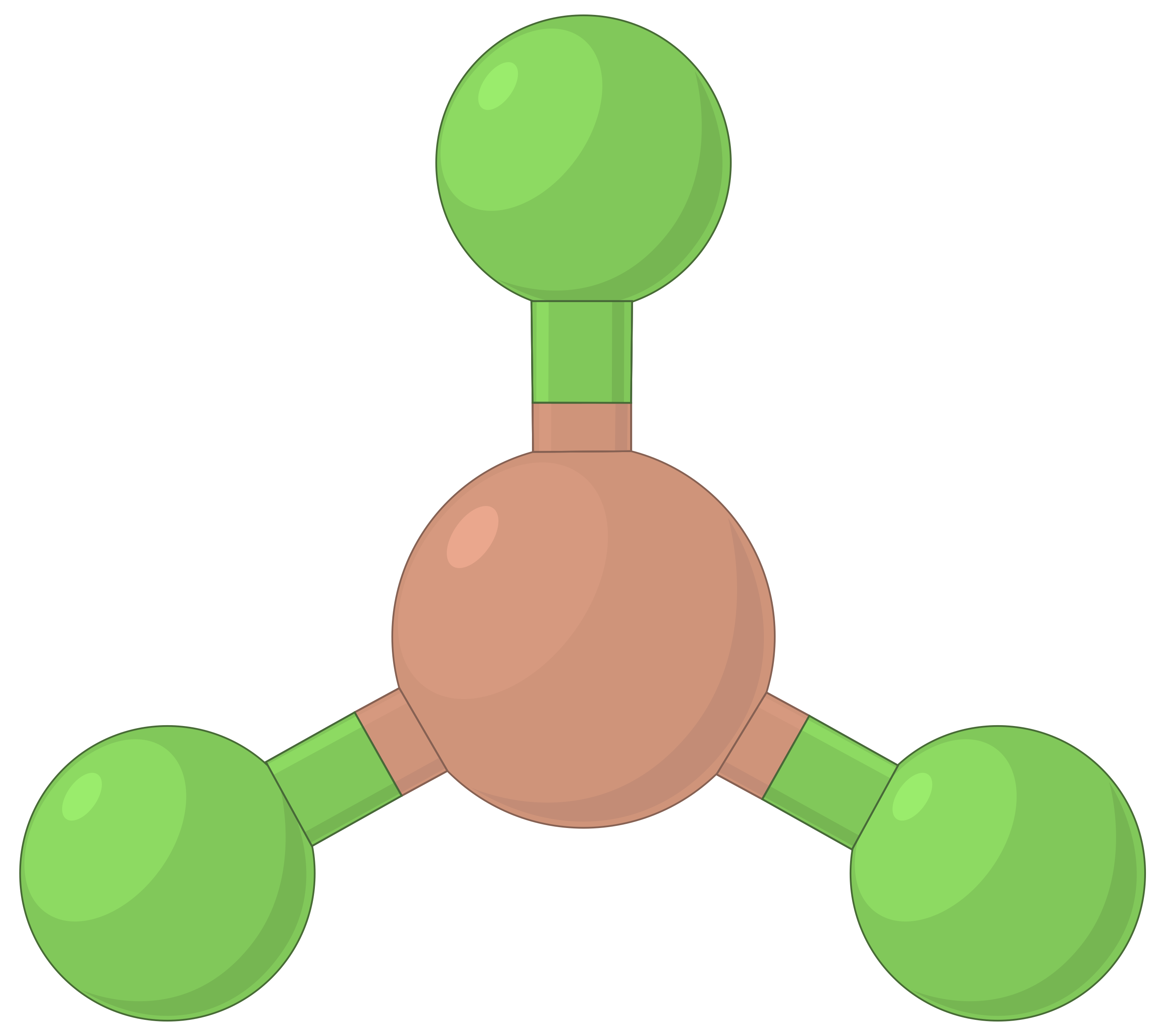 |
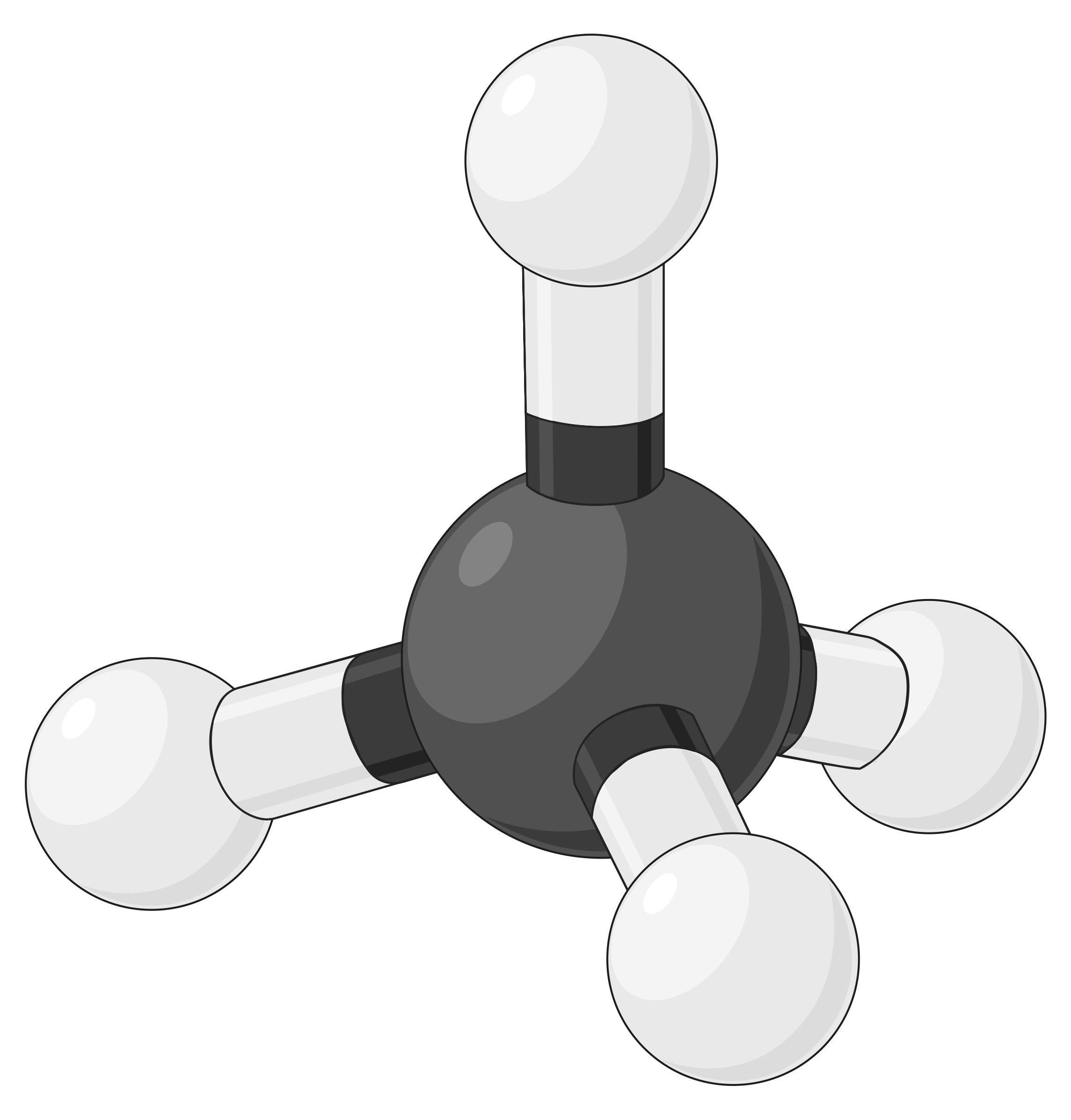 |
 |
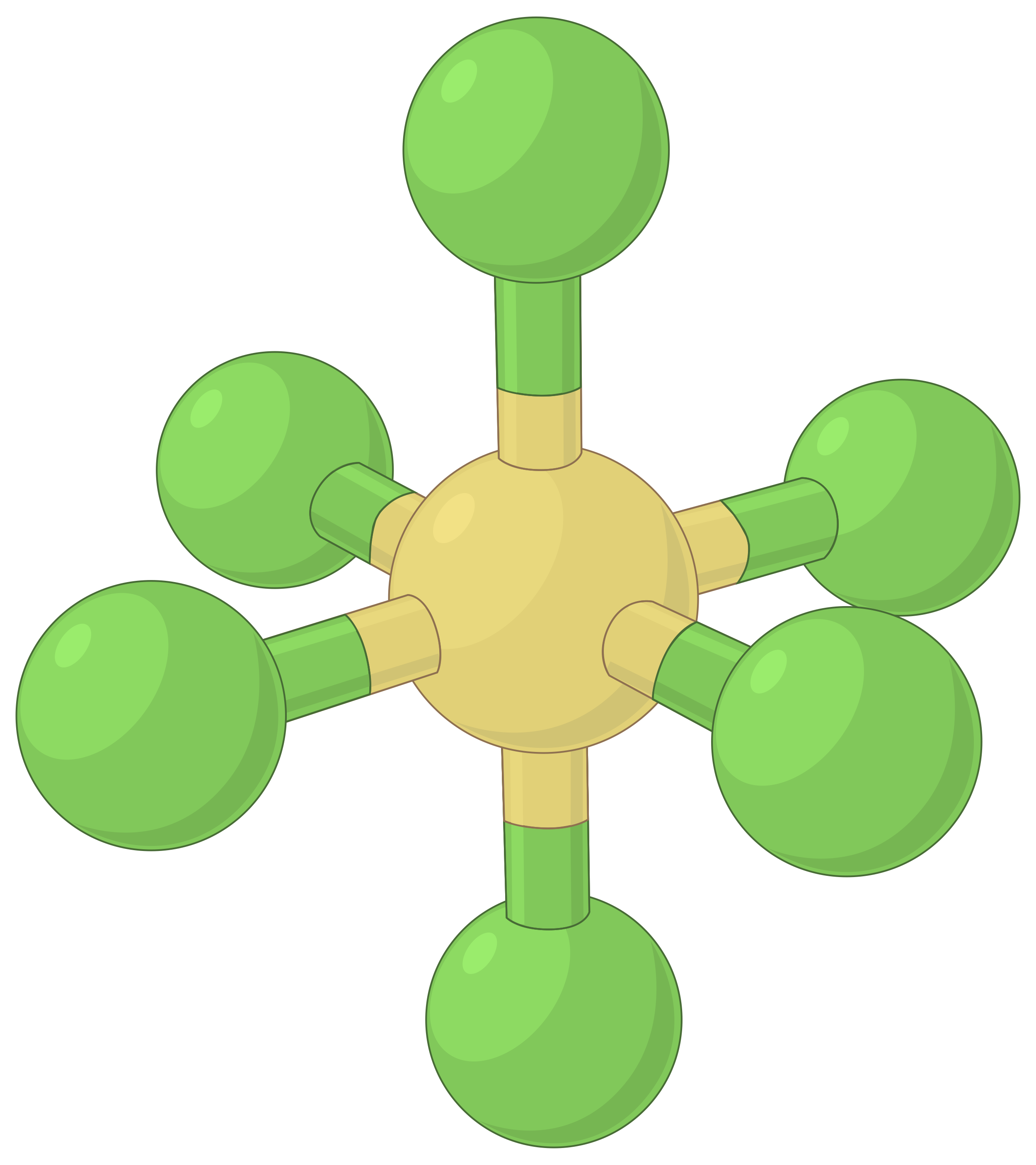 |
La tabella 1. Le geometrie di base della coppia elettrone previste dalla teoria VSEPR massimizzano lo spazio attorno a qualsiasi regione di densità elettronica (legami o coppie solitarie).
Questo testo è stato adattato da Openstax, Chemistry 2e, Sezione 7.6: Struttura molecolare e polarità.
