11.12:
Curvas de Aquecimento e Resfriamento
11.12:
Curvas de Aquecimento e Resfriamento
Quando uma substância, isolada do seu ambiente, é submetida a alterações térmicas, observa-se a alteração correspondente da temperatura e da fase da substância; esta é representada graficamente pelas curvas de aquecimento e arrefecimento.
Por exemplo, a adição de calor aumenta a temperatura de um sólido; a quantidade de calor absorvida depende da capacidade térmica do sólido (q = mcsólidoΔT). De acordo com a termoquímica, a relação entre a quantidade de calor absorvida ou libertada por uma substância, q, e a respectiva alteração de temperatura, ΔT, é:
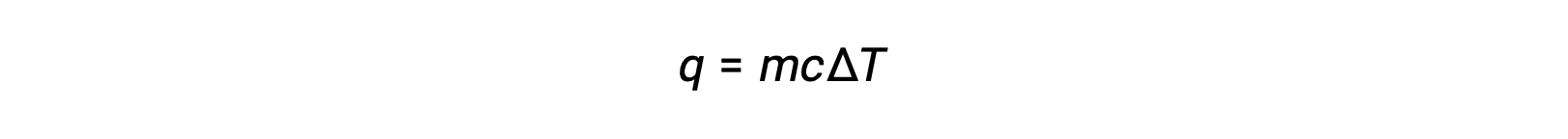
em que m é a massa da substância, e c é o seu calor específico. A relação aplica-se à matéria que está a ser aquecida ou arrefecida, mas não a mudar de estado.
Quando a temperatura é suficientemente alta, o sólido começa a derreter (Figura 1, ponto A). O calor absorvido depende da capacidade térmica do sólido (q = mcsólidoΔT), e um plateau é observado no seu ponto de fusão. O plateau indica uma mudança de estado de sólido para líquido, durante a qual a temperatura não aumenta devido ao calor de fusão (q = mΔHfusão). Por outras palavras, o aumento do calor é resultado de uma diminuição das atrações intermoleculares, em vez de aumentar as energias cinéticas moleculares. Consequentemente, enquanto uma substância está a mudar de estado, a sua temperatura permanece constante.
Assim que o sólido tiver derretido completamente (Figura 1, ponto B), o líquido começa a aquecer e sofre um aumento na temperatura. O calor absorvido depende da capacidade térmica do líquido (q = mclíquidoΔT). Quando o líquido atinge o seu ponto de ebulição, o líquido começa a vaporizar (Figura 1, ponto C) e a temperatura permanece constante apesar da entrada contínua de calor. Outro plateau (temperatura constante) é observado no ponto de ebulição do líquido durante a transição líquido-gás devido ao calor da vaporização (q = mΔHvap). Esta mesma temperatura é mantida pelo líquido desde que esteja a ferver. Se o calor for fornecido a uma taxa maior, a temperatura do líquido não sobe, mas, em vez disso, a ebulição torna-se mais vigorosa (rápida). Depois de todo o líquido ter vaporizado (Figura 1, ponto D), a temperatura do gás aumenta.
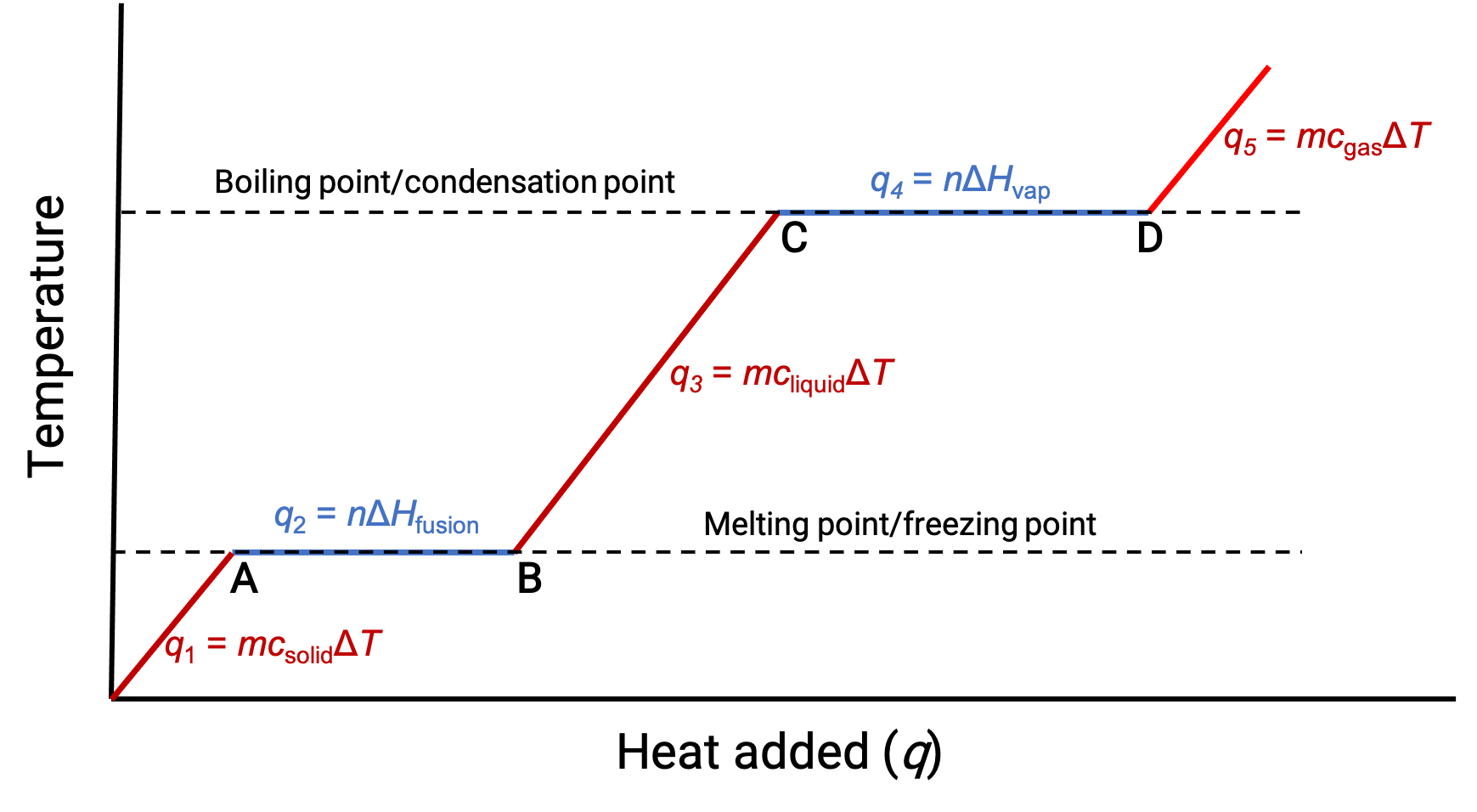
Figura 1. A curva de aquecimento representativa de uma substância representa alterações na temperatura que resultam na absorção de quantidades crescentes de calor. Os plateaus da curva (regiões de temperatura constante) são exibidos quando a substância é submetida a transições de fase.
Este texto é adaptado de Openstax, Chemistry 2e, Section 10.3: Phase Transitions.
