11.15:
Sólidos Moleculares e Iônicos
11.15:
Sólidos Moleculares e Iônicos
Os sólidos cristalinos estão divididos em quatro tipos: rede molecular, iónica, metálica, e covalente, com base no tipo de unidades constitutivas e as suas interações interpartículas.
Sólidos Moleculares
Os sólidos cristalinos moleculares, como gelo, sacarose (açúcar de mesa), e iodo, são sólidos compostos por moléculas neutras como as suas unidades constituintes. Essas moléculas são mantidas juntas por forças intermoleculares fracas, como forças de dispersão de London, interações dipolo-dipolo, ou ligações de hidrogénio, que ditam as suas propriedades (Tabela 1).
As forças de atração entre as unidades presentes em diferentes cristais variam muito, o que se reflete nos pontos de fusão desses cristais.
• Pequenas moléculas não polares simétricas, tais como H2, N2, O2, e F2, têm forças de dispersão fracas e formam sólidos moleculares com pontos de fusão muito baixos (abaixo de −200 °C). As substâncias constituídas por moléculas não polares maiores têm forças de atração maiores e derretem a temperaturas mais elevadas.
• Sólidos moleculares compostos por moléculas polares com momentos dipolares permanentes derretem a temperaturas ainda mais elevadas. Os exemplos incluem SO2 sólido e açúcar de mesa. As ligações de hidrogénio intermoleculares são principalmente responsáveis pela manutenção da malha tridimensional desses sólidos moleculares, como se pode vê em água congelada ou gelo.
As propriedades dos sólidos moleculares dependem do empacotamento eficiente das suas unidades constituintes, as moléculas, em três dimensões. Uma vez que as forças intermoleculares são dependentes de contacto, uma maior simetria das moléculas constituintes assegura um empacotamento próximo e compacto dentro da estrutura cristalina com atrações intermoleculares elevadas. Isto aumenta o ponto de fusão. A menor simetria das moléculas impede o seu empacotamento eficiente. As forças intermoleculares, portanto, não são tão eficazes, e o ponto de fusão é mais baixo.
Sólidos Iónicos
Os sólidos cristalinos iónicos, como o cloreto de sódio, são compostos por iões positivos e negativos que são mantidos juntos por fortes atrações eletrostáticas.
Os sólidos iónicos têm pontos de fusão elevados devido às fortes atrações iónicas. A força da interação iónica entre os catiões e os aniões em um sólido iónico pode ser aproximada pela força eletrostática, dada pela lei de Coulomb:
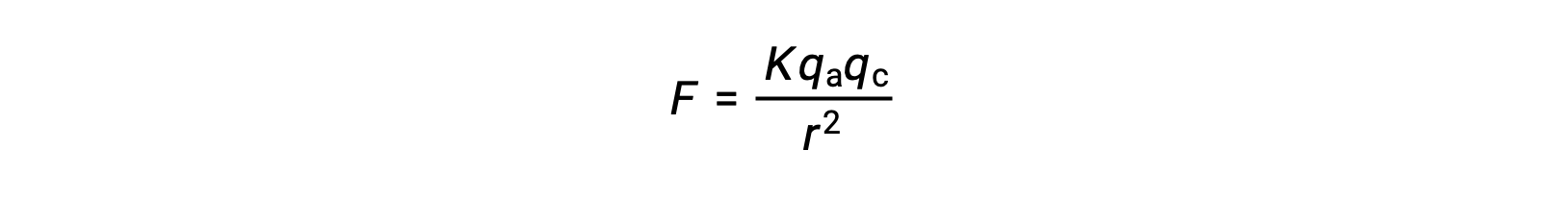
Aqui, K é uma constante de proporcionalidade, r é a distância entre as cargas, e qa e qc representam as cargas sobre os aniões e catiões, respectivamente. Quanto mais elevada a carga nos catiões e aniões, mais forte a força da atração iónica. Da mesma forma, o empacotamento próximo de aniões e catiões na malha de cristal reduz a distância entre as cargas, resultando em forças mais fortes da atração iónica.
Os sólidos iónicos são duros, também tendem a ser quebradiços, e quebram em vez de se dobrarem. A sua fragilidade é atribuída à presença de interações de atração (catião-anião) e repulsão (catião-catião e anião-anião) na malha de cristal. Como os iões não se podem mover livremente devido às forças coulômbicas fortes, os sólidos iónicos não conduzem a eletricidade. No entanto, no estado fundido ou dissolvidos em água, os iões ficam livres para se moverem e conduzirem a eletricidade.
Tabela 1. Características dos Sólidos Moleculares e Iónicos.
| Tipo de sólido cristalino | Tipo de partícula constitutiva | Tipo de atrações | Propriedades | Exemplos |
| Sólidos Moleculares | Moléculas | Forças intermoleculares (FIMs): Forças de dispersão, forças dipolo-dipolo, ligações de hidrogénio | dureza variável, fragilidade variável, pontos de fusão baixos, pobres condutores de calor e eletricidade | Ar, H2O (gelo), CO2 (gelo seco), I2, C12H22O11 (sacarose) |
| Sólidos Iónicos | Iões | Eletrostático | duros, quebradiços, pontos de fusão elevados a muito elevados, condutores de eletricidade em estado fundido e dissolvido | NaCl (sal de mesa), MgO (Óxido de Magnésio), Al2O3 (alumina) |
Parte deste texto foi adaptada de Openstax, Chemistry 2e, Section 10.5: The Solid State of Matter.
