12.7:
Solüsyon Konsantrasyonunu İfade Etmek
12.7:
Solüsyon Konsantrasyonunu İfade Etmek
Bir çözünen, tipik olarak çözücüden çok daha düşük bir konsantrasyonda bulunan bir çözelti bileşenidir. Solüt konsantrasyonları genellikle seyreltik (nispeten düşük konsantrasyonlu) ve konsantre (nispeten yüksek konsantrasyonlu) gibi nitel terimlerle tanımlanır.
Konsantrasyonlar, her biri belirli uygulamalar için uygun olan çok çeşitli ölçüm birimleri kullanılarak nicel olarak değerlendirilebilir. Molarite (M), kimyadaki birçok uygulama için yararlı bir konsantrasyon birimidir. Molarite, mol sayısındaki çözünen madde miktarının çözelti hacmine litre olarak bölünmesi olarak tanımlanır:

Çözelti hacimleri sıcaklığa göre değiştiğinden, molar konsantrasyonlar da aynı şekilde değişecektir. Molarite olarak ifade edildiğinde, aynı sayıda çözünen madde ve çözücü türü içeren bir çözeltinin konsantrasyonu, çözeltinin büzülmesine / genişlemesine bağlı olarak farklı sıcaklıklarda farklı olacaktır. Pek çok birleşik özelliği içeren hesaplamalar için daha uygun olan, değerleri sıcaklığa bağlı olmayan mol bazlı konsantrasyon birimleridir. Bu tür iki birim mol fraksiyonu (gazlarla ilgili önceki bölümde anlatılan) ve molalitedir.
Bir bileşenin, χA, mol fraksiyonu, molar miktarının tüm çözelti bileşenlerinin toplam mol sayısına oranıdır:
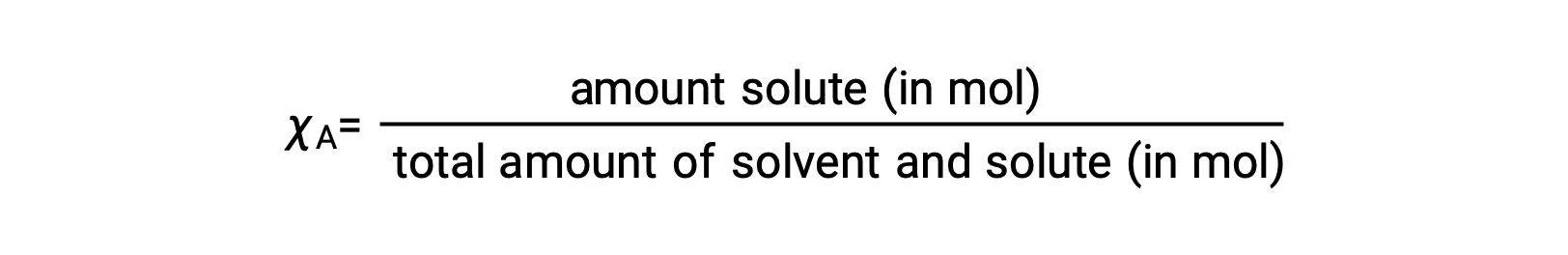
Bu tanıma göre, tüm çözelti bileşenleri (çözücü ve tüm çözünenler) için mol fraksiyonlarının toplamı bire eşittir.
Molalite, çözünen mol sayısının çözücünün kütlesine kilogram cinsinden oranı olarak tanımlanan bir konsantrasyon birimidir:
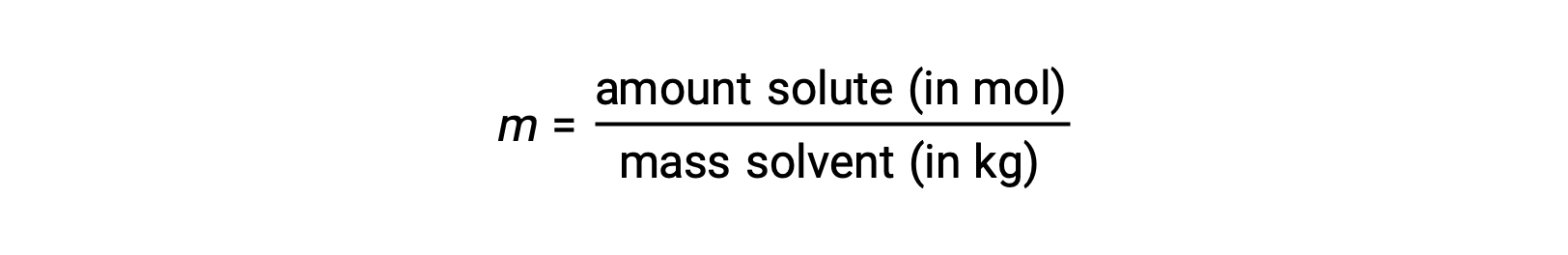
Bu birimler yalnızca kütleler ve molar miktarlar kullanılarak hesaplandığından, sıcaklıkla değişmezler ve bu nedenle sıcaklıktan bağımsız konsantrasyonlar gerektiren uygulamalar için daha uygundurlar.
Bu metin bu kaynaktan uyarlanmıştır Openstax, Chemistry 2e, Section 11.4: Colligative Properties.
Suggested Reading
- Irving, Harry MNH, Henry Freiser, and Thomas Summers West. Compendium of analytical nomenclature: definitive rules 1977. Elsevier, 2017.
