12.10:
Depressione del punto di congelamento e elevazione del punto di ebollizione
12.10:
Depressione del punto di congelamento e elevazione del punto di ebollizione
Elevazione del punto di ebollizione
Il punto di ebollizione di un liquido è la temperatura alla quale la sua pressione di vapore è uguale alla pressione atmosferica ambiente. Poiché la pressione di vapore di una soluzione viene abbassata a causa della presenza di soluti non volontari, è ovvio che il punto di ebollizione della soluzione verrà successivamente aumentato. La pressione di vapore aumenta con la temperatura, e quindi una soluzione richiederà una temperatura più alta di quella del solvente puro per ottenere una data pressione di vapore, incluso uno equivalente a quello dell’atmosfera circostante. L’aumento del punto di ebollizione osservato quando un soluto non volatile viene sciolto in un solvente, ΔTb, è chiamato elevazione del punto di ebollizione ed è direttamente proporzionale alla concentrazione di molluschi delle specie di soluti:
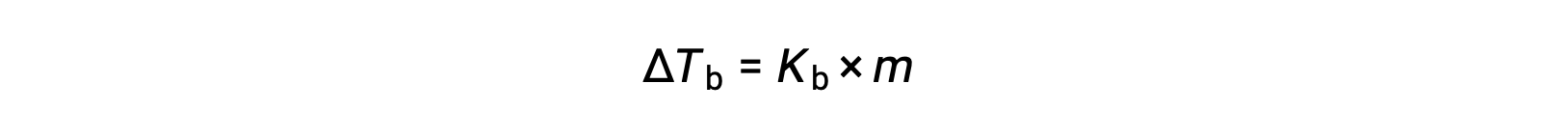
dove Kb è la costante di elevazione del punto di ebollizione, o la costante ebullioscopica e m è la concentrazione di molluschi (melanalità) di tutte le specie di soluti. Le costanti di elevazione del punto di ebollizione sono proprietà caratteristiche che dipendono dall’identità del solvente.
Depressione del punto di congelamento
Le soluzioni si congelano a temperature inferiori rispetto ai liquidi puri. Questo fenomeno è sfruttato in schemi di “disgelo” che usano sale, cloruro di calcio o urea per sciogliere il ghiaccio su strade e marciapiedi, e nell’uso del glicole etilenico come “antigelo” nei radiatori delle automobili. L’acqua di mare si congela a una temperatura inferiore rispetto all’acqua dolce, e così gli oceani Artico e Antartico rimangono scongelati anche a temperature inferiori a 0 °C (così come i fluidi corporei dei pesci e di altri animali marini a sangue freddo che vivono in questi oceani).
La diminuzione del punto di congelamento di una soluzione diluita rispetto a quella del solvente puro, ΔTf, è chiamata depressione del punto di congelamento ed è direttamente proporzionale alla concentrazione di molluschi del soluto
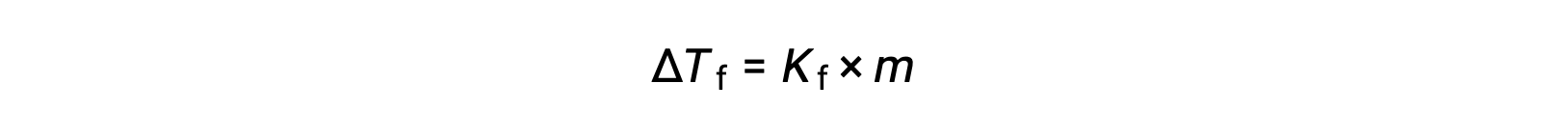
dove m è la concentrazione molale del soluto e Kf è chiamata costante di depressione del punto di congelamento (o costante crioscopica). Proprio come per le costanti di elevazione del punto di ebollizione, queste sono proprietà caratteristiche i cui valori dipendono dall’identità chimica del solvente.
Determinazione delle masse molari
La pressione osmotica e le variazioni del punto di congelamento, del punto di ebollizione e della pressione del vapore sono direttamente proporzionali al numero di specie di soluto presenti in una data quantità di soluzione. Di conseguenza, la misurazione di una di queste proprietà per una soluzione preparata utilizzando una massa nota di soluto consente di determinare la massa molare del soluto.
Ad esempio, una soluzione di 4,00 g di un non elettr trattato sciolto in 55,0 g di benzene si trova congelata a 2,32 °C. Assumendo il comportamento ideale della soluzione, qual è la massa molare di questo composto?
Per risolvere questo problema, in primo luogo, viene calcolato il cambiamento nel punto di congelamento dal punto di congelamento osservato e dal punto di congelamento del benzene puro:
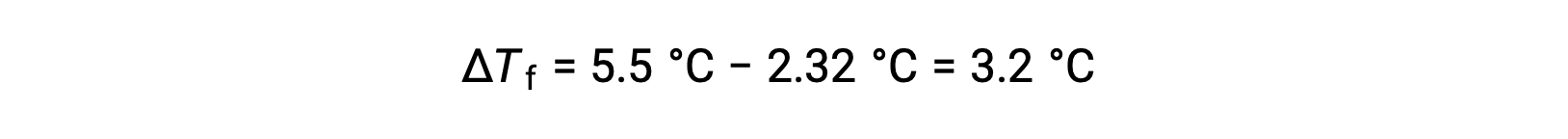
Quindi, la concentrazione di melano viene determinata da Kf, la costante di depressione del punto di congelamento per il benzene, e ΔTf:
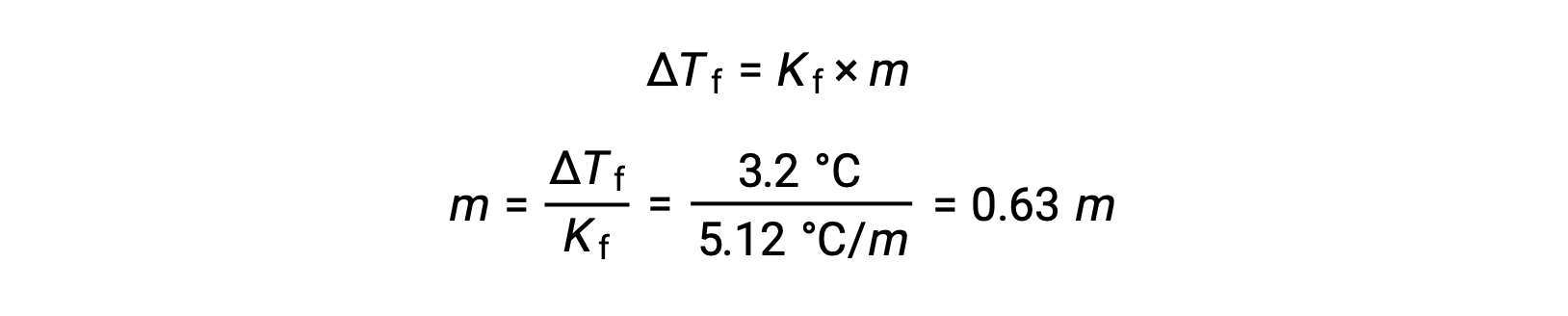
Successivamente, il numero di talpe del composto nella soluzione si trova dalla concentrazione di melanole e dalla massa di solvente che è stata utilizzata per fare la soluzione.
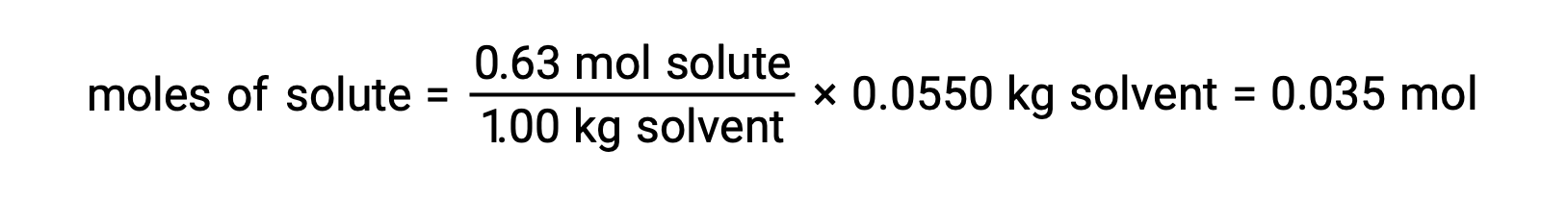
E, infine, viene determinata la massa molare dalla massa del soluto e il numero di talpe in quella massa.
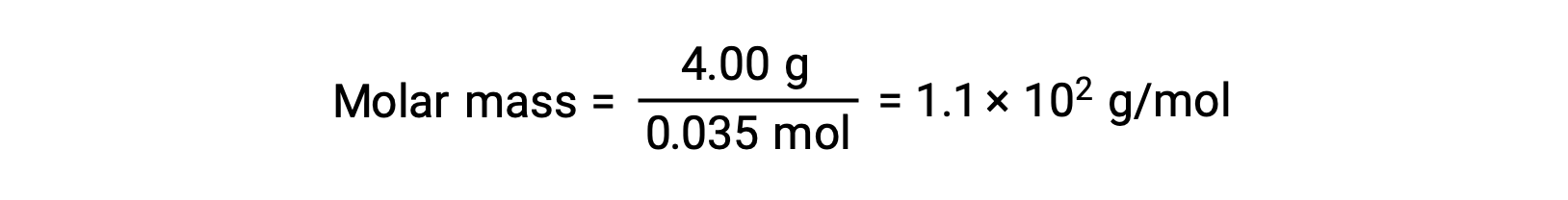
Questo testo è adattato da Openstax, Chimica 2e, Sezione 11.4: Proprietà Colligative.
Suggested Reading
- Steffel, Margaret J. "Raoult's law: A general chemistry experiment." Journal of Chemical Education 60, no. 6 (1983): 500.
- Berka, Ladislav H., and Nicholas Kildahl. "Experiments for Modern Introductory Chemistry: Intermolecular Forces and Raoult's Law." Journal of chemical education 71, no. 7 (1994): 613.
