13.6:
Emivita di una reazione
13.6:
Emivita di una reazione
L’emidità di una reazione (t1/2) è il tempo necessario per consumare la metà di una data quantità di reagente. In ogni emi vita che succede, viene consumata metà della concentrazione rimanente del reagente. Ad esempio, durante la decomposizione del perossido di idrogeno, durante la prima emiluizione (da 0,00 ore a 6,00 ore), la concentrazione di H2O2 diminuisce da 1.000 M a 0,500 M. Durante la seconda emita’ (da 6,00 ore a 12,00 ore), la concentrazione scende da 0,500 M a 0,250 M, mentre durante la terza emita’ scende da 0,250 M a 0,125 M. Quindi, durante ogni periodo successivo di 6,00 ore, la concentrazione di H2O2 diminuisce della metà.
L’eminazione di una reazione di primo ordine è indipendente dalla concentrazione del reagente. Tuttavia, l’emi vite di reazioni con altri ordini dipende dalle concentrazioni dei reagenti.
Emibilità delle reazioni di primo ordine
Un’equazione che riferisca l’emivio di una reazione di primo ordine alla sua costante di velocità può essere derivata dalla sua legge sui tassi integrata:
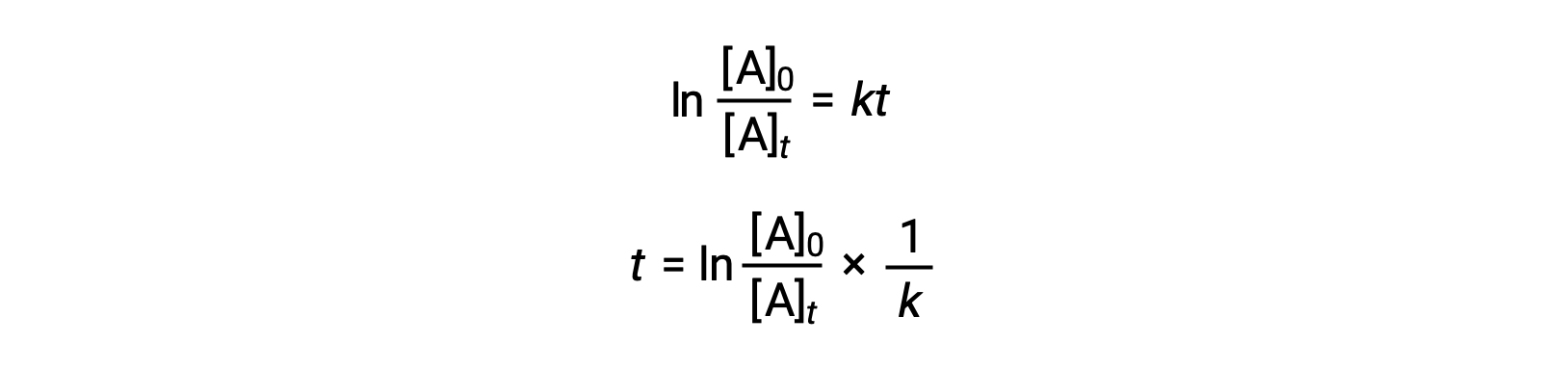
Secondo la definizione di emio-vita, al tempo t1/2, la concentrazione del reagente A è la metà della sua concentrazione iniziale. Pertanto; t = t1/2 e [A]t = 1/2 [A]0.
Sostituendo questi termini nella legge integrata riarrangiata sui tassi e semplificando si ottiene l’equazione per l’emiprotezione:
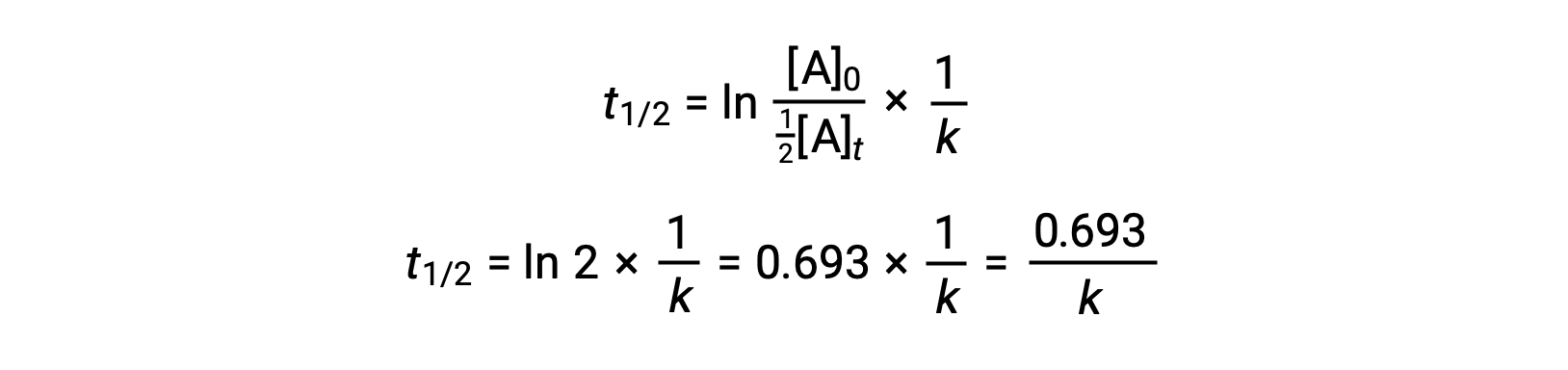
Questa equazione dell’emidità descrive una relazione inversa attesa tra l’emidità della reazione e la sua costante di velocità, k. Reazioni più veloci mostrano costanti di velocità maggiori e di conseguenza emi vite più brevi, mentre le reazioni più lente mostrano costanti di velocità più piccole e emimiti più lunghe.
Emibilità delle reazioni di secondo ordine
Seguendo lo stesso approccio delle reazioni di primo ordine, un’equazione che colleghi l’emi vita di una reazione di secondo ordine alla sua costante di velocità e alla sua concentrazione iniziale può essere derivata dalla sua legge integrata sui tassi:
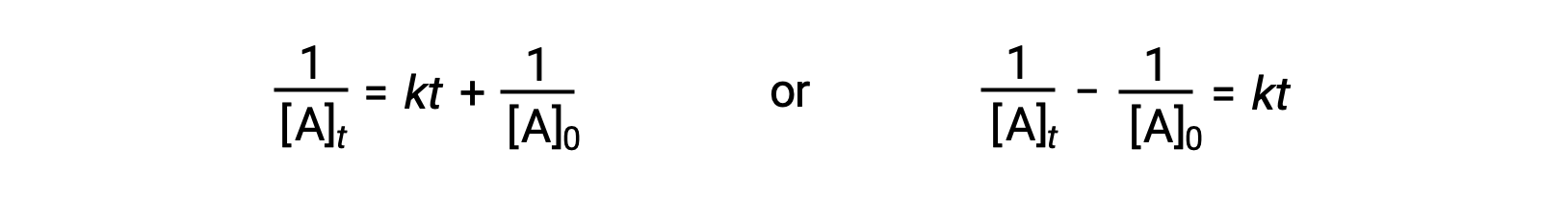
Sostituendo t = t 1/2 e [A]t = 1/2[A]0, la legge integrata sui tassi è semplificata:
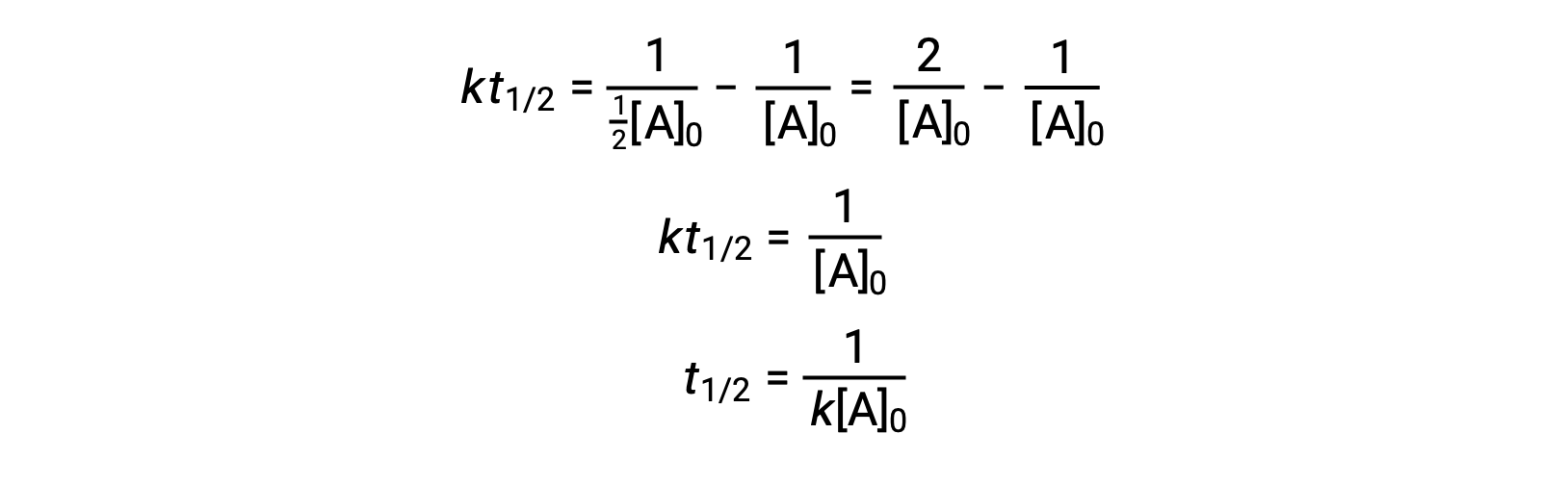
Per una reazione di secondo ordine, t1/2 è inversamente proporzionale alla concentrazione del reagente, e l’emi vita aumenta man mano che la reazione procede perché la concentrazione del reagente diminuisce. A differenza delle reazioni di primo ordine, la costante di velocità di una reazione di secondo ordine non può essere calcolata direttamente dall’emi vita a meno che non sia nota la concentrazione iniziale.
Emibilità delle reazioni di ordine zero
Un’equazione per l’emivio di ordine zero può anche essere derivata dalla sua legge sul tasso integrato:
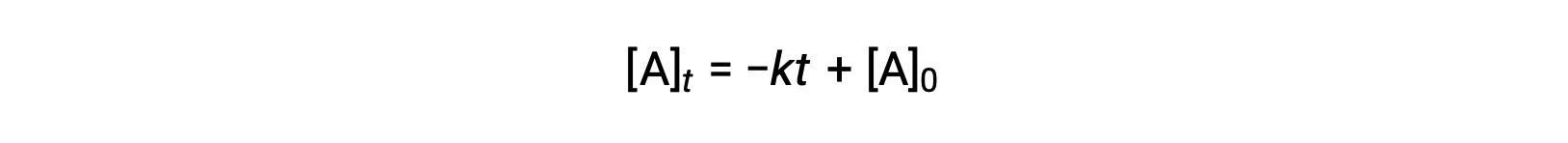
Sostituendo t = t 1/2 e [A]t = 1/2 [A]0, nella legge sui tassi integrati di ordine zero si ottiene:
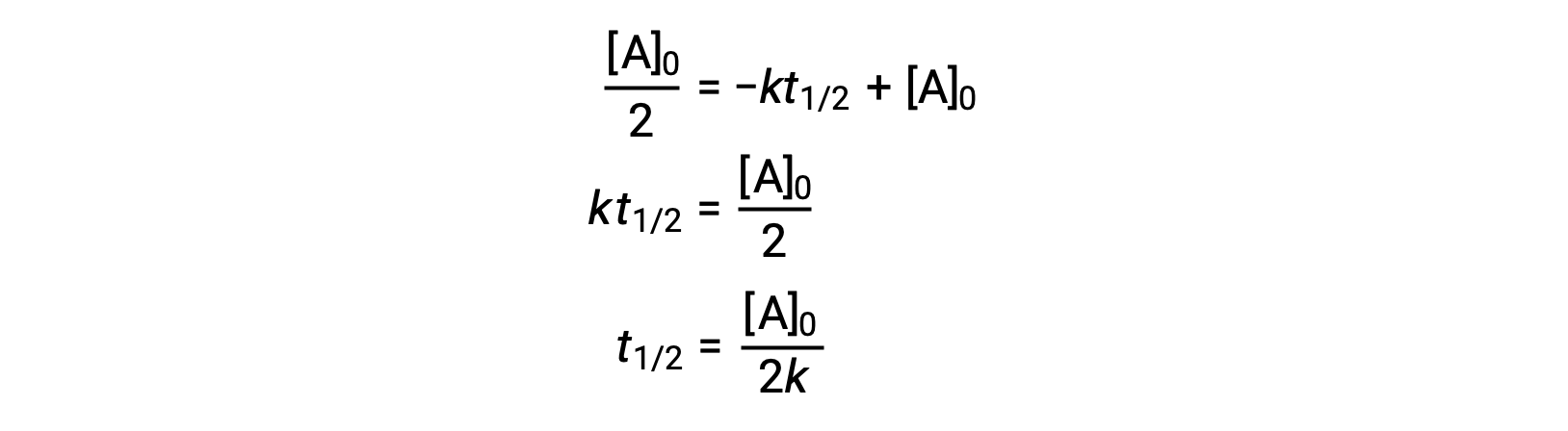
L’emi vita per una reazione di ordine zero è inversamente proporzionale alla sua costante di velocità. Tuttavia, l’emi vita di una reazione di ordine zero aumenta con l’aumentare della concentrazione iniziale.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 12.4: Leggi integrate sui tassi.
