13.9:
반응 메커니즘
13.9:
반응 메커니즘
화학 반응은 종종 서열에서 일어나는 두 개 이상의 뚜렷한 반응을 포함하는 단계적 방식으로 발생합니다. 균형 잡힌 방정식은 반응종과 제품 종을 나타내지만 분자 수준에서 반응이 어떻게 발생하는지에 대한 자세한 내용은 드러나지 않습니다. 반응 메커니즘(또는 반응 경로)은 반응이 발생하는 정밀하고 단계별 프로세스에 관한 세부 정보를 제공한다.
예를 들어 오존의 분해는 두 단계로 메커니즘을 따르는 것으로 보입니다.
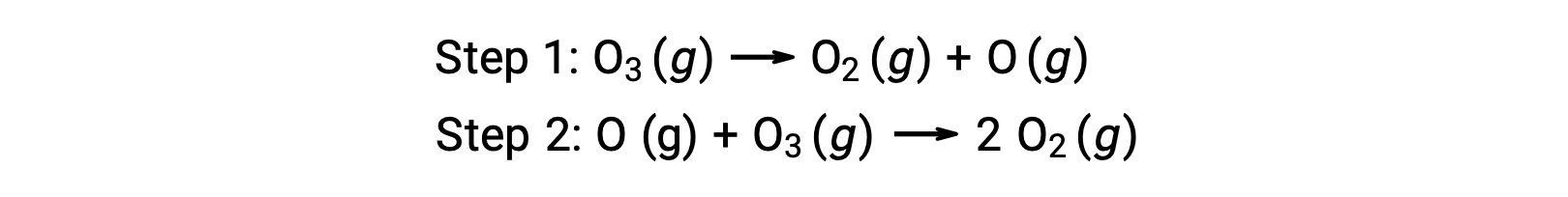
반응 메커니즘의 각 단계는 기본 반응이라고합니다. 이러한 기본 반응은 단계 방정식에 나타난 대로 순서대로 발생하며 전체 반응을 설명하는 균형 잡힌 화학 방정식을 산출합니다.
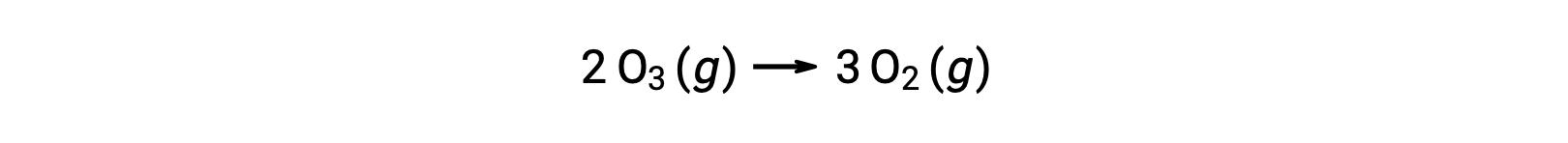
첫 번째 단계에서 생성된 산소 원자는 두 번째 단계에서 소비되며 전체 반응에서 제품으로 나타나지 않습니다. 한 단계에서 생산되고 후속 하나에서 소비되는 이러한 종은 반응 중간제라고합니다.
전반적인 반응 방정식은 2개의 오존 분자가 3개의 산소 분자를 주기 위하여 반응한다는 것을 나타내지만, 실제 반응 기계장치는 2개의 오존 분자의 직접적인 충돌 그리고 반응을 관련시키지 않습니다. 대신, O3 1개는 O2와 산소 원자를 산출하기 위하여 분해하고, 두 번째 O3 분자는 그 후에 2개의 추가 O2 분자를 산출하기 위하여 산소 원자와 반응합니다.
전반적인 반응을 나타내는 균형 잡힌 방정식과 달리, 기본 반응에 대한 방정식은 화학 적 변화의 명시적 표현이다. 초등회 반응 방정식은 결합 을 깨는 / 제작을 겪고있는 실제 반응제와 형성 된 제품을 묘사합니다. 따라서, 초등반응에 대한 요율법은 균형잡힌 화학방정식으로부터 직접 유래될 수 있다. 그러나, 이것은 일반적인 화학 반응에 대 한 경우, 속도 법률은 안정적으로 실험을 통해 결정 될 수 있습니다.
단분자 초등학교 반응
초등반응의 분자성은 반응성 종(원자, 분자 또는 이온)의 수이다. 예를 들어, 단분자 반응은 제품의 하나 이상의 분자를 생성하는 단일 반응의 반응을 포함합니다:

단분자 반응에 대한 속도 법은 첫 번째 순서입니다. 속도 = k [A].
단분자 반응은 복잡한 반응 메커니즘에서 여러 가지 기본 반응 중 하나일 수 있다. 예를 들어, 반응(O3(g)→ O2(g) + O)는 2단계 반응 메커니즘의 일부로 발생하는 단분자 초등반응을 보여 준다. 그러나, 일부 단분자 반응은 단단계 반응 메커니즘의 유일한 단계일 수 있다. (즉, “전반적인” 반응은 경우에 따라 기본적인 반응일 수도 있습니다.) 예를 들어, 사이클로부탄, C4H8,에틸렌, C2H4의가스상 분해는 화학방정식으로 표현된다.
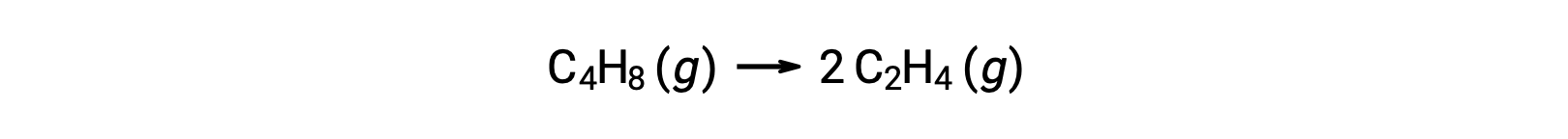
이 방정식은 단분자 기본 과정을 설명하는 전반적인 반응을 나타냅니다. 이 방정식에서 예측된 금리법은 1차 반응을 보이고 있으며, 전체적인 반응을 위해 실험적으로 파생된 속도법과 동일하게 판명되었습니다.
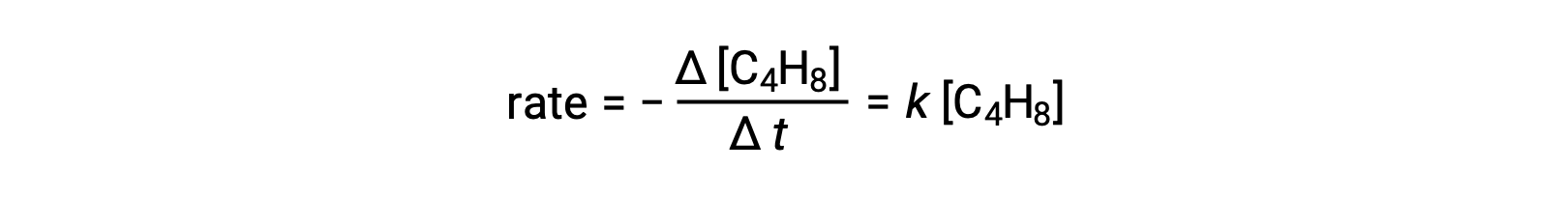
관찰 및 예측 속도 법률 간의 이 합의는 제안된 단분자, 단단계 공정이 부타디엔 반응에 대한 합리적인 메커니즘임을 나타냅니다.
분자 초등학교 반응
분자 반응은 2개의 반응종을 관련시킵니다. 예를 들어:
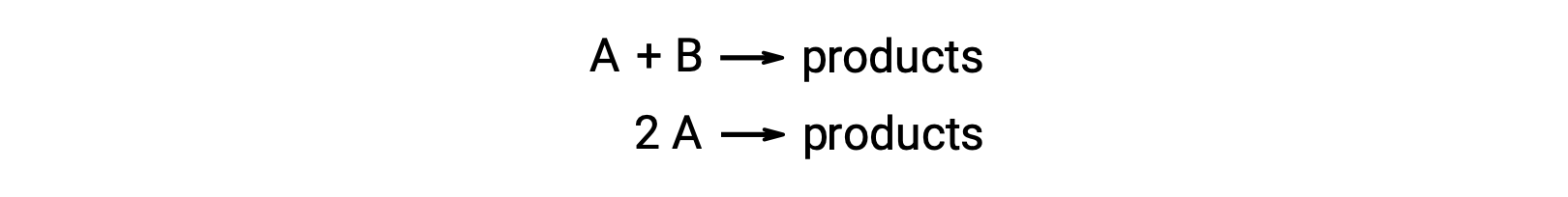
두 반응성 분자가 다른 첫 번째 유형에서, 속도법은 A에서 1차, B의 1차(전체 2차)입니다.
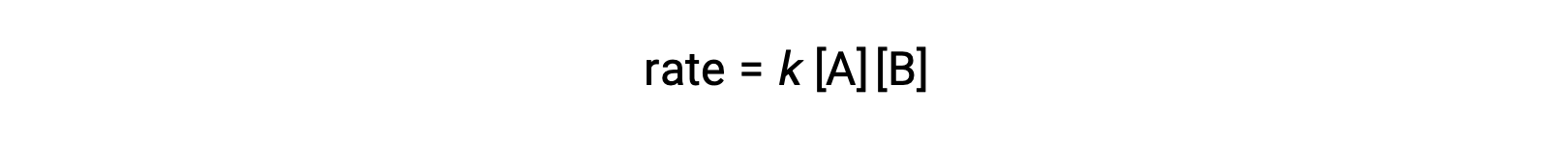
두 개의 동일한 분자가 충돌하여 반응하는 두 번째 유형에서 속도 법은 A에서두 번째 순서입니다.
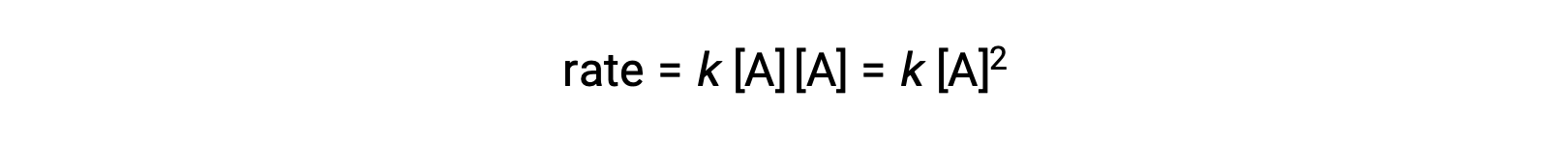
일부 화학 반응은 단일 분자 기본 반응으로 구성된 메커니즘에 의해 발생합니다. 한 가지 예는 일산화탄소를 가진 이산화질소의 반응입니다:
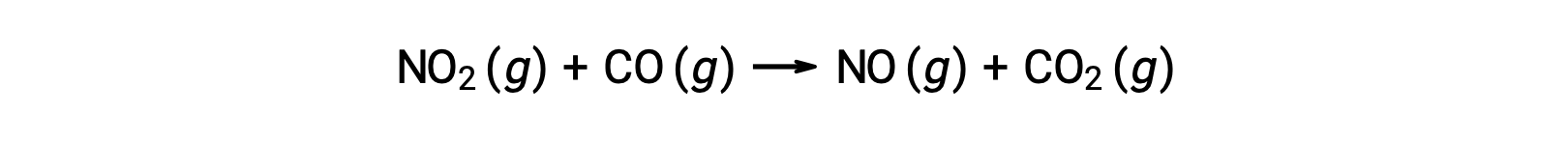
이중 분자 기본 반응은 또한 다단계 반응 메커니즘의 단계로 관련될 수 있다. 오존을 가진 원자 산소의 반응은 2 단계 오존 분해 메커니즘의 두 번째 단계입니다:
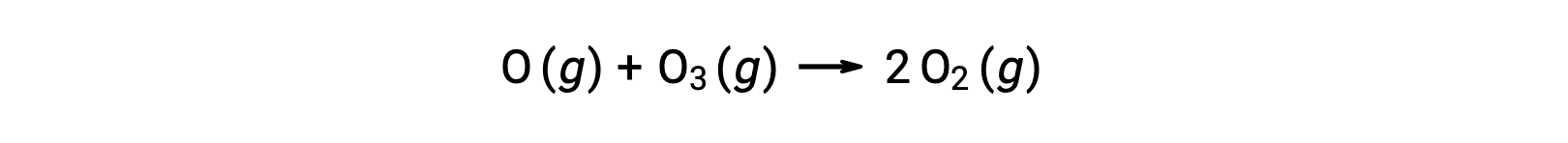
테르 분자 초등학교 반응
1차 적인 심분자 반응은 3개의 원자, 분자, 또는 이온의 동시 충돌을 관련시킵니다. 3개의 입자가 동시에 충돌할 확률이 매우 드물기 때문에 테르분자 초등학교 반응은 드물다. 그러나 몇 가지 확립 된 기분자 기본 반응이 있습니다. 산소와 산화 질소의 반응은 세포 분자 단계를 포함 하는 것으로 보인다:
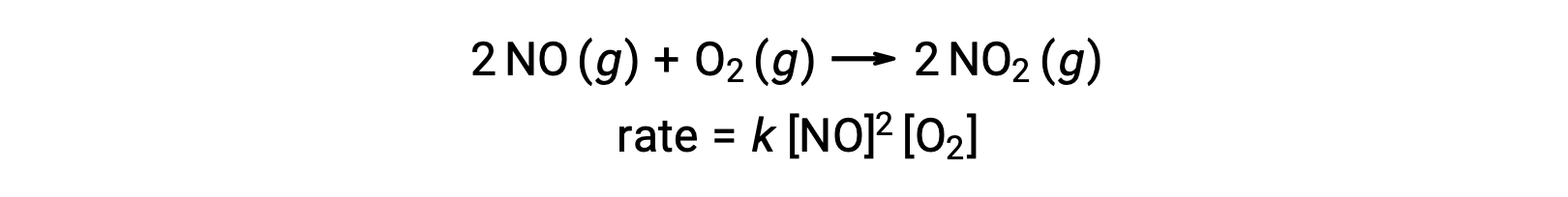
마찬가지로, 염소와 산화 질소의 반응은 테르 분자 단계를 포함 하는 것으로 보인다:
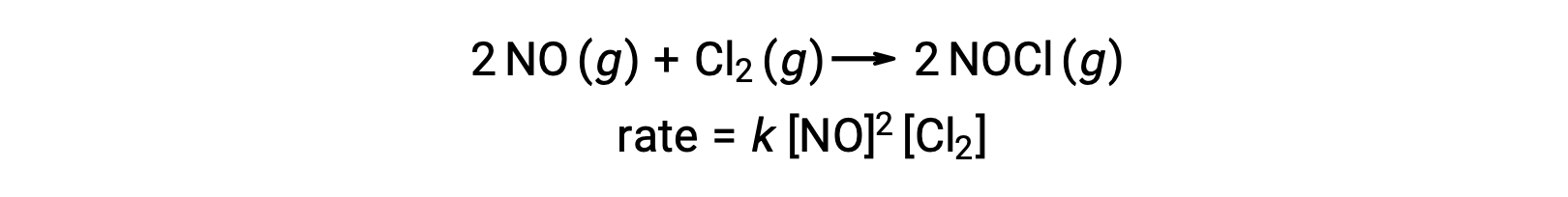
종종 다단계 반응 메커니즘의 기본 단계 중 하나는 다른 단계보다 상당히 느립니다. 반응이 가장 느린 단계보다 빠르게 진행될 수 없기 때문에 이 단계는 전체 적인 반응이 발생하는 속도를 제한합니다. 따라서 가장 느린 초등학교 단계는 반응의 속도 제한 단계(또는 속도 결정 단계)라고 합니다.
