13.11:
Catalisi
13.11:
Catalisi
La presenza di un catalizzatore influisce sulla velocità di una reazione chimica. Un catalizzatore è una sostanza che può aumentare la velocità di reazione senza essere consumata durante il processo. Una comprensione di base del ruolo di catalizzatore durante le reazioni chimiche può essere compresa dal concetto di meccanismi di reazione e diagrammi energetici.
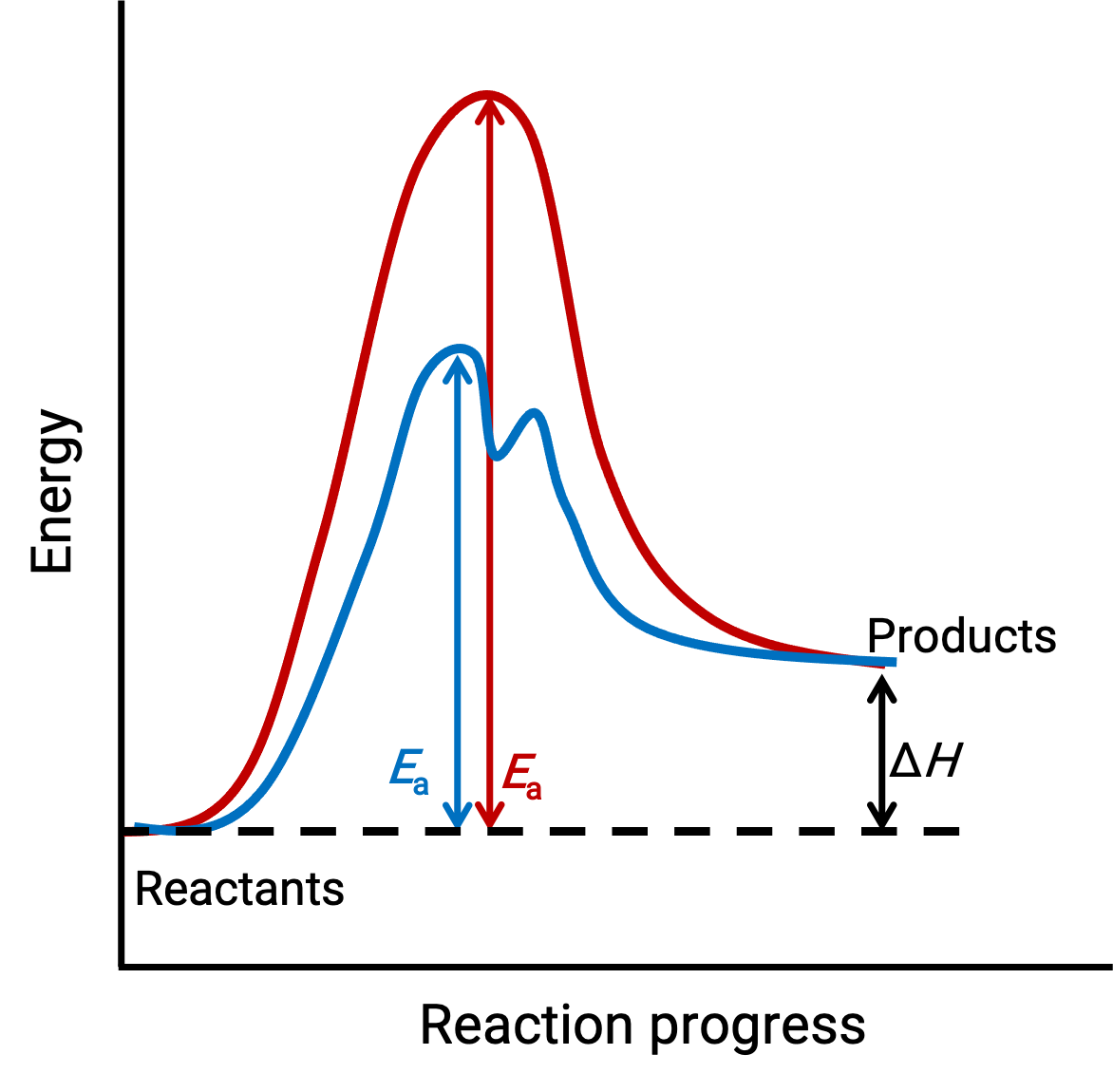
L’immagine illustrata rappresenta i diagrammi di reazione per un processo chimico endotermico che progredisce in assenza (curva rossa) e presenza (curva blu) di un catalizzatore.
Entrambe le curve rappresentano la stessa reazione complessiva: iniziano e finiscono alle stesse energie. (In questo caso, i prodotti hanno più energia dei reagenti. Quindi, la reazione è endotermica). Tuttavia, i loro meccanismi di reazione sono diversi. La reazione noncatalizzata procede attraverso un meccanismo in un solo passaggio (con un solo stato di transizione osservato). Al contrario, la reazione catalizzata segue un meccanismo in due fase (si osservano due stati di transizione) con un’energia di attivazione notevolmente minore. Questa differenza nelle vie di reazione illustra il ruolo del catalizzatore nel fornire un meccanismo di reazione alternativo con minore energia di attivazione, accelerando così le reazioni.
Il meccanismo di reazione catalizzato non ha bisogno di coinvolgere un numero maggiore di passaggi elementari rispetto al meccanismo non catalizzato. Tuttavia, deve fornire un percorso di reazione alternativo il cui passaggio di determinazione della velocità è più veloce (con una E a inferiore oenergia di attivazione).
Una reazione catalitica può essere classificata come omogenea o eterogenea, in base agli stati fisici che i catalizzatori e i reagenti esistono durante il processo catalitico.
Catalisi omogenea
Nella catalisi omogenea, il catalizzatore è presente nella stessa fase dei reagenti : solido, liquido o gas. Durante il processo, il catalizzatore interagisce con il reagente per formare una sostanza intermedia, che poi si decompone o reagisce con un altro reagente in uno o più passaggi per rigenerare il catalizzatore originale e formare il prodotto finale.
Un esempio di catalisi omogenea è il processo chimico che comporta la decomposizione dell’ozono che si verifica nell’atmosfera superiore della terra. L’ozono è una molecola relativamente instabile che si decompone per produrre ossigeno biatomico. Questa reazione di decomposizione è coerente con il seguente meccanismo in due passaggi:
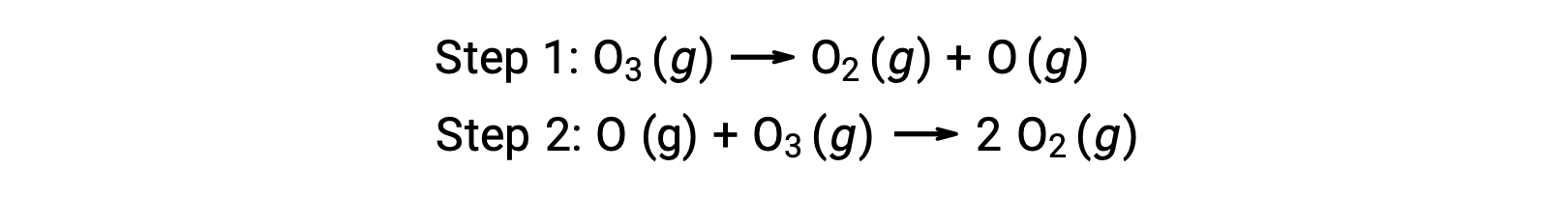
Molte sostanze possono catalizzare la decomposizione dell’ozono. Ad esempio, si ritiene che la decomposizione dell’ozono catalizzata dall’ossido nitrico avvenga attraverso il seguente meccanismo in tre passaggi:
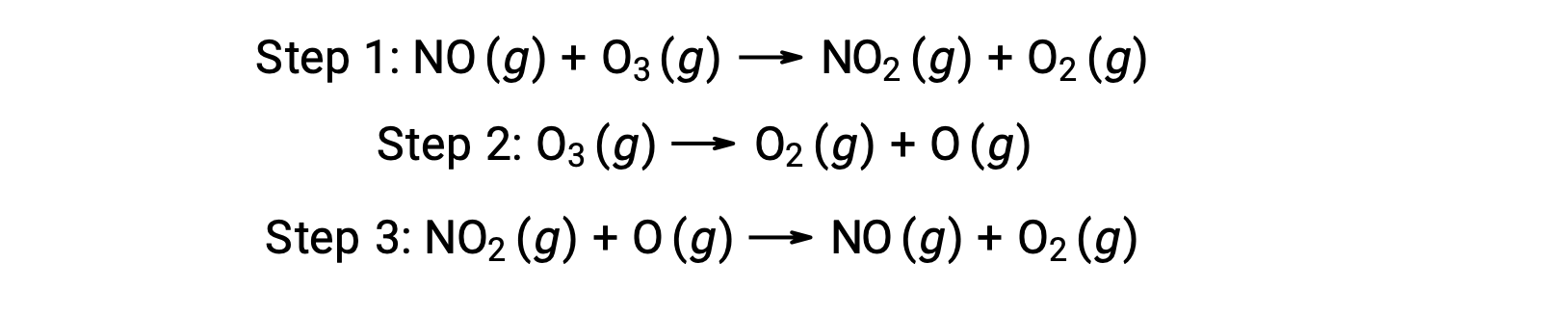
Tuttavia, la reazione complessiva è la stessa sia per il meccanismo non catalizzato in due step che per il meccanismo a tre step catalizzato da NO:
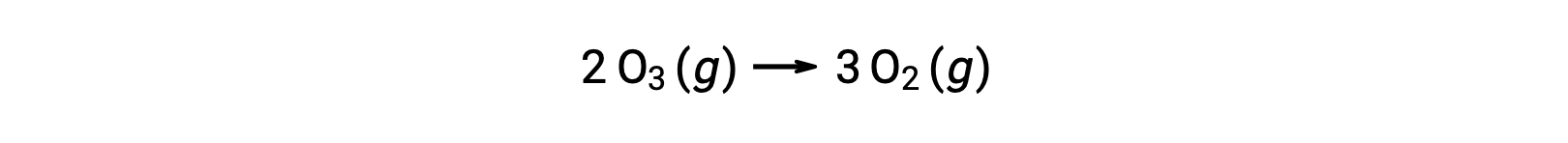
Nella reazione catalizzata, si noti che IL NO è un reagente nella prima fase del meccanismo e un prodotto nell’ultimo passaggio. Questo è un altro tratto caratteristico di un catalizzatore: Sebbene partecipi alla reazione chimica, non viene consumato dalla reazione. Inoltre, in questa catalisi omogenea, sia il reagente che il catalizzatore esistono in una fase gassosa.
Catalisi eterogenea
Nella catalisi eterogenea, il catalizzatore è presente in una fase diversa (di solito un solido) rispetto ai reagenti. Tali catalizzatori generalmente funzionano arredare una superficie attiva su cui può verificarsi una reazione. Reazioni di fase gassosa e liquida catalizzate da catalizzatori eterogenei si verificano sulla superficie del catalizzatore piuttosto che all’interno della fase gassosa o liquida.
La catalisi eterogenea coinvolge tipicamente i seguenti processi:
- Adsorbimento del o dei reagenti sulla superficie del catalizzatore
- Attivazione del o dei reagenti adsorbiti
- La reazione del reagente o dei reagenti adsorbiti
- Desorbimento di prodotti dalla superficie del catalizzatore
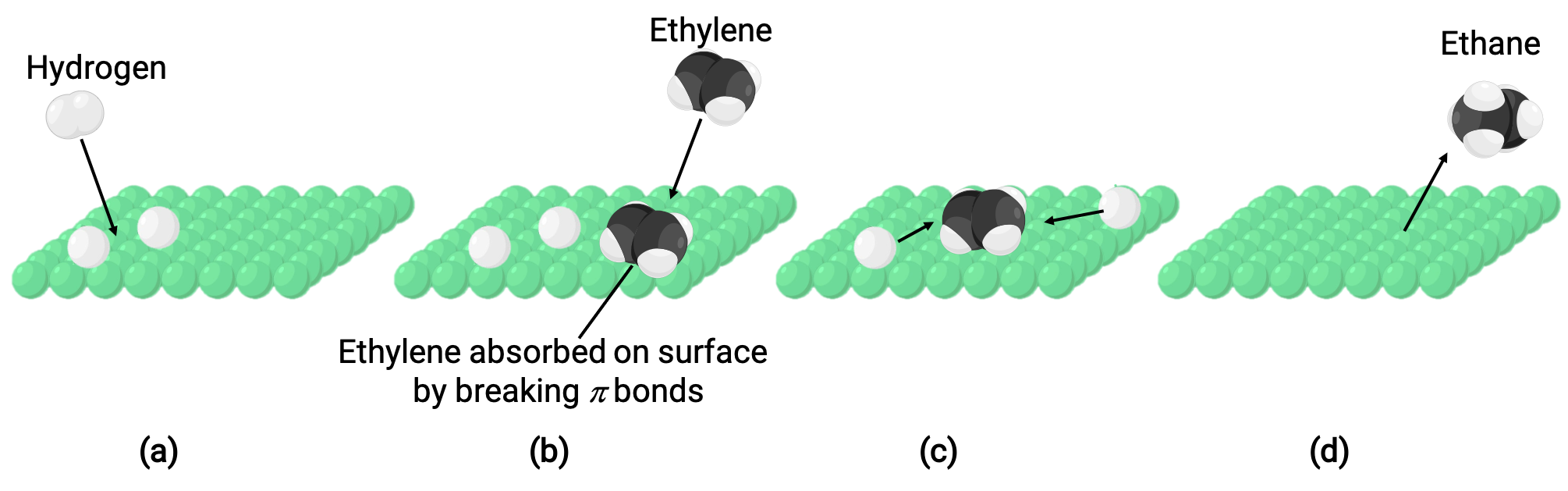
L’immagine illustrata rappresenta il meccanismo di reazione che coinvolge la catalisi eterogenea di etene e idrogeno gassoso su una superficie solida di nichel, formando gas di etano (C2H4 + H2 ⟶ C2H6):
(a) Adsorbimenti di idrogeno sulla superficie del nichel. Durante il processo, i legami idrogeno-idrogeno vengono rotti per formare legami nichel-idrogeno.
(b) Ethene adsorbe anche sulla superficie del nichel rompendo il legame carbonio-carbonio pi e formando legami nichel-carbonio.
(c) Gli atomi di idrogeno si diffondono attraverso la superficie e formano nuovi legami carbonio-idrogeno quando si scontrano per formare etano (C2H6).
(d) Le molecole di etano si dissorbono dalla superficie del nichel.
La catalisi eterogenea viene utilizzata per produrre industrialmente prodotti chimici come ammoniaca, acido nitrico, acido solforico e metanolo. Catalizzatori eterogenei sono utilizzati anche nei convertitori catalitici presenti sulla maggior parte delle automobili alimentate a benzina.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 12.7: Catalisi.
