14.1:
동적평형
14.1:
동적평형
가역적인 화학 반응은 전방(왼쪽에서 오른쪽) 및 역(오른쪽에서 왼쪽) 방향으로 진행되는 화학 공정을 나타냅니다. 전방 및 역반응의 비율이 같을 때, 반응제와 제품 종의 농도는 시간이 지남에 따라 일정하게 유지되고 시스템이 평형에 있습니다. 특수 이중 화살표는 반응의 가역적 특성을 강조하는 데 사용됩니다. 평형 시스템에서 반응제 및 제품의 상대적 농도는 크게 다릅니다. 일부 시스템에는 대부분 평형에서 제품이 포함되어 있으며 일부는 대부분 반응물질을 포함하고 있으며 일부는 양 모두를 함유하고 있습니다.
화학 반응의 동적 평형
방정식에 의해 설명 된 갈색 이산화질소를 산출하기 위해 무색 디질소 테트옥사이드의 가역 분해를 고려하십시오.
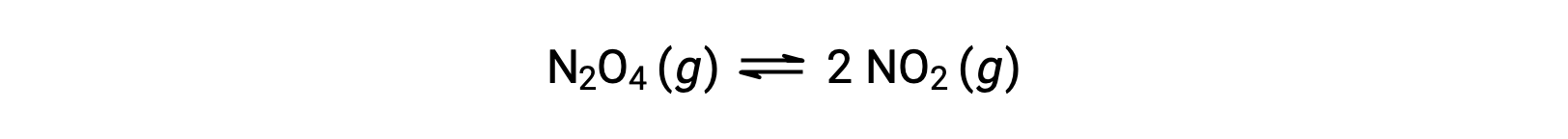
반응이 시작됨에따라(시간 =0),N2O4 반응제의 농도는 유한하고 NO2 제품의 농도가 0이므로 반대 반응 속도가 0이면 전방 반응이 유한 속도로 진행됩니다. 시간이 지남에 따라, N2O4 소비 하 고 그것의 농도 떨어지는, NO2 생산 하는 동안, 그리고 그것의 농도 증가. 반응제의 농도가 감소하면 전방 반응 속도가 느려지고, 제품 농도가 증가하면 역반응 속도가 빨라집니다. 이 과정은 전방 및 역반응 비율이 동등해질때까지 계속되며, 이 때 반응은 평형에 도달했습니다. 화학적 평형이 역동적이라는 점을 강조하는 것이중요합니다. 평형에 대한 반응은 “중지”되지 않았지만 동일한 속도로 전방 및 역 방향에서 진행되고 있습니다. 따라서, 평형에서,N2O4 및 NO2의 농도는 NO2의 형성 비율이 NO2의소비 속도와 정확히 동일하기 때문에 더 이상 변경되지 않으며, N2O4의 형성 속도는 N2O4의소비 속도와 정확히 동일하다.
동질적 및 이질적 평형
동질적 평형은 다음 예제에서 알 수 있듯이 모든 반응제및 제품(및 모든 촉매,해당되는 경우)이 동일한 단계에서 존재하는 것입니다.
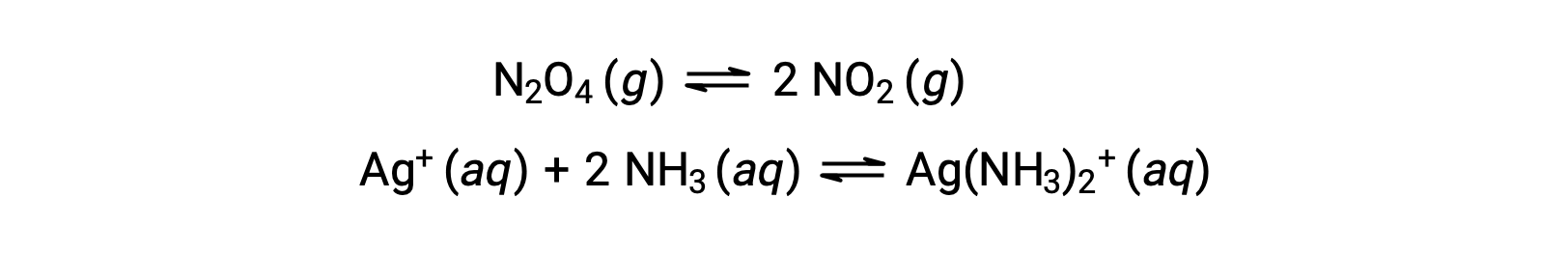
이기종 평형은 다음 예에서 설명한 바와 같이 두 개 이상의 다른 단계에서 반응제와 제품을 포함합니다.
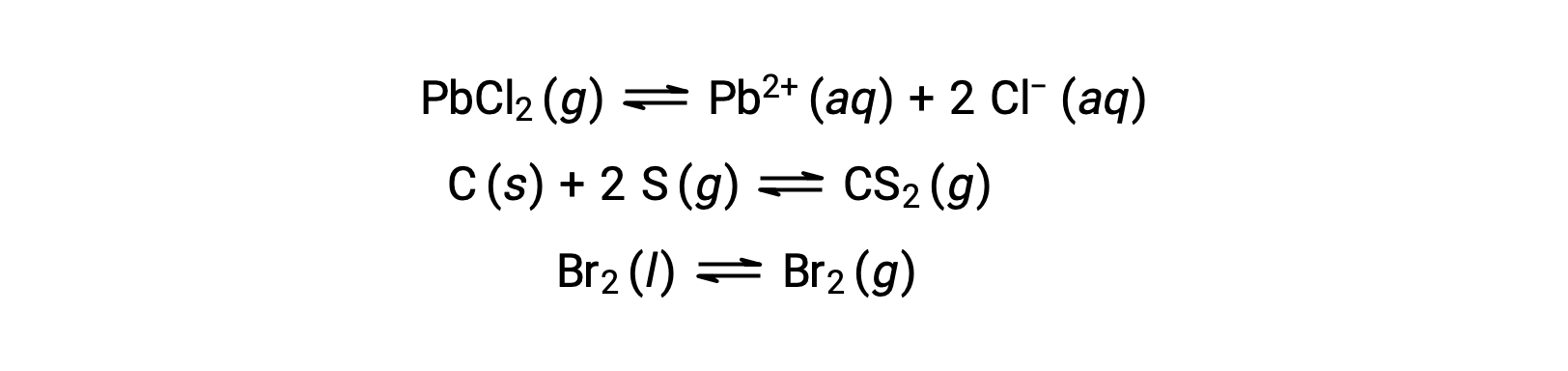
이 텍스트는 Openstax, 화학 2e, 섹션 13.1 화학 평형에서 적응되었습니다.
