14.2:
平衡定数
14.2:
平衡定数
二酸化硫黄の酸化について考えてみましょう。
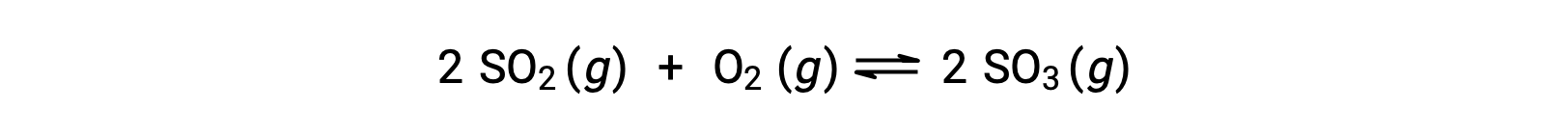
反応物のみの混合物から始まる反応では、最初の生成物濃度はゼロに等しいです。反応が平衡に向かって順方向に進むにつれて、反応物の濃度は減少し、生成物の濃度は増加します。平衡状態になると、反応物と生成物の濃度は一定になります。
生成物のみが存在する状態で反応が開始された場合、反応は逆方向の平衡に向かって進む。生成物の濃度は時間とともに減少し、反応物の濃度は平衡状態で濃度が一定になるまで増加します。
質量作用の法則とは、平衡状態における反応物の濃度に対する生成物の濃度の比を、それぞれの化学量論係数でべき乗したものが、平衡定数K(またはKc)に等しいというものです。
したがって、上記の反応の平衡定数式は次のように書かれます。
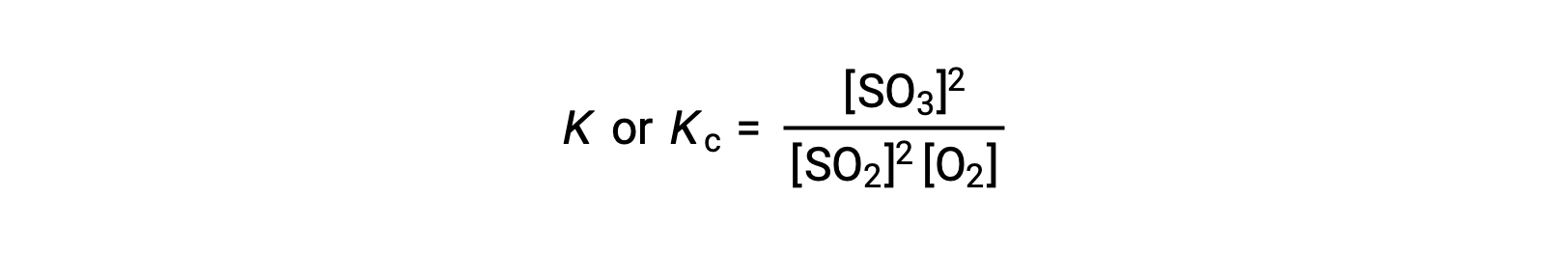
ここで、添字 ‘c’は、平衡定数が反応物と生成物のモル濃度を考慮していることを示しています。
平衡定数の大きさは、平衡状態にある反応混合物の組成を反映します。大きなKを示す反応は、反応物のほとんどが生成物に変換されたときに平衡に達しますが、小さなK は、反応物がほとんど変換されないで平衡に達したことを示します。ここで注意すべき点は、Kの大きさは、平衡に達するまでの速さや遅さを示すものではないということです。平衡は、ほぼ瞬間的に成立するものもあれば、数日、数年、あるいはそれ以上の時間をかけても知覚できる変化が観察されないほどゆっくりと成立するものもあります。ある反応の平衡定数は、その反応物や生成物を含む混合物の挙動を予測するのに用いることができます。前述の二酸化硫黄の酸化プロセスで示されたように、化学反応は平衡を達成するために必要な方向に進行します。
連動した平衡状態
多くの平衡系では、2つ以上の 連結した 平衡反応、つまり1つ以上の反応種または生成物種を共通に持つ反応が関与しています。結合平衡を含む系の K 値は、個々の反応の K 値と関連付けることができます。この方法には、以下のような3つの基本的な手順からなります。
• 化学式の向きを変えると、「反応物」と「生成物」が入れ替わるため、反応式を逆転させた式の平衡定数は、もとの式の平衡定数の逆数になります。
• 式中の化学量論的係数をある係数 x だけ変化させると、平衡定数も同じ係数だけ指数関数的に変化します。
• 2つ以上の化学平衡式を組み合わせると、個々の反応’K 値の積を平衡定数とする全体の化学平衡式が得られます。
不均一系平衡における化学平衡式
2つ以上の異なる相の反応物と生成物を含む不均一系平衡の場合、以下の例で示すように、純粋な固体または純粋な液体の濃度は平衡定数の式には含まれません。

これは、純粋な液体と純粋な固体の相対的な濃度が、反応中に一定であるためです。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 13.2 Equilibrium Constants.
