15.3:
Water: een Bronsted-Lowry Zuur en Base
15.3:
Water: een Bronsted-Lowry Zuur en Base
The reaction between a Brønsted-Lowry acid and water is called acid ionization. For example, when hydrogen fluoride dissolves in water and ionizes, protons are transferred from hydrogen fluoride molecules to water molecules, yielding hydronium ions and fluoride ions:
Base ionization of a species occurs when it accepts protons from water molecules. In the example below, pyridine molecules, C5NH5, undergo base ionization when dissolved in water, yielding hydroxide and pyridinium ions:
The preceding ionization reactions suggest that water may function as both a base (as in its reaction with hydrogen fluoride) and an acid (as in its reaction with ammonia). Species capable of either donating or accepting protons are called amphiprotic, or more generally, amphoteric, a term that may be used for acids and bases per definitions other than the Brønsted-Lowry one. The equations below show the two possible acid-base reactions for two amphiprotic species, bicarbonate ion, and water:
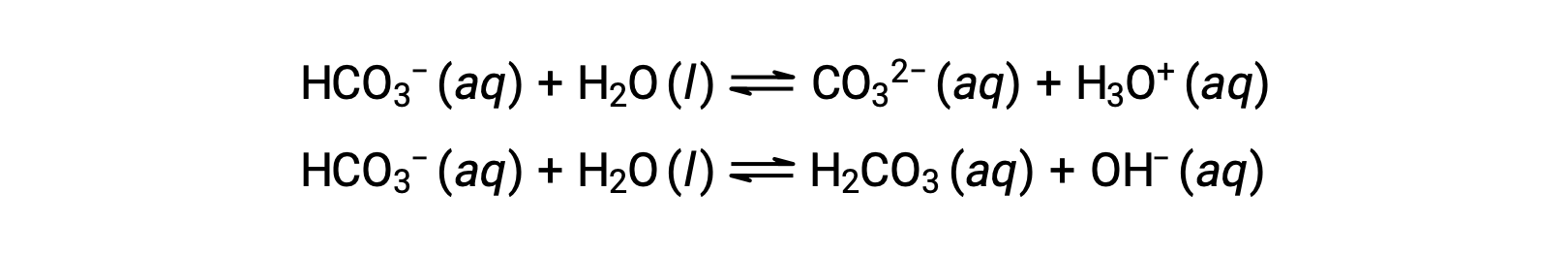
The first equation represents the reaction of bicarbonate as an acid with water as a base, whereas the second represents the reaction of bicarbonate as a base with water as an acid. When bicarbonate is added to water, both these equilibria are established simultaneously and the composition of the resulting solution may be determined through appropriate equilibrium calculations. In the liquid state, molecules of an amphiprotic substance can react with one another as illustrated for water in the equations below:
The process in which like molecules react to yield ions is called autoionization. Liquid water undergoes autoionization to a very slight extent; at 25 °C, approximately two out of every billion water molecules are ionized. The extent of the water autoionization process is reflected in the value of its equilibrium constant, the ion-product constant for water, KW:
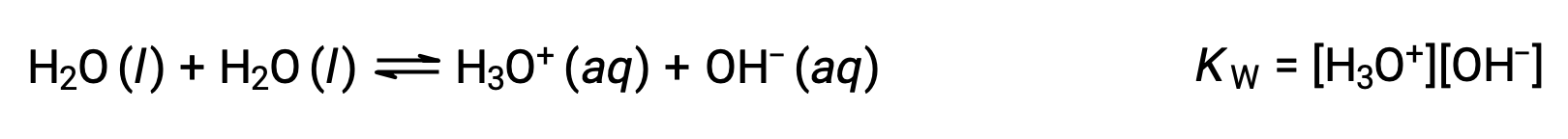
The slight ionization of pure water is reflected in the small value of the equilibrium constant; at 25 °C, KW has a value of 1.0 × 10−14.
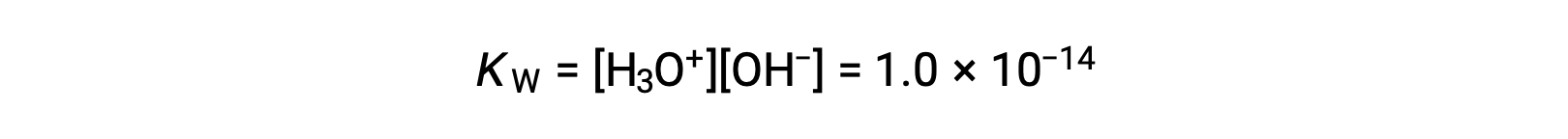
The process is endothermic, and so the extent of ionization and the resulting concentrations of hydronium ion and hydroxide ion increase with temperature. For example, at 100 °C, the value for KW is about 5.6 × 10−13, roughly 50 times larger than the value at 25 °C.
The autoionization of water yields the same number of hydronium and hydroxide ions. Therefore, in pure water at 25 °C:
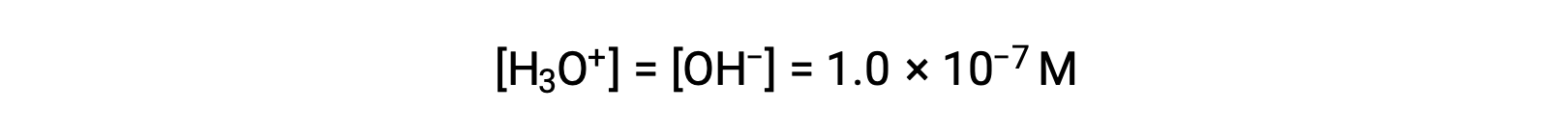
The concentrations of these ions in a solution are often critical determinants of the solution’s properties and the chemical behaviors of its other solutes, and specific vocabulary has been developed to describe these concentrations in relative terms. A solution is neutral if it contains equal concentrations of hydronium and hydroxide ions; acidic if it contains a greater concentration of hydronium ions than hydroxide ions; and basic if it contains a lesser concentration of hydronium ions than hydroxide ions.
Summary of Relations for Acidic, Basic, and Neutral Solutions
| Classification | Relative Ion Concentrations | pH at 25 °C |
| acidic | [H3O+] > [OH−] | pH < 7 |
| neutral | [H3O+] = [OH−] | pH = 7 |
| basic | [H3O+] < [OH−] | pH > 7 |
This text is adapted from Openstax, Chemistry 2e, Section 14.1: Brønsted-Lowry Acids and Bases, and Section 14.2: pH and pOH.
