15.5:
Punti di forza relativi delle coppie coniugate acido-base
15.5:
Punti di forza relativi delle coppie coniugate acido-base
La chimica acido-base di Brønsted-Lowry è il trasferimento di protoni; quindi, la logica suggerisce una relazione tra i punti di forza relativi delle coppie acido-base coniugate. La forza di un acido o di una base è quantificata nella sua costante di ionizzazione, Ka o Kb, che rappresenta l’estensione della reazione di ionizzazione acida o di base. Per la coppia acido-base coniugata HA / A − ,leequazioni di equilibrio di ionizzazione e le espressioni costanti di ionizzazione sono
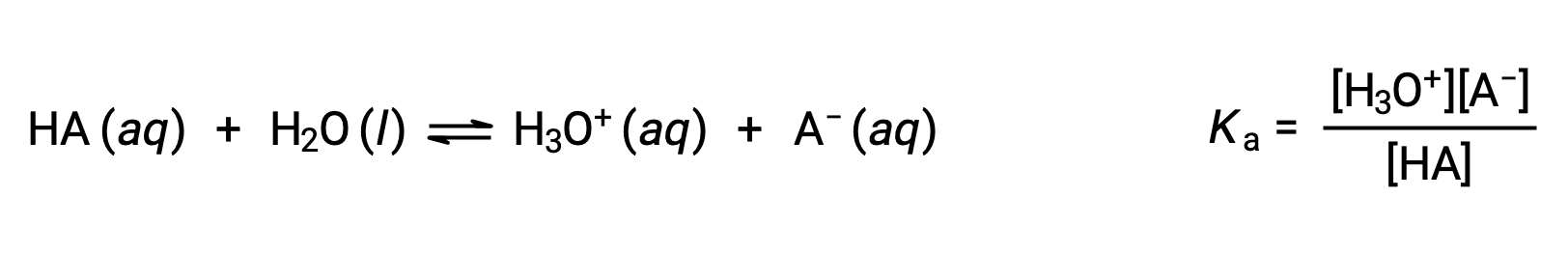
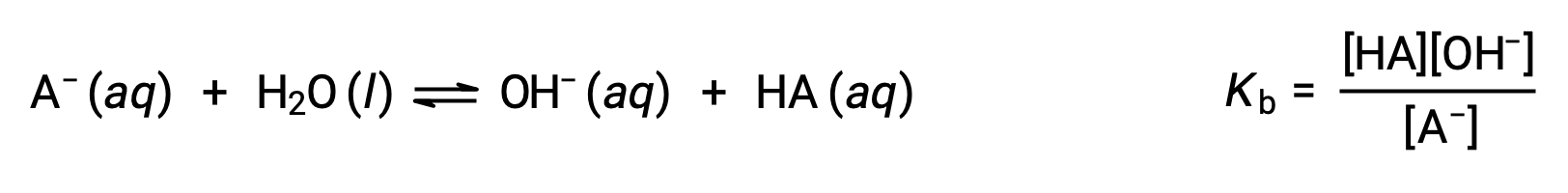
Aggiungendo queste due equazioni chimiche si ottiene l’equazione per l’autoionizzazione per l’acqua:
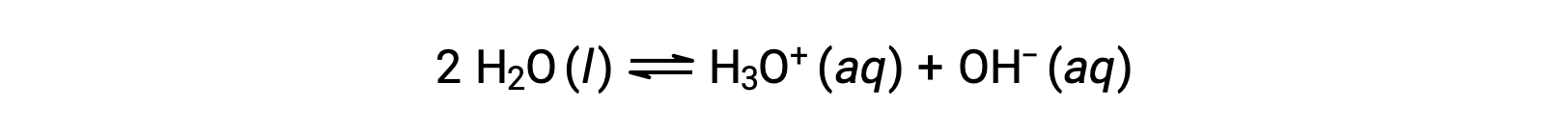
Come accennato in precedenza, la costante di equilibrio per una reazione sommata è uguale al prodotto matematico delle costanti di equilibrio per le reazioni aggiunte, e quindi
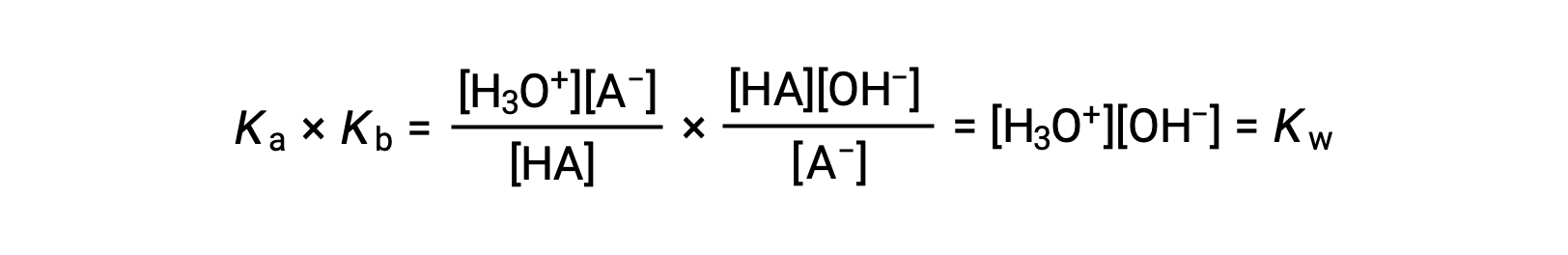
Questa equazione afferma la relazione tra costanti di ionizzazione per ogni coppia acido-base coniugata, vale a dire, il loro prodotto matematico è uguale al prodotto ionico dell’acqua, KW. Riorganizzando questa equazione, diventa evidente una relazione reciproca tra i punti di forza di una coppia acido-base coniugata:
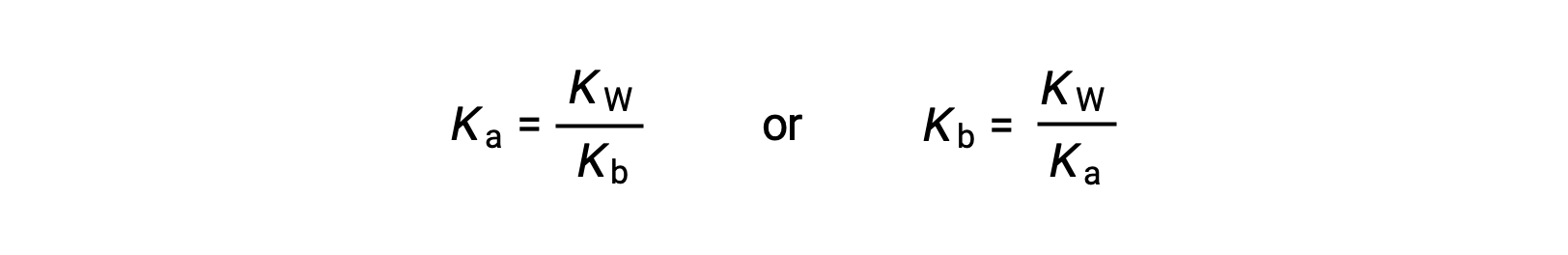
La relazione proporzionale inversa tra Ka e Kb significa che più forte è l’acido o la base, più debole è il suo partner coniugato.
Prendendo il log negativo di entrambi i lati dell’equazione, Ka × Kb = KW yields
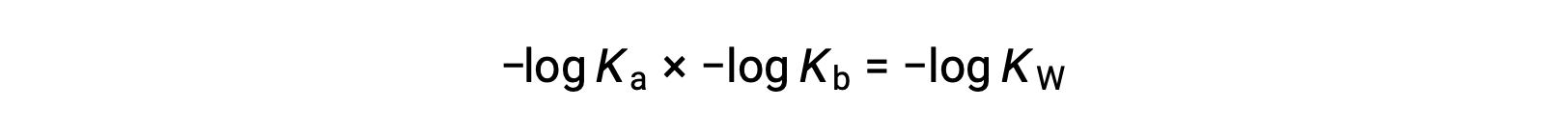
Poi
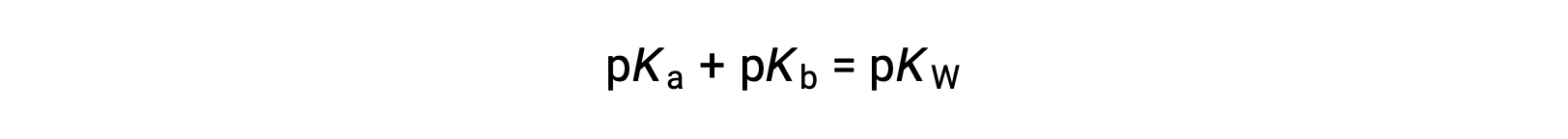
Poiché pKW è 14 a 25 °C, questa equazione può anche essere scritta come
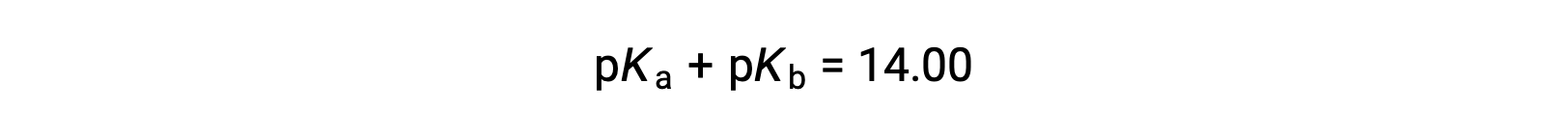
I pKa e pKb rappresentano anche la forza degli acidi e delle basi, rispettivamente. Come pH e pOH, maggiore è il valore pKa o pKb, più debole è rispettivamente l’acido o la base.
| Acido | Base |
| Acido perclorico (HClO4)* | Ione perclorato (ClO4−)** |
| Acido solforico (H2SO4)* | Ione solfato di idrogeno (HSO4−)** |
| Ioduro di idrogeno (HI)* | Ione ioduro (I−)** |
| Bromuro di idrogeno (HBr)* | Ione bromuro (Br−)** |
| Cloruro di idrogeno (HCl)* | Ione cloruro (Cl−)** |
| Acido nitrico (HNO3)* | Ioni nitrati (NO3−)** |
| Ioni di idronio (H3O+) | Acqua (H2O) |
| Ione solfato di idrogeno (HSO4−) | Ione solfato (SO42−) |
| Acido fosforico (H3PO4) | Ione fosfato diidrogeno (H2PO4−) |
| Fluoruro di idrogeno (HF) | Ione fluoruro (F−) |
| Acido nitroso (HNO2) | Ione nitrito (NO2−) |
| Acido acetico (CH3CO2H) | Ione acetato (CH3CO2−) |
| Acido carbonico (H2CO3) | Ione carbonato di idrogeno (HCO3−) |
| Idrogeno solforato (H2S) | Ione solfuro di idrogeno (HS−) |
| Ione ammonio (NH4+) | Ammoniaca (NH3) |
| Acido cianidrico (HCN) | Ione cianidrico (CN−) |
| Ione carbonato di idrogeno (HCO3−) | Ione carbonato (CO32−) |
| Acqua (H2O) | Ione idrossido (OH−) |
| Ione solfidro di idrogeno (HS−)† | Ione solfuro (S2−)‡ |
| Etanolo (C2H5OH)† | Ione etossico (C2H5O−)‡ |
| Ammoniaca (NH3)† | Ione ammide (NH2−)‡ |
| Idrogeno (H2)† | Ione idruro (H−)‡ |
| Metano (CH4)† | Ione metilide (CH3−)‡ |
| *Sottoporsi a ionizzazione acida completa in acqua | |
| † Non subisce ionizzazione acida in acqua | |
| **Non subisce ionizzazione di base in acqua | |
| ‡ Sottoporsi a ionizzazione di base completa in acqua | |
L’elenco delle coppie acido-base coniugato mostrate è disposto per mostrare la forza relativa di ogni specie rispetto all’acqua. Nella colonna acida, le specie elencate sotto l’acqua sono acidi più deboli dell’acqua. Queste specie non subiscono ionizzazione acida nell’acqua; non sono acidi di Brønsted-Lowry. Tutte le specie sopra elencate sono acidi più forti, che trasferiscono protoni in acqua in una certa misura quando vengono sciolti in una soluzione acquosa per generare ioni di idronio. Le specie al di sopra dell’acqua ma al di sotto dello ione idronio sono acidi deboli, sottoposti a ionizzazione acida parziale, mentre quelli al di sopra dello ione idronio sono acidi forti che sono completamente ionizzati in soluzione acquosa.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 14.3: Punti di forza relativi di acidi e basi.
