16.2:
المحاليل المنظِّمة
16.2:
المحاليل المنظِّمة
يُطلق على المحلول الذي يحتوي على كميات ملحوظة من زوج ضعيف ومتقارن من حمض-قاعدة باسم المحلول المنظِّم، أو المنظِّم. تقاوم المحاليل المنظّمة التغير في درجة الحموضة عند إضافة كميات صغيرة من حمض قوي أو قاعدة قوية. محلول من حمض الخل وخلات الصوديوم مثال على المحلول المنظّم الذي يتكون من حمض ضعيف وملحه: CH3COOH (aq) + CH3COONa (aq). مثال على المحلول المنظّم الذي يتكون من قاعدة ضعيفة وملحها هو محلول من الأمونيا وكلوريد الأمونيوم: NH3 (aq) + NH4Cl (aq).
How Buffers Work
كيفية عمل المحاليل المنظّمة
لتوضيح وظيفة المحلول المنظم، ضع في اعتبارك مزيجاً من كميات متساوية تقريباً من حمض الخل وخلات الصوديوم. إن وجود زوج متقارن وضعيف من حمض-قاعدة في المحلول يضفي القدرة على تحييد كميات متواضعة من حمض أو قاعدة قوية مضافة. على سبيل المثال، ستؤدي إضافة قاعدة قوية إلى هذا المحلول إلى معادلة أيون الهيدرونيوم وتحويل توازن تأين حمض الخل إلى اليمين، واستعادة تركيز H3O+ concentration:
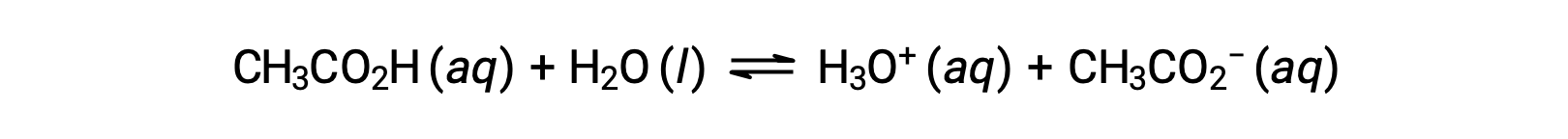
وبالمثل، فإن إضافة حمض قوي إلى هذا المحلول المنظم سيعادل أيون الخلّات، ويحول توازن التأين أعلاه إلى اليمين ويعيد [H3O+] إلى ما يقارب من قيمته الأصلية. يقدم الشكل 1 توضيحاً رسومياً للتغييرات في المحلول المنظم عند إضافة حمض قوي وقاعدة. إن آلية التنظيم للمحلول هي في الأساس نتيجة تحوّل الحمض القوي والقاعدة المضافين إلى حمض ضعيف وقاعدة واللذان يشكّلان الزوج المتقارن للمحلول المنظّم'. مقارنةً بالتأيّن الكامل للحمض القوي والقاعدة، فإن الحمض الأضعف والقاعدة يخضعان لتأيّن طفيف فقط. لذلك، تتأثّر قيمة الرقم الهيدروجيني (pH) للمحلول بشكل أقل بكثير مما عليه الحال في المحلول غير المخفف.
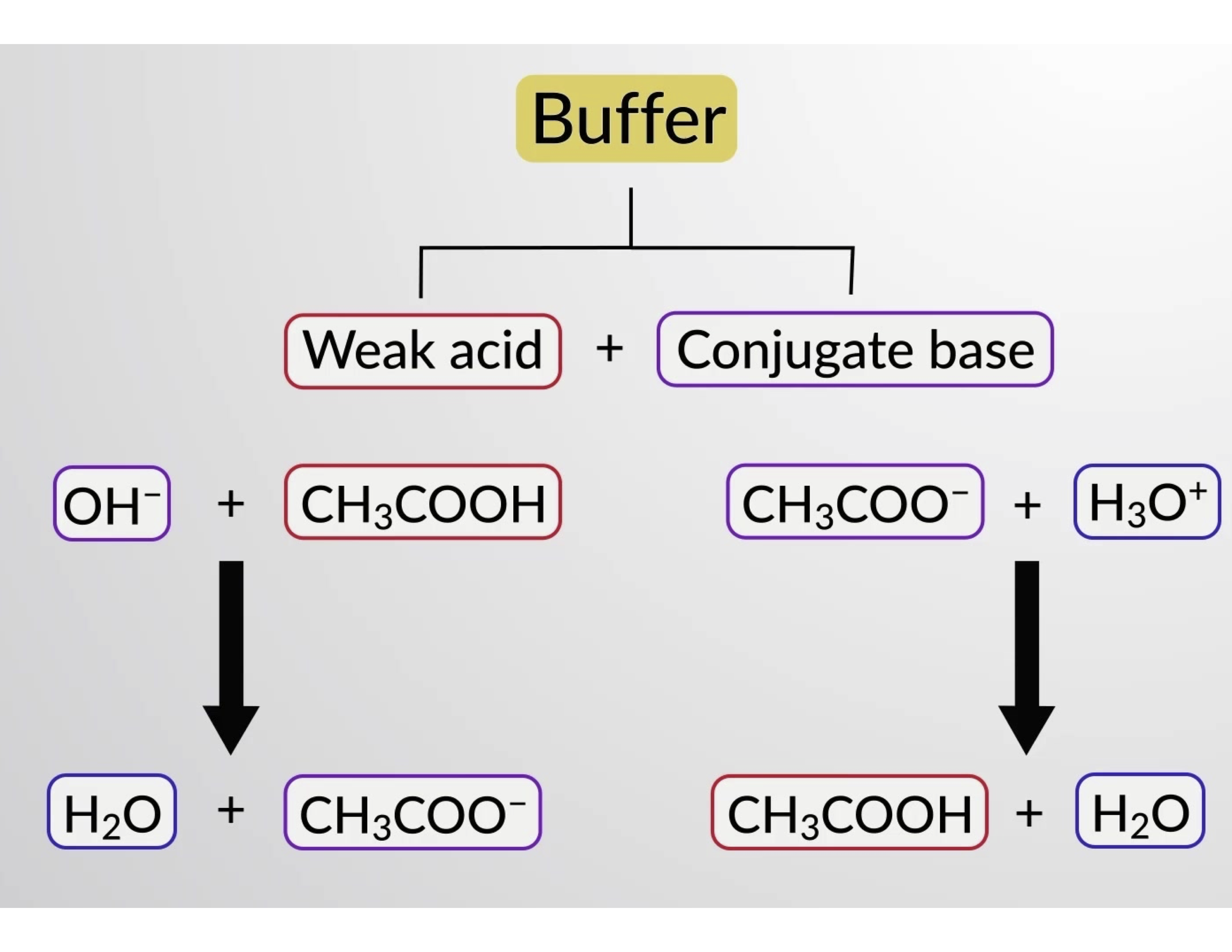
الشكل1. عمل المحلول المنظّم في خليط من حمض الخل وملح الخلّات.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 14.6: Buffers.
